|
СОДЕРЖАНИЕ 1. ОСОБЕННОСТИ ЭЛЕКТРОХИМИЧЕСКИХ ИЗМЕРЕНИЙ: МАТЕРИАЛЫ И МЕТОДЫ 2. ТРАДИЦИОННЫЕ МЕТОДЫ ИЗУЧЕНИЯ ЛЕКАРСТВ: КРАТКИЙ ОБЗОР 3. ЭЛЕКТРОХИМИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ Рисунок 2 Схема электрохимического окисления ацетаминофена (парацетамола). Рисунок 4 Схема электрохимического окисления диклофенака. Рисунок 6 Схема электрохимического окисления ибупрофена. Рисунок 8 Химическая структура эритромицина. Рисунок 9 Химическая структура омепразола. Рисунок 11 Дизайн электродов, получаемых методом трафаретной печати. Таблица 1Электроаналитические характеристики лекарственных препаратов. |
Методы анализа лекарственных препаратов 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121 Москва, ул. Погодинская, 10; *e-mail viktoria.shumyantseva@ibmc.msk.ru 2Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, Москва, ул. Островитянова, 1 Ключевые слова: электроанализ; лекарственные препараты; диклофенак; ибупрофен; ацетаминофен; эритромицин DOI: 10.18097/BMCRM00110 ВВЕДЕНИЕ
Анализ лекарственных препаратов представляет собой активно развивающуюся область аналитической химии, биохимии, нанотехнологий, нанобиотехнологий и различных технологических платформ. Аналитические методы анализа лекарственных средств необходимы на различных стадиях дизайна новых лекарственных средств, исследовании их стабильности и контроля качества, изготовлении рецептурных форм, получения новых систем доставки лекарственных средств, исследовании фармакокинетики и фармакодинамики, метаболических биотрансформаций ксенобиотиков, проведении доклинических и клинических испытаний. Лекарственные препараты могут быть проанализированы для выявления контрафактной продукции, наличия примесей, установления концентрации, проверки загрязнений сточных вод, а также для исследования каталитической активности ферментов, метаболизирующих лекарственные препараты. В данной работе основное внимание уделено обсуждению электрохимических методов количественного анализа лекарственных средств. Приведены примеры анализа лекарственных препаратов диклофенака (вольтарен), ибупрофена (нурофен), ацетаминофена (парацетамол), эритромицин, омепразол на основе электрохимических реакций. 1. ОСОБЕННОСТИ ЭЛЕКТРОХИМИЧЕСКИХ ИЗМЕРЕНИЙ: МАТЕРИАЛЫ И МЕТОДЫ
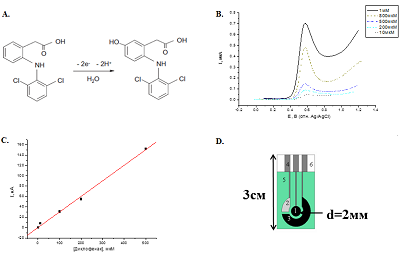
Электрохимические измерения можно проводить с использованием потенциостата PGSTAT 12 Autolab, («Metrohm Autolab», Нидерланды) с программным обеспечением GPES, (версия 4.9.7) и PGSTAT 312N Autolab с программным обеспечением NOVA (версия 2.0). В работе используются трехконтактные электроды, полученные методом трафаретной печати («КолорЭлектроникс», Россия); с графитовыми рабочим и вспомогательным электродами и хлорсеребряным электродом сравнения. Диаметр рабочего электрода 0.2 см (площадь 0.0314 см2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (Ag/AgCl). Для электроанализа лекарственных препаратов рабочий электрод модифицируют дисперсией многостенных углеродных нанотрубок (УНТ) или графена (1 мг/мл). В данной работе использовали метод нековалентной функционализации печатного графитового электрода углеродными наноматериалами. Для осуществления модификации на поверхность рабочего графитового электрода наносят 2 мкл суспензии углеродных наноматериалов с концентрацией 1 мг/мл в водных растворах полимерных материалов [1] (Статья с подробным описанием приготовления стабильных дисперсий углеродных наноматериалов готовится к печати). После этого электроды 15 мин выдерживают при температуре 37˚C до высыхания жидкости на поверхности рабочего электрода. Электроанализ лекарственных препаратов проводят в горизонтальном режиме измерений, при нанесении 60 мкл анализируемой пробы в 0.1 М калий фосфатном буфере (рН 7.4) содержащем 0.05 М NaCl. Для расчета чувствительности и предела определяемых концентраций следует строить зависимость тока пика окисления аналита (лекарственного средства) от его концентрации на основе экспериментально получаемых вольтамперограмм (Рис. 1). На графике выделяют диапазон, в котором зависимость имела линейный характер. Полученные калибровочные зависимости используют для расчета чувствительности (формула 1) и предела определяемых концентраций (формула 2).
2. ТРАДИЦИОННЫЕ МЕТОДЫ ИЗУЧЕНИЯ ЛЕКАРСТВ: КРАТКИЙ ОБЗОР Традиционные стандартные методы оценки качества лекарственных препаратов включают спектрофотометрию в УФ, видимой и средней ИК-области, флуоресцентные методы (в сочетании с модификациями квантовыми точками для визуализации) [2-5], спектроскопию ядерного магнитного резонанса [5] высокоэффективную жидкостную хроматографию (ВЭЖХ, HPLC) [6-9], газовую хроматографию [10], иммуноанализ (анализ с применением соответствующих антител) [11], различные модификации масс-спектрометрических методов [12-14], а также комбинации методов, такие как HPLC/UV детектирование [15], HPLC-MS/MS анализ [16]. Современным направлением спектрофотометрии, используемым для анализа сложных многокомпонентных смесей лекарственных средств, является хемометрические подходы с привлечением математической обработки спектров, например, методом главных компонент [17]. Для анализа макролидных, тетрациклиновых и пептидных антибиотиков используется планарная тонкослойная хроматография (ТСХ) [18]. Высокоэффективная жидкостная хроматография (ВЭЖХ, HPLC) за последние десятилетия во многом определила заметный прогресс в фармации и практической медицине. ВЭЖХ как универсальный и высокочувствительный метод анализа, позволяет одновременно осуществлять контроль за содержанием нескольких лекарственных веществ, вспомогательных компонентов и возможных токсичных примесей в многокомпонентных системах, отличаясь при этом высокой точностью и воспроизводимостью [6-9]. Масс-спектрометрия – метод анализа, позволяющий определить молекулярную массу, молекулярную формулу и строение вещества. Его отличают высокая селективность, чувствительность и точность. Масс-спектрометрический метод анализа основан на ионизации молекул веществ, разделении ионов с разным отношением массы m к заряду z (m/z) и их регистрации [14]. Абсолютная чувствительность характеризует минимальное количество вещества в граммах или молях, необходимое для получения масс-спектра, относительная чувствительность - способность прибора определять данный компонент в смеси. Абсолютная чувствительность современных масс-спектрометров составляет 10−14 – 10−12 г, в некоторых случаях этот показатель может быть еще меньше. Так, при использовании ионизации электрораспылением качественный масс-спектр можно получить при наличии 10 пг/л [16]. С помощью масс-спектрометрии можно анализировать высокомолекулярные соединения (белки, полипептиды, синтетические полимеры, композиции для адресной доставки лекарств) [12-14]. Масс-спектрометрия может быть применена для работы с биологическими жидкостями с целью терапевтического лекарственного мониторинга. К недостаткам метода относится то, что анализируемое вещество должно обладать достаточной способностью к ионизации (летучестью) и термической стабильностью, а также отсутствие или низкая интенсивность в спектрах многих соединений сигнала молекулярного иона затрудняет идентификацию. Кроме того, анализ многокомпонентных систем сопряжен со сложной идентификацией целевого лекарственного средства в анализируемом образце. Для анализа качества лекарственных препаратов активно внедряются экспресс-методы [19-20]. Применение экспресс-методов необходимо также в связи с присутствием на фармацевтическом рынке лекарственных веществ, не отвечающих нормативным требованиям, включая контрафактную продукцию. Трудоемкость анализа и возможная погрешность при сопоставлении результатов, полученных в разных лабораториях и на разном оборудовании, диктуют необходимость применения более универсальных, экономичных и экспрессных методов контроля. 3. ЭЛЕКТРОХИМИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ Электрохимический анализ является строго количественным, что позволяет рассчитать количество электроактивного соединения в пробе. Электроанализ с использованием наноматериалов, которые относятся, по современной терминологии, к «передовым, продвинутым материалам» (advanced materials), является одним из наиболее чувствительных, экономичных и информативных методов в современной аналитической химии, биохимии, фармакологии [19-21]. Электроанализ лекарственных препаратов основан на реакции присоединения/отдачи электронов, поставляемых электродом (реакции электроокисления/электровосстановления) и регистрации концентрационно-зависимой амплитуды тока при потенциале окисления/восстановления препарата [22, 23] (рис. 1). Для проведения электроанализа возможно использование различных типов стационарных электродов: стеклоуглеродных, графитовых, золотых, допированных бором алмазных. Широко используются 3-х контактные печатные электроды - одноразовые, промышленно выпускаемые графитовые электроды, получаемые последовательным нанесением на пластиковую основу проводящих слоев и изоляции методом трафаретной печати (ПГЭ). Алгоритм анализа лекарственных препаратов с использованием электродов, получаемых методом трафаретной печати, заключается в проведении эксперимента в горизонтальном режиме измерений, что позволяет использовать минимальное количество пробы (60 мкл анализируемого раствора). Нами были проанализированы лекарственные препараты с различным фармакологическим действием: ацетаминофен, диклофенак, ибупрофен, эритромицин, омепразол. Самым востребованным классом лекарственных препаратов, используемых современной медициной, являются обезболивающие средства. При всем разнообразии лекарств, представленных на современном фармакологическом рынке, спектр лекарственных средств, обладающих прямым обезболивающим действием, не столь велик и ограничивается, по сути, тремя группами лекарственных препаратов. Это ацетаминофен (парацетамол), нестероидные противовоспалительные препараты (НПВП) и опиоидные анальгетики. Ацетаминофен (парацетамол, N –ацетил-п-аминофенол) – слабая органическая кислота с рК = 9.5 (рис. 2).
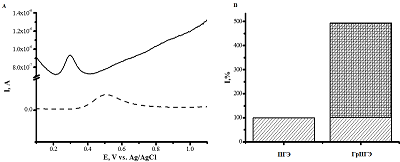
Использование углеродных наноматериалов (углеродных нанотрубок, оксида графена, графена, допированного азотом) позволяет повысить аналитические характеристики сенсорных систем. Наиболее чувствительный сенсор с пределом определяемых концентраций ацетаминофена до 9 х 10-12 М и широким диапазоном 0.0002 – - 15 мкМ описан в работе [24]. Авторы использовали стеклоуглеродный электрод, модифицированный многостеночными углеродными нанотрубками. Для модификации электродов широко используют стабильные дисперсии многостеночных углеродных нанотрубок и графена, допированного азотом в различных полимерных композициях (полиаллилдиметиламмоний хлорид (PDDA)/полистирол сульфонат (PSS), хитозан, ионные и полиионные жидкости [1, 19, 25]. Наиболее значимыми свойствами, определяющими возможность использования ионных жидкостей при создании электрохимических систем, являются ионная проводимость, гидрофобность, вязкость и большая ширина электрохимического «окна» т.е. разность анодного и катодного потенциала окислительно-восстановительного процесса фонового электролита [25]. При использовании ПГЭ электроокисление ацетаминофена регистрируется при потенциале 0.5 В, при модификации ПГЭ дисперсией графена, допированного азотом, электроокисление ацетаминофена регистрируется при потенциале 0.25 ÷ 0.35 В. Смещение окислительного потенциала в отрицательную область свидетельствует о более энергетически выгодном электродном процессе (hис. 3А) Диапазоны определяемых концентраций ацетаминофена составляют 10 – 100 мкM и 100 – 1000 нM, что лежит в физиологических пределах лекарственных препаратов в биологических жидкостях [26].
Модификация нанокомпозитным материалом на основе графена, допированного азотом, существенно повышает чувствительность сенсорной системы (Рис. 3Б). Регистрируемая амплитуда анодного тока для модифицированного электрода (ГрПГЭ) возрастает в 5 раз. Диклофенак («Вольтарен», «Вурдон», «Диклак», «Диклоберл», «Диклофенак», «Диклофенак Ретард», «Долекс», «Клодифен», «Наклофен», «Олфен», «Ортофен») – нестероидный противовоспалительный препарат (НПВП) из группы производных фенилуксусной кислоты[27]. В лекарственных формах используется в виде натриевой соли. Диклофенак назначают при многих заболеваниях, таких как ревматоидный артрит, остеоартрит, различные воспалительные процессы [28]. В некоторых случаях этот препарат может вызывать нежелательные побочные (явления) эффекты, такие как повышение артериального давления у пациентов с синдромом Шая-Драгера и сахарным диабетом, а также желудочные кровотечения или перфорацию. При длительном приеме диклофенака может развиться инфаркт или инсульт [29]. В связи с этим анализ диклофенака и его метаболитов в биологических жидкостях является активно развивающейся областью биоаналитической химии. Электрохимические методы анализа диклофенака основаны на вольтамперометрическом анализе (квадратно-волновая или дифференциальная импульсная вольтамперометрия) с использование модифицированных электродов [20-22]. Схема электрохимического окисления диклофенака приведена на рисунке 4. При модификации углеродными наноматериалами (углеродные нанотрубки, графен, оксид графена) электроокисление происходит при потенциале 0.5 ÷ 0.6 В (рис. 5) [30]. Диапазоны определяемых концентраций диклофенака составляют 1 – 1000 нМ и 10 – 100 мкM.
Ибупрофен ((RS)-2-(4-изобутилфенил)-пропионовая кислота) – НПВП из группы производных пропионовой кислоты, обладает болеутоляющим и жаропонижающим действием [32]. В России ибупрофен зарегистрирован под торговым названием «Нурофен». Этот препарат обладает хорошей переносимостью и малым риском развития осложнений, а также оказывает жаропонижающие и противовоспалительные эффекты, что позволяет его широко использовать в клинической практике [33]. Механизм электрохимического окисления ибупрофена представлен на рисунке 6.
Сложность электроанализа ибупрофена заключается в том, что электроокисление происходит в области положительных потенциалов (часто больше 1 В) [31], что на пределе диапазона потенциалов графитовых электродов, получаемых методом трафаретной печати. Модификация графитового электрода дисперсией УНТ в хлороформе приводит к существенному смещению потенциала окисления ибупрофена в область отрицательных потенциалов (от 1.3 В до 1.0 В), а также к увеличению амплитуды окислительного пика, что свидетельствует о улучшении электронно-транспортных свойств электрода. Диапазон определяемых концентраций составляет 0.5 – 10 мМ (рис. 7). Эритромицин относится к классу макролидных антибиотиков, применяется при лечении грамположительных и грамотрицательных бактериальных инфекций, широко используется в животноводстве [34]. Этот антибиотик используется также в случае непереносимости антибиотиков пенициллинового ряда [35, 36]. Механизм электрохимического окисления эритромицина (рис. 8) и заключается в постадийном двухэлектронном окислении N-метильной группы [34, 35]. Для электрохимической регистрации эритромицина используют модифицированные углеродными наноматериалами электроды. Наночастицы ацетилена черного (Acetylene black nanoparticle) применены для модификации стеклоуглеродного электрода (СУЭ/АБ). Наночастицы ацетилена черного представляют собой материал с пористой структурой, большой поверхностью, хорошей электропроводностью и высокими адсорбционными свойствами. Регистрация эритромицина по окислительному пику при 0.77 В продемонстрирована в диапазоне концентраций 0.2 – 10 мкM [35]. Омепразол (omeprazole, Омез) (рис. 9) лекарственное средство, угнетающее секрецию желудочной кислоты (относится к ингибиторам протонной помпы) и используемое при лечении язв желудка часто совместно с макролидными антибиотиками эритромицином или кларитромицином для угнетения Helicobacter pylori [37]. Показана возможность регистрации омепразола с помощью электроанализа [38, 39]. В наших экспериментах при использовании электродов, модифицированных стабильными дисперсиями УНТ, электроокисление омепразола наблюдается при потенциале 0.70 В (рис. 10). Диапазон определяемых концентраций составляет 20 мкМ ÷ 1 мМ.
Сравнительные характеристики параметров электроокисления лекарственных препаратов приведены в Таблице 1 (Шумянцева В.В. и др., готовится к публикации).
Электрохимические ячейки могут быть сопряжены c масс-спектрометрами. Принцип анализа заключается в том, что электрохимическая ячейка моделирует процесс ферментативных метаболических превращений, а последующий анализ с помощью масс-спектрометрии позволяет установить структуру соединения [40]. В цитируемом обзоре приведены примеры исследования цитохром Р450-моделирования метаболизма митоксантрона (mitoxantrone). Показано образование метаболитов, аналогичных метаболитам в микросомах печени мышей и человека [40, 41]. Электроокисление лекарственных препаратов - субстратов цитохромов Р450 разработано нами для анализа каталитической активности этого класса гемопротеинов. Изменение (уменьшение) концентрации субстрата при электрокатализе цитохрома Р450 позволяет количественно оценить скорость метаболизма субстрата и рассчитать кинетические параметры цитохром Р450-зависимых ферментативных реакций [42, 43]. Для рутинных электрохимических измерений могут быть использованы коммерчески доступные портативные микропотенциостаты с программным обеспечением. Размеры таких портативных микропотенциостатов 13.2 cm x 10.0 cm x 3.6 cm, 12.5 x 9.5 x 4 см, 8.0 cm x 5.4 cm x 2.3 cm (http://www.dropsens.com). Анализ лекарственных препаратов может быть проведен с использованием взаимозаменяемых электродов, производимых методом трафаретной печати [44]. Электроды могут иметь различную конфигурацию, размер и материал рабочего (индикаторного) электрода, что расширяет возможности электроанализа (Рис. 10). Количественный анализ лекарственных средств является актуальной областью развития различных методов аналитической химии, биохимии, нанотехнологий, а также фарминдустрии и фармпроизводства. В статье показана значимая роль электроанализа в таких исследованиях как инструмента для оценки качества и чистоты препаратов, а также для исследования биохимических и кинетических особенностей поведения лекарств как субстратов ферментативных и биорецепторных систем. ФИНАНСИРОВАНИЕ Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-04-00374 и Программы фундаментальных научных исследований государственных академий наук на 2013 – 2020 гг. ЛИТЕРАТУРА
|