|
СОДЕРЖАНИЕ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 1 Дизайн электродов различной конфигурации, получаемых методом трафаретной печати. Рисунок 3 Принцип электрохимического анализа нуклеиновых кислот Адаптировано из [11]. Рисунок 9 Схема фунционализации электродов для проведения электроанализа. Таблица 1Аналитические характеристики химически модифицированных электродов для анализа биообъектов |
Подготовка электрохимических биосенсорных систем для анализа биообъектов: обоснованный выбор модификаций рабочей поверхности электродов для проведения исследований в режиме «смарт-электродов»
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: электроанализ; углеродные нанотрубки; наночастицы металлов; полимерные композитные материалы; одномерные структуры; биосенсоры DOI: 10.18097/BMCRM00119 ВВЕДЕНИЕ
Электрохимические методы в биомедицинских исследованиях основаны на регистрации процессов, происходящих при получении или отдаче электронов биологическими молекулами. Их отличительной особенностью является то, что это количественные методы, которые позволяют рассчитать количество электроактивного биокомпонента в пробе. Измерительные устройства, необходимые для такого рода исследований, относительно недороги и могут быть как стационарными для проведения фундаментальных исследований и работы в научно-исследовательских организациях, так и портативными для проведения анализов в «полевых» условиях. Для электроанализа биообъектов, в том числе для повышения его чувствительности, рабочий электрод модифицируют различными системами. Электроанализ с использованием наноматериалов, которые относятся по современной терминологии к «передовым, продвинутым материалам» (advanced materials), является одним из наиболее чувствительных, экономичных и информативных методов в современной аналитической химии, биохимии, фармакологии [1–3]. Электроанализ основан на реакции присоединения/отдачи электронов, поставляемых электродом (реакции электроокисления/электровосстановления) и регистрации концентрационно-зависимой амплитуды тока при потенциале окисления/восстановления биообъекта [4, 5]. Регистрируя зависимость тока, протекающего через рабочий электрод, находящийся в контакте с электроактивным веществом, от разности потенциалов между рабочим электродом и электродом сравнения, можно получить данные о концентрации электроактивного вещества, кинетике и термодинамике электрохимической реакции. Для повышения чувствительности сенсорных систем применяют различные электроаналитические методы: циклическую (ЦВА), квадратно-волновую (КВВА), дифференциально-импульсную (ДИВА), инверсионную вольтамперометрию (ИВА). Для проведения электроанализа возможно использование различных типов стационарных электродов: стеклоуглеродных, графитовых, золотых, допированных бором алмазных. Широко используются 3-х контактные печатные электроды (ПГЭ) - одноразовые, промышленно выпускаемые графитовые электроды, получаемые последовательным нанесением на пластиковую основу проводящих слоев и изоляции методом трафаретной печати. ПГЭ позволяют работать в широком диапазоне рабочих потенциалов (как правило, -1.5 ÷ +1.5В) использовать разнообразный спектр модификаций и методов получения химически модифицированной рабочей поверхности электрода [6, 7]. Электроды, в том числе получаемые методом трафаретной печати, могут иметь различную конфигурацию, размер и материал рабочего (индикаторного) электрода, что расширяет возможности электроанализа (рис. 1). В данной работе описаны системы и материалы для модификации ПГЭ, а также методы получения модифицированных электродов для усиления регистрации электрохимического сигнала биохимических процессов на поверхности электродов и повышения порога чувствительности в электроанализе различных биообъектов.
1. МАТЕРИАЛЫ И МЕТОДЫ В данном разделе приведены методические подходы, использованные нами для анализа изоформ цитохрома Р450, миоглобина, кардиомаркеров, а также для анализа ДНК. Электрохимические измерения проводят с использованием потенциостата PGSTAT 12 Autolab, μAutolab Type III («Metrohm Autolab», Нидерланды) с программным обеспечением GPES (версия 4.9.7) и PGSTAT 312N Autolab с программным обеспечением NOVA (версия 2.0). В работе используют трехконтактные электроды, полученные методом трафаретной печати («КолорЭлектроникс», Россия); с графитовыми рабочим и вспомогательным электродами и хлоридсеребряным электродом сравнения. Диаметр рабочего электрода составляет 0.2 см (площадь 0.0314 см2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (Ag/AgCl). 1.1. Модификация электрода дидодецилдиметиламмония бромидом для анализа изоформ цитохрома Р450 [8] На поверхность рабочего графитового электрода наносят 2 мкл 0.1 М раствора дидодецилдиметиламмония бромида (ДДАБ) в хлороформе. После испарения хлороформа (10 мин) наносят 1 мкл анализируемого белка соответствующей концентрации. Электроды оставляют при температуре 4˚С на 12 ч в закрытой камере, предотвращающей высыхание пленки белка на модифицированной рабочей поверхности электрода. Перед началом всех электрохимических измерений электроды инкубируют в электролитном (0.1 М KH2PO4 + 0.05 М NaCl) фосфатном буфере (ФБ), pH 7.4, 20 мин при комнатной температуре (22 ± 3°С). Электрохимические измерения в анаэробных условиях проводят в герметично закрытой ячейке с помещенным в нее ферментным электродом. Ячейку заполняют 1 мл электролитного буфера, герметично закрывают, в течение 30 мин пропускают аргон. Измерения в аэробных условиях регистрируют в 1 мл электролитного ФБ. 1.2. Модификация электрода дидодецилдиметиламмония бромидом для анализа изоформ цитохрома Р450 [8] Методика приготовления коллоидного раствора золота (AuНЧ) стабилизированного ДДАБ описана в [10]. На поверхность рабочего графитового электрода наносят 2 мкл 5 мМ коллоидного раствора золота в 0.1 М ДДАБ в хлороформе (ДДАБ/Au), после испарения хлороформа (10 мин) наносят 1 мкл соответствующей изоформы цитохрома Р450. Электроды оставляют при температуре 4°С на 12 ч в закрытой камере, предотвращающей высыхание пленки белка на модифицированной рабочей поверхности электрода. Электрохимические измерения в анаэробных условиях проводят в герметично закрытой ячейке с помещенным в нее ферментным электродом. Ячейку заполняют 1 мл электролитного буфера, герметично закрывают, в течение 30 мин пропускают аргон. 1.3. Модификация электрода дисперсией многостенных углеродных нанотрубок в хлороформе для анализа изоформ цитохрома Р450 [8] На поверхность рабочего графитового электрода наносят 2 мкл дисперсии многостенных углеродных нанотрубок (МУНТ) в хлороформе (1 мг/мл, ультразвуковая дезинтергация 5 мин). После испарения хлороформа (10 мин) наносят 1 мкл анализируемого белка соответствующей концентрации. Электроды оставляют при температуре 4°С на 12 ч в закрытой камере, предотвращающей высыхание пленки белка на модифицированной рабочей поверхности электрода. 1.4. Модификация электрода дисперсиями МУНТ в полимерных композитных материалах Синтез полиионных жидкостей (ПИЖ) для получения стабильных дисперсий МУНТ описан в [11]. В водные растворы с концентрацией 3 г/л поли(1-этил-3-винилимидазолийбромида) и поли(1-бутил-3-винилимидазолийбромида) добавляют МУНТ таким образом, чтобы каждый 1 мл раствора ПИЖ содержал 1 мг углеродного материала. Дисперсии МУНТ (1 мг/мл) в водных растворах ПИЖ получают ультразвуковой дезинтеграцией 100 Вт при мощности 20% в импульсном режиме. Для электроанализа ДНК рабочий электрод модифицируют 2 мкл соответствующей дисперсией МУНТ в ПИЖ (1 мг/мл). Электроды оставляют при температуре 37˚С на 15 мин до полного высыхания. Иммобилизацию аналита проводят в горизонтальном режиме, при нанесении 2 мкл анализируемой пробы в 0.1 М ФБ (рН 7.4), электроды инкубируют при температуре 37°С 15 мин до полного высыхания. Модифицированные электроды хранят при температуре 4°C до измерения в тот же день. ЦВА проводят в электрохимической ячейке объемом 1 мл. Эксперименты с ДИВА проводят в горизонтальном режиме в объеме 60 мкл электролитного буфера. 1.5. Модификация электрода МУНТ и ионным амфифильным (мицеллообразующим) диблок-сополимером (полибутадиен-блок-поли(2-(N,N-диметиламино)этилметакрилат), PB290-b-PDMAEMA240) для анализа миоглобина (Mb) [12] Для анализа Mb была использована следующая схема. ПГЭ модифицировали полимером полибутадиен-блок-поли(2-(N,N-диметиламино)этилметакрилат) (PB290-b-PDMAEMA240) - 2 мкл раствора полимера с концентрацией 2 мг/мл в 0.1 М ФБ, pH 8.2, затем дисперсией МУНТ в хлороформе, 2 мкл (1 мг/мл, ультразвуковая дезинтергация 1 мин, 38 Вт). Для изготовления электрохимических иммуносенсоров 1 мкл антител к Mb (105 нг/мкл в 0.1 М ФБ, рН 7.4) иммобилизуют на ПГЭ/МУНТ/PB290-b-PDMAEMA240. Электроды оставляют на ночь при температуре 4°С. Анализ связывания Mb с иммобилизованными антителами проводят по [12]. ЦВА проводят в электрохимической ячейке объемом 1 мл. Эксперименты с КВВА проводят в горизонтальном режиме в объеме 60 мкл электролитного буфера. Дисперсии МУНТ в полианионом амфифильном поли-н-бутилакрилат-блок-полиакриловой кислоты (PnBA100-b-PAA140) диблок-сополимере были приготовлены аналогично и использованы для анализа цитохрома с [13]. Приготовление дисперсий МУНТ в поликатионных полимерах на основе поли-н-бутилметакрилат-блок-поли(диметиламино)этилметакрилат), (PnBMA(X)-b-PDMAEMA(Y)) для анализа ДНК будет описано в статье, подготовленной к печати (Shumyantseva et al., подготовлено к печати).
1.6. Модификация электрода коллоидными AuНЧ и AgНЧ, полученными химическим синтезом (ПГЭ/Auх/ДДАБ, ПГЭ/Agх/ДДАБ) для анализа кардиомаркеров [14] Коллоидные растворы серебра (золота) готовят следующим образом: к 1 мл 0.1 М ДДАБ в хлороформе при интенсивном перемешивании добавляют 0.5 мл 10 мМ водного раствора нитрата серебра AgNO3 (HAuCl4×3H2O тетрахлорзолотой кислоты) соответственно, затем по каплям добавляют 0.2 мл 0.4 М свежеприготовленного боргидрида натрия NaBH4. Через 2 ч окрашенный органический слой, содержащий коллоидные растворы серебра (золота), отделяют от воды. На рабочую поверхность ПГЭ наносят 2 мкл раствора наночастиц Auх или Agх, приготовленных как описано выше, после испарения хлороформа (5 мин) электрод хранят в холодильнике при 4°С. Для приготовления иммуносенсоров на модифицированные Auх или Agх электроды наносят 1 мкл 0.1 М ДДАБ (ПГЭ/Auх/ДДАБ и ПГЭ/Agх/ДДАБ соответственно), электроды высушивают при комнатной температуре в течение 15 мин. Затем наносят 1 мкл раствора антител (Ат) к соответствующему белку-маркёру (ПГЭ/Auх/ДДАБ/Ат, ПГЭ/Agх/ДДАБ/Ат) и высушивают в течение 20 мин при комнатной температуре. Связывание белка (1 мкл аналита) со специфическими Ат проводят в течение 45 мин при 37&odeg;С в термостате. Электрод перед измерением сигнала помещают в электрохимическую ячейку с 1 мл ФБ, pH 7.4 на 30 мин при 37°С. 1.7. Модификация электрода AuНЧ и AgНЧ, полученными электросинтезом (ПГЭ/Auэ/ДДАБ, ПГЭ/Agэ/ДДАБ) для анализа кардиомаркеров [14] Раствор 5 мМ HAuCl4/0.1 М HCl для электросинтеза AuНЧ готовят следующим образом: к 0.003 г HAuCl4, добавляют 150 мкл 1 М HCl. Полученный раствор растворяют в 1.35 мл дистиллированной воды. Раствор 5 мМ AgNO3/0.1 М НNO3 для электросинтеза наночастиц серебра готовят следующим образом: к 8.5 мг нитрата серебра (AgNO3) добавляют 1 мл 1 М НNO3. Полученный раствор растворяют в 9 мл дистиллированной воды. На поверхность ПГЭ (покрывая рабочий электрод, вспомогательный и электрод сравнения) в горизонтальном режиме наносят 60 мкл 5 мМ раствора HAuCl4/0.1 М HCl или 5 мМ раствора AgNO3/0.1 М НNO3 соответственно. Электросинтез проводят в течение 180 с при контролируемом потенциале (относительно Ag/AgCl) -0.5 В для синтеза AuНЧ и 1.2 В для синтеза AgНЧ. После электросинтеза наночастиц металлов поверхность электрода промывают дистиллированной водой и высушивают на воздухе. Иммуносенсоры готовят аналогичным образом, как описано выше для AuНЧ и AgНЧ, полученных химическим синтезом.
1.8. Модификация электрода МУНТ и наночастицами оксида титана (IV) TiO2 для электроанализа белков на основе окисления аминокислотных остатков [15] Для измерения сигнала электроокисления аминокислот в составе белков электроды модифицируют МУНТ, диспергированными в хлороформе (1 мг/мл, ультразвуковая дезинтергация 5 мин) и суспензией наночастиц оксида титана (1 мг в 0.5 мл H2O:C2H5OH, смесь 1:1, ультразвуковая дезинтергация 1 ч). На рабочий электрод наносят 2 мкл суспензии МУНТ в хлороформе, либо 2 мкл суспензии наночастиц оксида титана, после испарения хлороформа (10 мин) наносят 60 мкл исследуемого белка или аминокислоты. Модификацию электрода МУНТ и суспензией наночастиц оксида титана проводят последовательным нанесение 2 мкл суспензии МУНТ и 2 мкл суспензии наночастиц оксида титана. Измерения проводят при комнатной температуре (22 ± 3ºС) в горизонтальном режиме. 1.9. Модификация электрода нанопроводами (одномерными наноструктурами на основе свинца (Pb(OH)2 и нанопроводами на основе свинца с адсорбированными AuНЧ для анализа гемопротеинов (кардиомиоглобина, цитохрома Р450 2В4 и цитохрома с) [16, 17] Синтез нанопроводов на основе свинца (PbНП) проводят по методике [16]. На поверхность рабочего графитового электрода наносят послойно 1 мкл суспензии PbНП (спирт), 1 мкл 5 мМ коллоидного раствора золота в 0.1 М ДДАБ в хлороформе, после испарения хлороформа (10 мин) наносят 1 мкл исследуемого гемопротеина. Электроды оставляют на 12 ч при 4$deg;С во влажной камере, предотвращающей полное высыхание электродов [17]. 2. ЭЛЕКТРОХИМИЧЕСКИЙ АНАЛИЗ При разработке эффективного электрохимического процесса, связанного с переносом электронов, и реализации электрокатализа важную роль играет выбор соответствующей модификации электрода для иммобилизации отличающихся по своим свойствам биообъектов и регистрации электронного транспорта. В качестве модификаторов поверхности электродов используются различные вещества и наноматериалы. В зависимости от цели (анализ маркера патологического процесса, ферментативный катализ, поиск потенциальных субстратов/ингибиторов, анализ фермент-зависимых межлекарственных взаимодействий, образование комплекса лиганд-рецептор) это могут быть: углеродные нанотрубки, графен, оксид графена, наночастицы металлов, липиды, синтетические мембраноподобные вещества, полимерные композиции, имеющие различные заряженные группы. В работе [8] для проявления каталитической активности мембранных форм цитохрома Р450 (рис. 2) было создано соответствующее микроокружение фермента с помощью природных липидов или липидоподобных синтетических соединений, таких как ДДАБ. ДДАБ и ранее применялся в наших работах [18-22] для иммобилизации гемопротеинов или антител на рабочем графитовом электроде в качестве биосовместимой мембраны для удержания и фиксации белков. ДДАБ используют также и для синтеза наночастиц золота в качестве стабилизирующего агента по отношению к коллоидным растворам золота [23, 24].
Результаты исследования каталитических функций и кинетических параметров изоформ цитохромов Р450 показали предпочтительное использование ДДАБ как биосовместимого композиционного материала для модификации электродов, сохраняющего каталитическую активность этого уникального класса гемопротеинов [8]. Включение биосовместимых AuНЧ в пленках ДДАБ увеличивает чувствительность и стабильность электрохимических параметров электродов вследствие получения наноэлектродных систем [9, 25-28]. Модификация ПГЭ/ДДАБ/Au была применена авторами в работах для анализа цитохрома Р450 17А1 [9], цитохромов Р450 2В4, 1А2, 51в1 [23] и для анализа Mb [26]. Включение AuНЧ в модификатор электродной поверхности позволяет иммобилизовать на поверхности электрода антитела [14, 26, 29, 30]. Нековалентная иммобилизация осуществляется за счет взаимодействия SH-групп антител с золотыми наночастицам. Авторами работы [8] была исследована модификация электрода дисперсиями МУНТ в хлороформе. Данная модификация ПГЭ повышает аналитическую чувствительность системы и количество электроактивного белка на электроде на порядок ((2.7 ± 0.2)·10-11 моль гемопротеина/см2 рабочей поверхности электрода для модификации ПГЭ/ДДАБ и (2.6 ± 0.6)·10-10 моль гемопротеина/см2 для модификации ПГЭ/МУНТ). Модификации с помощью углеродных наноматериалов могут быть использованы для аналитического определения цитохромов Р450 в различных биообъектах, включая микросомы, клетки, ткани, бакулосомы, биологические жидкости, орган-специфические цитохром Р450-содержащие экстракты. С помощью полимерных дисперсантов, таких как ПИЖ на основе имидазолия, поли(1-этил-3-винилимидазолийбромида) и поли(1-бутил-3-винилимидазолийбромида), были получены и применены для модификации поверхности ПГЭ высокостабильные дисперсии МУНТ в водных средах. Такая модификация ПГЭ значительно увеличивает электроактивную площадь поверхности и ускоряет скорость переноса электронов за счет синергетического сочетания таких специфических свойств МУНТ, как сильная адсорбционная способность, высокие электронтранспортные свойства и высокая удельная поверхность, с такими преимуществами ПИЖ, как ионная проводимость и способность диспергировать углеродные наноматериалы. Авторами в работе [11] использованы модифицированные ПГЭ/ПИЖ/МУНТ для прямого электрохимического анализа двухцепочечной ДНК (дцДНК) на основе электроокисления гуаниновых и адениновых оснований. На рисунке 3 показан принцип электрохимического анализа нуклеиновых кислот.
Линейные диапазоны определения дсДНК соответствуют 5-500 мкг/мл для окислительного пика гуанина и 0.5 – 50 мкг/мл для окислительного пика аденина (табл. 1, рис. 3).
Электроанализ с использованием модифицированных наноматериалами электродов делает прямое электрохимическое обнаружение дцДНК на ПГЭ/ПИЖ/МУНТ конкурентоспособным с применяемыми в настоящее время спектральными и флуоресцентными методами. Кроме того, авторами показано, что разработанные системы способны распознавать точечную мутацию в 12-членных одноцепочечных олигонуклеотидах [11]. Такое обнаружение мутаций имеет большое клиническое значение при выборе адекватного противоопухолевого лечения, где электрохимическая идентификация точечной мутации может внести свой вклад в персонализированный подход к лечению (рис. 4).
Дисперсии УНТ в хлороформе были использованы для анализа миоглобина [19]. Модификация ПГЭ/УНТ приводит к существенному повышению чувствительности электрода, что делает экспериментально обоснованным анализ миоглобина как кардиомаркера с помощью данной модификации (рис. 5).
Синергический эффект МУНТ в сочетании с ионным амфифильным (мицеллообразующим) диблок-сополимером был отмечен нами ранее в отношении количественного электрохимического детектирования миоглобина [12]. Было показано, что PB290-b-PDMAEMA240 является подходящим материалом для встраивания Mb и облегчает прямой перенос электронов с электрода на гемопротеин. В водных растворах он образует мицеллы, которые при рН = 7 в фосфатном буфере проявляют хорошую адгезию к углеродным материалам и образуют однородные тонкие пленки на гидрофобной графитовой подложке. ЦВА и КВВА вольтамперометрии показали 180-кратное увеличение тока восстановления Mb в матрице ПГЭ/МУНТ/PB290-b-PDMAEMA240 по сравнению с немодифицированным электродом ПГЭ. Таким образом, эти материалы могут быть использованы для конструирования «умных» биосенсоров (смарт-электродов) и для регистрации низких концентраций функционально-значимых гемопротеинов. Чувствительность данной биосенсорной системы достаточна, чтобы охватить весь диапазон концентраций Mb, начиная с нормальной физиологической концентрация сердечного миоглобина человека (10 – 100 нг/мл; 0.56 – 5.6 нм) до уровня Mb у пациентов с инфарктом миокарда (100 – 1780 нг/мл; 5.6 – 100 нм) (табл. 1). Наночастицы металлов могут быть использованы не только для создания системы наноэлектродов на рабочей поверхности электрода, но и как сенсорные элементы [14, 27, 30]. Метод инверсионной вольтамперометрии позволяет зарегистрировать процессы окисления/восстановления самих наночастиц металлов. Изменение микроокружения наночастиц металлов (т.е. присутствие маркера заболевания, например, миоглобина) концентрационно-зависимо меняет интенсивность сигнала. Как было показано в работе [14], наилучшие аналитические характеристики в определении кардиомаркеров показали электрохимические иммуносенсоры на основе наночастиц AuНЧ, полученных электросинтезом, и AgНЧ, полученных химическим синтезом. Аналитическая чувствительность для тропонина I методом ИВА (рис. 6) составила 0.1 нг/мл (4.25 пМ). Диагностическая чувствительность для AuНЧ, полученных электросинтезом, составила 87%, а для AgНЧ, полученных химическим синтезом, – 80%. Таким образом, электрохимические иммуносенсоры на тропонин I на основе AuНЧ, полученных электросинтезом, показали наилучшую аналитическую и диагностическую чувствительности, а также воспроизводимость (91%). Для потенциометрического метода определения тропонина I аналитическая чувствительность составила 18.0 пг/мл (0.8 пМ). Разработанные электрохимические иммуносенсоры на основе AuНЧ, полученных электросинтезом, также показали достаточную аналитическую чувствительность в определении физиологически значимых концентраций белка, связывающего жирные кислоты (0.5 нг/мл (33 пМ); 67%) и кардиомиоглобина (10 нг/мл (0.6 нМ); 86%) (рис. 6, табл. 1).
В работе [15] продемонстрировано, что ПГЭ/МУНТ и ПГЭ/МУНТ/TiO2 показали высокую электрокаталитическую активность и хорошие аналитические характеристики в отношении окисления L-тирозина. При этом электрокаталитическое окисление тирозина с использованием ПГЭ/TiO2 не было эффективным. Причиной данных различий может быть недостаточная электроактивность площади поверхности TiO2 покрытия и низкая проводимость такого наноразмерного покрытия. Электроды, модифицированные ПГЭ/МУНТ и ПГЭ/МУНТ/TiO2 имеют одинаково широкий линейный диапазон определяемых концентраций тирозина от 1 нМ до 0.1 мМ в калий-фосфатном буфере. Поскольку электроокисление тирозина происходит легче на электроде ПГЭ/МУНТ (Е = 0.53 В), данная модификация электрода была использована для определения концентраций тирозина в сыворотке крови человека. Диапазон определяемых концентраций составил 0.025 – 1 мМ (табл. 1). Модификация печатных графитовых электродов с помощью нанопроводов (одномерных наноструктур) на основе свинца с адсорбированными AuНЧ (PbНП/AuНЧ) улучшает такие аналитические характеристики сенсора, как возрастание электроактивной площади поверхности электрода, усиление электрокаталитических свойств и кинетики переноса электронов. Так, в работе [17] показано, что наибольшую электроактивность проявляли электроды ПГЭ/PbНП/AuНЧ (30 %) и ПГЭ/AuНЧ (10 %) с иммобилизованным цитохромом с. При иммобилизации на рабочую поверхность 10-10 моль цитохрома Р450 2В4 электроактивность для ПГЭ/PbНП/AuНЧ, по сравнению с ПГЭ/AuНЧ, так же существенно возрастает, что позволяет электрохимически детектировать с помощью цикловольтамперометрии до 10-12 моль/электрод, а использование дифференциально-импульсной вольтамперометрии позволяет снизить определяемый предел детекции цитохрома Р450 до 10-15 моль/электрод. Такой эффект синергизма может быть связан с переходом AuНЧ в «режим одномерности» за счет выстраивания на одномерных нанопроводах на основе свинца. ПГЭ/PbНП/AuНЧ/Р450 2В4 электроды проявляли также высокую электрокаталитическую активность: при прибавлении бензфетамина – субстрата цитохрома Р450 2В4 – каталитический ток существенно возрастает. Синергизм действия AuНЧ и одномерных структур на основе свинца проявляется и при анализе кардиомиоглобина: интенсивность сигнала возрастает примерно в 10 раз. Электроокисление субстратов цитохрома Р450 (диклофенака) использовано для регистрации ферментативной активности в режиме on-line (рис. 7). Для этого применяют два типа электродов: модифицированный мембраноподобным соединением ДДАБ для проявления каталитической активности цитохрома Р450 и модифицированный дисперсиями углеродных нанотрубок в полимерах (полибутадиен-блок-поли(2-(N,N-диметиламино)этил метакрилат) диблок сополимер PB290-b-PDMAEMA240/MУНТ) для регистрации электроокисления лекарственного препарата – субстрата цитохрома Р450 [31].
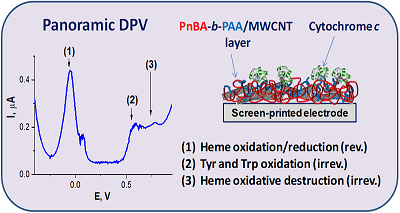
Полимерные материалы, несущие различные функциональные группы, могут быть использованы для иммобилизации биообъектов, отличающихся зарядом молекулы и значениями изоэлектрических точек. Для иммобилизации полианионных молекул ДНК предпочтительно использование поликатионных полимерных модификаторов, таких как полиионные жидкости на основе поли(1-этил-3-винилимидазолийбромида) или поли(1-бутил-3-винилимидазолийбромида) [11]. Дисперсии МУНТ в полимерах на основе полианионого полимера поли-н-бутилакрилат-блок-полиакриловой кислоты (МУНТ/PnBA100-b-PAA140) были использованы для модификации электродов и последующего анализа цитохрома с, имеющего положительный заряд при физиологических значениях рН [13]. Изоэлектрическая точка цитохрома c - pI = 10.1; это свидетельствует о том, что в молекуле преобладают аминокислотные остатки, боковые радикалы которых содержат положительно заряженные (катионогенные) группы при физиологических значениях pH. Такой тип модификации электродов позволяет получить панорамную вольтамперограмму в широком диапазоне потенциалов и регистрировать не только окислительно-восстановительные процессы иона железа гема (в соответствии с реакцией Fe+3 +1e ↔ Fe+2), но и исследовать процессы электроокисления аминокислот полипептидной цепи цитохрома с (тирозина и триптофана), что важно для регистрации функционально значимых посттрансляционных модификаций этого гемопротеина [32] (рис. 8).
Расширение и углубление знаний о строении и функциях белков и пептидов, выявление новых путей развития заболеваний и обнаружение ранних биомаркеров как результат прогресса аналитических и биоинформационных технологий влечет за собой разработку «умных» устройств, доступных для массового использования. Современные биохимия и энзимология нуждаются в эффективных и надежных аналитических методах для оценки состояния биомолекул. На основании рассмотренных в работе данных можно сделать вывод, что функционализация электродной поверхности в зависимости от поставленной цели эксперимента (анализ маркера патологического процесса, ферментативный катализ, поиск потенциальных субстратов/ингибиторов, исследование межлекарственных взаимодействий, анализ конформационных изменений белков, поиск однонуклеотидных замен), в совокупности с выбранным электрохимическим методом анализа позволяет повысить чувствительность электрохимической биосенсорной системы и снизить предел определяемых концентраций, что является основополагающим для конструирования «умных» биосенсоров для электроанализа различных биообъектов (рис. 9).
Электрохимический анализ может с успехом дополнить, а в некоторых случаях и заменить, другие, более трудоемкие и дорогостоящие физико-химические и биохимические методы. Аналитические и сенсорные электрохимические системы перспективны в разработке новых лекарственных средств, терапевтическом мониторинге лекарственных средств и их метаболизма, в персонализированном подходе к эффективной и безопасной терапии. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий наук на 2013 – 2020 гг. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|