|
Биосенсорная селекция низкомолекулярных соединений, модулирующих взаимодействия в системе микросомальных цитохромов Р450 и NADPH-зависимой Р450 оксидоредуктазы
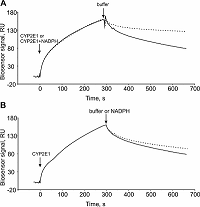
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, ул Погодинская 10; *e-mail: evgeyablokov1988@mail.ru 2Институт биоорганической химии Национальной академии наук Беларуси, Республика Беларусь, 220141, Минск, ул. Купревича, 5/2 Ключевые слова: модуляторы аффинности; модуляторы кинетики; низкомолекулярные соединения; NADPH; цитохром Р450; NADPH-зависимая цитохром Р450 оксидоредуктаза DOI: 10.18097/BMCRM00134 ВВЕДЕНИЕ Соединения с молекулярной массой менее 900 Да непептидной природы (далее – низкомолекулярные соединения, НС) способны оказывать разносторонние эффекты на белковые макромолекулы, образуя с ними стабильные или короткоживущие комплексы. Вследствие такого комплексообразования могут индуцироваться локальные или глобальные конформационные изменения белковой молекулы, что так или иначе отражается на ее способности к комплексообразованию с партнерами по белок-белковому взаимодействию (ББВ). Целенаправленный поиск НС, направленных на зону контакта (интерфейс) двух белков клинически значимого ББВ либо усиливающих, либо дестабилизирующих взаимодействие, представляет собой актуальную ветвь в разработке инновационных лекарственных средств [1-3]. Метаболом организма человека включает большое количество соединений, среди которых есть те, которые способны модулировать аффинность разных белковых комплексов. Это также имеет место и в монооксигеназной системе цитохромов Р450 и их редокс-партнеров: дифлавиновой NADPH-зависимой цитохром Р450-оксидоредуктазы (CPR) и цитохрома b5 (CYB5A). ББВ в системе цитохромов Р450 можно охарактеризовать различными методами. Один из способов оценки влияние НС на ББВ заключается в изменении кинетических параметров этого ББВ в присутствии соответствующих НС. При этом равновесная константа диссоциации ББВ (Kd) представляет собой “статическую” компоненту и не всегда отражает реальный эффект от НС. Кинетические константы (константы скорости ассоциации (kon) и диссоциации (koff)) комплекса являются динамической компонентой и по их изменению можно судить о влиянии НС на ББВ. Поэтому именно определение последних приобретает исключительную ценность при изучении этих процессов. Так, в недавней нашей работе [4] с использованием технологии поверхностного плазмонного резонанса (Surface Plasmon Resonance, SPR) нами было показано, что стероидные субстраты примерно на порядок повышали аффинность комплексообразования цитохрома Р450 17А1 (CYP17A1) с CYB5А, что было обусловлено пропорциональным увеличением значения kon (без изменения koff). С другой стороны, эндогенный биорегулятор изатин, реализующий свой биологический эффект посредством изатин-связывающих белков [5], влиял на кинетику взаимодействий CYB5A с цитохромами Р450 3А4 и 3А5 [6] и гетеродимеризацию СYP2E1/CYP5А1 [7]. Таким образом, серия работ убедительно продемонстрировала универсальное использование SPR технологии для выявления НС, которые способны модулировать кинетические и равновесные параметры белкового комплексообразования. На примере нескольких стероидогенных микросомальных цитохромов Р450 с узкой субстратной специфичностью было показано, что субстраты и продукты ферментативных реакций не модулировали их комплексообразование с CPR [4]. Поэтому, с фундаментальной точки зрения, интересным представляется вопрос о существовании модуляции взаимодействия CYP/CPR такими НС, которые бы не были вовлечены в реакции, катализируемые цитохромами Р450. В частности, SPR эксперименты позволили установить, что кофермент NADP+ повышал в пять раз аффинность взаимодействия CPR с “нецитохромным” белком – гем-оксигеназой (HO-1) за счет повышения скорости ассоциации белкового комплекса [8]. Как и НО-1, цитохромы Р450 нуждаются в притоке электронов для осуществления ферментативных реакций [9], которые, как правило, представляют собой введение в молекулу субстрата атома кислорода [10]. CPR, получив электроны от NADPH, передает их на микросомальные CYP, и, следовательно, комплексообразование CPR/CYP может зависеть от редокс-статуса кофактора CRP [11]. Мы предположили, что параметры комплексообразования CYP/CPR способны изменяться в присутствии NADPH в системе, так как наличие донора электронов является критически важным для протекания катализируемых CYP монооксигеназных реакций. Целью данной работы была проверка данной гипотезы на примере взаимодействия двух микросомальных цитохромов CYP3A4 и CYP2E1 с CPR. SPR анализ показал наличие селективного модулирующего действия NADPH на СYP2E1/CPR. NADPH повышал стабильность комплекса CYP2E1/CPR примерно на один порядок, тогда как в случае CYP3A4/CPR не было обнаружено значимого эффекта NADPH на стабильность этого комплекса. Влияние NADPH было специфичным для взаимодействия СYP2E1/CPR, так как взаимодействие СYP2E1/CYB5A (негативный контроль) не модулировалось этим кофактором. МАТЕРИАЛЫ И МЕТОДЫ Рекомбинантные белковые препараты В работе были использованы высоко очищенные (>95%, по данным электрофореза в полиакриламидном геле) препараты рекомбинантных белков: микросомальные цитохромы Р450 (CYP3A4, CYP2E1), микросомальный цитохром b5 (CYB5A) и цитохром Р450 редуктаза (CPR), полученные гетерологичной экспрессией в E. coli в Институте биоорганической химии Национальной академии наук Беларуси Беларуси [4, 6]. Препарат NADPH был получен от фирмы “Sigma Aldrich” (США). Поверхностный плазмонный резонанс (SPR) В работе использовали четырёхканальные оптические биосенсоры Biacore T-200 и Biacore 3000(«GE Healthcare», США), адаптированные для работы в автоматизированном режиме с использованием 96-луночных полистироловых планшетов. В качестве рабочего буфера использовали HBS-ЕР+ (10 мМ HEPES (pH 7.4), 150 мМ NaCl, 1 мМ ЭДТА, 0.005% Tween-20 (v/v)). Ковалентную иммобилизацию белковых препаратов CYB5A и CPR в рабочие каналы биосенсора (№2 и №3) выполняли на оптическом чипе СМ5 («GE Healthcare») за поверхностные аминогруппы белка по стандартному протоколу от производителя, используя в качестве иммобилизационного буфера 10 мМ ацетат натрия (рН 5.5). Целевой уровень иммобилизации составлял 5000 RU (5 нг/мм2). Первый канал использовали в качестве контрольного канала (без иммобилизации белка) для коррекции эффектов неспецифического связывания аналитов с поверхностью чипа. В ходе иммобилизации были последовательно выполнены следующие процедуры: (а) инжекция смеси равных объемов 0.2M EDC и 0.05M NHS в течение 7 мин при скорости потока 5 мкл/мин; (б) инжекция 25 мкг/мл раствора белка в иммобилизационном буфере в течение 10 мин при скорости потока 5 мкл/мин; (в) промывка каналов биосенсора рабочим буфером HBS-ЕР+ в течение 1 ч при скорости потока 25 мкл/мин. Анализируемые образцы, содержащие NADPH в концентрациях от 1 мкМ до 200 мкМ, были приготовлены в HBS-ЕР+ буфере [8] непосредственно перед измерениями. Инжекцию проб, содержащих разные концентрации CYP или СYP + NADPH, выполняли в течение 5 мин при скорости потока 25 мкл/мин. Для регенерации поверхности оптического чипа однократно инжектировали регенерационный раствор (2М NaCl и 0.4% СHAPS) в течение 30 c при скорости 25 мкл/мин. Результирующий сигнал биосенсора представлял собой разницу между рабочим и контрольным каналами биосенсора. Запись сигнала биосенсора в резонансных единицах (RU) в режиме реального времени осуществлялась в виде сенсограмм, к которым затем подбирали кривые поверхностного связывания Лэнгмюра 1:1 в программе BIAevaluation software v.4.1.1. Значения равновесных констант диссоциации (Kd) рассчитывали по соотношению констант скорости диссоциации (koff) и ассоциации (kon), т.е. Kd = koff/kon. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Влияние NADPH на взаимодействие (комплексообразование) CYP2E1 (CYP3A4) с их редокс-партнерами Влияние кофактора NADPH на ББВ было различным в зависимости от конкретных пар цитохромов Р450 и редокс-партнеров (табл. 1). SPR анализ показал, что комплекс CYP2Е1/CPR стабилизировался вследствие снижения значения koff почти в 10 раз при отсутствии изменений скорости ассоциации комплекса. Типичные сенсограммы взаимодействия показаны на рисунке 1А.
Иначе выглядело влияние NADPH на комплексообразование CPR/CYP3A4. Было выявлено незначительное усиление скорости образования комплекса (менее чем в 2 раза) без значимого эффекта на стабильность комплекса. Важно упомянуть, что NADPH не модулировал комплексообразование CYP2Е1 (или CYP3A4) c цитохромом b5.
Контрольные SPR эксперименты показали невысокий уровень сигналов связывания NADPH (100 мкМ) с иммобилизованной на чипе CPR (12 – 16 RU), что лишь в 2.5 – 3 раза превышало дрейф базовой линии биосенсора (~ 1 RU/мин). Также установлено, что концентрация NADPH, при которой наблюдались равновесные эффекты на комплексообразование, составляла не менее 100 мкМ, что согласуется с данными Higashimoto и соавт. по исследованию влияния NADP+ на взаимодействие CPR/HO-1 [8]. Мы предполагаем, что стабилизация комплекса CYP2Е1/CPR была обусловлена тем, что связывание кофактора с CPR может инициировать конформационные изменения структуры белка, соответствующие более благоприятной геометрической ориентации взаимодействующих участков с цитохромом Р450, что, в частности, обсуждается в работах [12, 13]. Сопоставимая амплитуда увеличения аффинности наблюдалась в присутствие субстратов при комплексообразовании цитохрома b5 со стероидогенными микросомальными цитохромами Р450 [4]. Таким образом, на примере субстратов и кофакторов было показано наличие паттерна селективного модулирующего действия на кинетические параметры бинарных ББВ с участием компонентов Р450-зависимой монооксигеназной системы. Методические аспекты SPR анализа с целью селекции различных НС, влияющих на кинетику (аффинность) бинарного ББВ Выбор условий иммобилизации целевых белков на чипе. На основе описанных результатов в данной статье, а также серии более ранних наших работ [4, 6, 14, 15] по изучению модулирующего действия НС на ББВ, важно рассмотреть некоторые методические особенности ключевых стадий дизайна SPR экспериментов. В SPR анализе выбор значения рН иммобилизационного буфера для каждого белка осуществляется индивидуально, согласно процедуре “рН скаутинга”, а критерием выбора подходящего буфера являются максимальные уровни сигналов электростатической преконцентрации целевого белка на поверхности карбоксиметил-декстранового чипа, также как и общая устойчивость структуры белка к рН. Последнее можно проверить уже после ковалентной иммобилизации белка на чипе путем исследования связывающей способности с его референсным партнером по ББВ или низкомолекулярным лигандом с известными параметрами взаимодействия. Для выполнения “рН скаутинга” следует приготовить несколько растворов белка (25 мкг/мл) в 10 мМ буферных растворах с pH 4.0 – 8.5, с шагом 0.5. Далее инжектируют каждый раствор в течение 2 мин при скорости 10 мкл/мин. После каждой инжекции поверхность чипа промывают 25 мМ NaOH в течение 30 с при скорости потока 30 мкл/мин. Ковалентная иммобилизация одного из белковых партнеров по ББВ. Многими SPR экспериментами продемонстрировано, что для исследования связывания разных концентраций белка-аналита с его партнером на чипе существенную роль играет уровень иммобилизации последнего. Мы установили, что для достижения равновесных (выход на “плато”) сигналов связывания необходимо иммобилизовать от 4000 RU до 6000 RU целевого белка при условии инжекции его партнера по взаимодействию со скоростью потока не менее 25 мкл/мин. Иммобилизация от 6000 RU до 15000 RU белка особенно важна в экспериментах по скринингу коллекций низкомолекулярных соединений, где требуется максимальный уровень чувствительности детекции комплексообразования. Дизайн SPR эксперимента для оценки действия НС на ББВ. В общем виде схема исследования действия низкомолекулярных соединений на бинарное белок-белковое взаимодействие с помощью оптического биосенсора поверхностного плазмонного резонанса показана на рисунке 2.
Подготовка образцов низкомолекулярных соединений для скрининга связывающей способности с иммобилизованными белками описана в работе [14]. Навески тестируемых НС, которые не растворимы в рабочем буфере, растворяют либо в 96%-ном этиловом спирте, либо в одном из органических растворителей, например, диметилсульфооксиде. Как показала практика, для детектирования белкового комплексообразования в отсутствие низкомолекулярного соединения следует инжектировать один из белковых партнеров (аналит) в широком концентрационном диапазоне (референсная панель, например, 10 нМ, 50 нМ, 100 нМ, 500 нМ, 1000 нМ и 10000 нМ или использовать лог-разведение), в течение 5 мин при скорости 25 мкл/мин и записью процесса диссоциации молекулярного комплекса не менее 5 мин. При этом рабочий буфер (также как и анализируемый образец) следует выравнивать по содержанию органического растворителя. Этот шаг требуется для исключения крайне нежелательного резкого перепада сигналов биосенсора (bulk-effect) при последовательной инжекции двух растворов с сильно отличающимися коэффициентами преломления. Одна из таких методик с использованием лабораторного рефрактометра представлена в работе [14]. Для биосенсорного анализа содержание растворителя в буфере не должно превышать 3% по объему, поскольку при более высоких концентрациях растворителя появляются приборные артефакты измерений, а также снижается конформационная стабильность белковой молекулы. После каждого биосенсорного цикла следует регенерировать поверхность чипа такой композицией буферного раствора (ионная сила, детергенты, значение рН), которая обеспечивала бы сохранение нативности иммобилизованного белка в течение всего времени проведения биосенсорного эксперимента и в то же время максимально полно удаляла связавшийся материал аналита. Выбор концентраций НС для исследования его влияния на ББВ может также варьироваться в широких пределах, но часто зависит от способности анализируемого образца НС к агрегации, которая, в свою очередь, обусловлена растворимостью НС. Например, в работе [15], влияние изатина на белковое комплексообразование с участием феррохелатазы тестировали в диапазоне 25-270 мкМ без появления характерных признаков артефактов базовой линии биосенсора при инжекции образцов аналита. Для оценки уровней непосредственного связывания НС с иммобилизованными на чипе белками анализируемые образцы, содержащие от 4 до 6 разных концентраций НС в рабочем буфере (контрольная панель, например, 10 мкМ, 25 мкМ, 50 мкМ, 75 мкМ, 100 мкМ, 200 мкМ), инжектируют в течение 5 мин при скорости 25 мкл/мин. Далее в таких же условиях инжектируют несколько целевых панелей образцов, содержащих идентичные референсной панели концентрации белка-аналита и каждая целевая панель содержит лишь одну концентрацию НС. Соответственно, остальные целевые панели образцов будут отличаться только по концентрации НС. Результирующие сигналы биосенсора при анализе целевой панели будут представлять собой разницу после вычитания сигналов контрольной панели. Далее следует выполнить сравнительный анализ параметров связывания референсной панели (без добавления НС) со скорректированной целевой панелью. В таблице 2 продемонстрирован дизайн типичного SPR эксперимента c использованием референсной, контрольной и целевых панелей анализируемых образцов.
Для НС, оказывающих значительное влияние ( > 2 раз) на константы скорости диссоциации ББВ, дополнительно можно исследовать их влияние на стабильность предварительно сформированного на чипе белкового комплекса в отсутствие НС, используя режим ко-инжекции (co-inject) оптического биосенсора Biacore 3000. В качестве примера подобного эксперимента в работе [6] было показано дестабилизирующее действие изатина на комплексообразование CYB5A/CYP3A4. Интересно отметить, что SPR анализ показал лишь незначительное влияние на koff (изменение сигнала биосенсора < 10%) (рис. 1В) при ко-инжекции 100 мкМ NADPH по предварительно сформированному бинарному комплексу CYP2E1/CPR в отсутствие NADPH на оптическом чипе, что, возможно, указывает на стабилизирующую роль NADPH в процессе непосредственного взаимодействия CYP2E1 с CPR. В данной работе мы представили протокол для оценки влияния низкомолекулярных соединений на белок-белковые взаимодействия в монооксигеназных системах c помощью оптического SPR биосенсора. Установлено, что NADPH повышает стабильность комплексов CYP2E1/CPR. Таким образом, для одного из микросомальных цитохромов P450 (CYP2E1) была установлена роль NADPH как модулятора взаимодействия с основным редокс-партнёром (CPR). Это может быть одним из механизмов регуляции работы микросомальных монооксигеназных P450 зависимых систем. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований (РФФИ) (грант № 18-04-00071). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|