|
Чувствительность экстраклеточных везикул из сыворотки крови человека к различным детергентам 1 Институт высшей нервной деятельности и нейрофизиологии РАН, Ключевые слова: экзосомы; микровезикулы; сыворотка крови; динамическое светорассеяние; детергенты DOI: 10.18097/BMCRM00143 Спиок сокращений: PBS – фосфатно-солевой буфер; SDS – додецил сульфат натрия; DOC – дезоксихолат натрия; Brij 35 – додециловый эфир полиэтиленгликоля; CHAPS – 3-[(3-хлорамидопропил) диметиламмонио]-1-пропансульфонат; CTAB – цетил триметиламмония бромид; Triton X-100 – терт-октилфеноксиполиэтоксиэтанол; NP-40 – октил феноксиполиэтоксилэтанол; ЭВ - экстраклеточные везикулы ВВЕДЕНИЕ
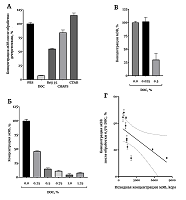
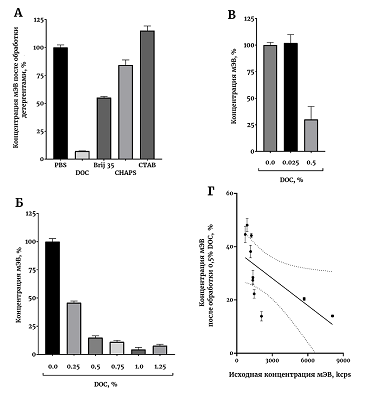
Малые ЭВ (мЭВ) являются мембранными везикулами, секретируемыми практически всеми клетками организма [1]. Показано, что мЭВ содержат нуклеиновые кислоты, ферменты, рецепторы и многое другое, но детальный анализ состава мЭВ еще не проведен. Размер экзосом составляет 50–150 нм; при этом другой класс ЭВ – микровезикулы – имеет размер 100–200 нм [2]. При изучении мЭВ часто возникает ситуация, когда нужно растворить мембрану везикулы и исследовать растворимую фракцию. Например, можно последовательно биотинилировать вначале поверхностные белки мЭВ, а затем растворить мембрану и с помощью другого реагента биотинилировать внутривезикулярные белки [3]. Это позволяет более подробно охарактеризовать состав мЭВ. Более того, подход с использованием избирательного биотинилирования позволяет более надежно выявлять маркеры различных заболеваний [4]. Известно, что мЭВ проявляют избирательную чувствительность к разным детергентам [5]. Согласно опубликованным данным, для растворения и микровезикул, и экзосом достаточно 0.125% SDS, 0.075% Triton X-100 или 0.1% DOC [5]. Однако большинство предыдущих результатов получено на мЭВ из культуральной жидкости от клеточных культур, а чувствительность мЭВ сыворотки крови к детергентам остается неизвестной. В некоторых работах для лизирования мЭВ из плазмы крови без четкого обоснования используется 3% Triton X-100 [6]. Для лизиса мЭВ из слюны были использованы детергенты SDS, Triton X-100 и NP-40, каждый в концентрации 1%; при этом неионные детергенты не могли обеспечить полного разрушения частиц [7]. Кроме того, даже с чувствительностью мЭВ из культуральной жидкости от клеточных культур к детергентам не все ясно. Так, некоторые авторы считают, что, по крайней мере, неионные детергенты не растворяют мембрану мЭВ, а снижают дзета-потенциал частиц и таким образом снижают коллоидальную стабильность частиц в растворе, что может приводить, например, к выпадению частиц в осадок [8]. В некоторых работах для разрушения мЭВ из клеточных культур используют заведомо большую концентрацию детергентов, например 2% SDS [9]. По некоторым данным, выделенные из плазмы крови мЭВ можно разрушить 1% Triton X-100, хотя использование разных методов выделения мЭВ приводит к выделению частиц, существенно различающихся по чувствительности к детергенту [10]. При лизисе мЭВ из культуральной жидкости, проведенном в смеси детергентов 1% NP-40, 1% DOC и 0.1% SDS увеличивается число экстрагированных белков по сравнению с лизисом мЭВ в 1% Triton X-100 [11]. Таким образом, на сегодняшний день нет четких данных о чувствительности мЭВ к детергентам, тем более мЭВ из сыворотки крови человека. Тем не менее, такие данные сейчас востребованы для проведения целого ряда биохимических экспериментов. Нам чувствительность мЭВ к детергентам нужна для планирования экспериментов по определению активности внутривезикулярных ферментов. Мы выбрали основные детергенты, часто используемые в лаборатории, и проверили чувствительность к ним мЭВ. Оказалось, что самым эффективным детергентом, обеспечивающим наиболее полную солюбилизацию мЭВ, является DOC. МАТЕРИАЛЫ И МЕТОДЫ В экспериментах были использованы фосфатно-солевой буфер (PBS, в таблетках, «Биолот», Россия), додецил сульфат натрия (SDS, «Serva», Германия), дезоксихолат натрия (DOC, «Calbiochem», США), додециловый эфир полиэтиленгликоля (Brij 35, «MP Biomedicals», США), 3-[(3-хлорамидопропил) диметиламмонио]-1-пропансульфонат (CHAPS, «MP Biomedicals»), цетил триметиламмония бромид (CTAB, «Fluka», Германия), сефароза CL-2B («GE Healthcare», США). Все растворы готовили на дважды деионизованной воде сопротивлением 18,2 Мом х см. Материал для исследования Материалом для исследования служила сыворотка крови человека. Забор крови у здоровых добровольцев проводили из локтевой вены в утренние часы натощак. Известно, что на образование ЭВ оказывает влияние множество факторов [12], поэтому процедура взятия крови и преаналитический этап подготовки проб были максимально стандартизированы. Для всех проб были соблюдены одинаковые условия, а именно: время (не более 30 мин) и способ забора крови; температура в помещении между взятием крови и центрифугированием (22-23°С); условия центрифугирования; условия хранения биологического материала на всех этапах анализа. Выделение мЭВ из сыворотки крови человека Пробы сыворотки крови получали и очищали от остатков клеток и высокомолекулярных комплексов центрифугированием при 4°С в течение 30 мин при 10000 g. Колонку заполняли 10 мл смолы Сефароза CL-2B и уравновешивали PBS. Предварительно центрифугированную сыворотку крови наносили на колонку в объеме 500 мкл, после добавления пробы наносили 2.5 мл PBS, элюат отбрасывали. После этого наносили 1 мл PBS и собирали элюат для последующего анализа. Перед очередной пробой промывали колонку не менее чем 15 мл PBS [13]. Выделенные мЭВ хранили при -80°С. Обработка мЭВ детергентами К образцам мЭВ добавляли детергенты до концентрации 1% из свежеприготовленного 20% стокового раствора. Растворы всех детергентов готовили на PBS, его же использовали в качестве холостой пробы. Через 5 мин после смешивания определяли концентрацию мЭВ с помощью динамического светорассеяния. Все операции проводили на комнатной температуре. Определение концентрации мЭВ с помощью динамического светорассеяния Интенсивность динамического светорассеяния экзосом определяли с помощью прибора Zetasizer Nano S («Malvern Panalytical», Великобритания). В кварцевую кювету наливали мЭВ в присутствии заданной концентрации детергента и определяли светорассеяние на угол 173 градуса на длине волны 633 нм за четыре повтора длительностью по 50 с каждый. Оборудование позволяет вычислить размер наночастиц, а также определить число рассеянных на частицах фотонов, выражаемое в тысячах фотонов в секунду (kcps). Общее число рассеянных на частицах фотонов служит параметром, отражающим концентрацию мЭВ в образце [14]. Статистическая обработка результатов Статистический анализ проводили в программе Graphpad Prism ver. 8.0. Результаты представлены в виде среднее ± стандартное отклонение. Для выявления взаимосвязи между переменными использовали непараметрический корреляционный анализ, представлен коэффициент корреляции Спирмена и 95% доверительный интервал. Для эксперимента по определению чувствительности мЭВ к разным детергентам было использовано 16 образцов, для остальных экспериментов по 10 образцов. РЕЗУЛЬТАТЫ В первом эксперименте была продемонстрирована существенно различная чувствительность мЭВ к детергентам (рис. 1А). Все детергенты были использованы в концентрации 1%, что значительно превосходит критическую константу мицеллообразования для каждого из использованных детергентов. Влияние на солюбилизацию мЭВ было проверено еще для двух детергентов - SDS и Triton X-100, но 1% раствор этих детергентов в PBS обладает слишком высоким светорассеянием, так что исследовать в нем какие-либо объекты с помощью динамического светорассеяния не представляется возможным (данные не представлены). Из исследованных детергентов DOC проявил самую высокую эффективность, так что в следующем эксперименте была исследована зависимость эффективности солюбилизации от концентрации DOC (рис. 1Б). Видно, что эффективной солюбилизации можно добиться уже при концентрации DOC 0.5%. Насколько эффективна солюбилизация 0.5% DOC продемонстрировано в следующем эксперименте с использованием образцов, существенно различающихся по числу мЭВ (рис. 1В). В среднем, 0.5% DOC растворяет 75% везикул. Доля мЭВ, растворенных 0.5% DOC, зависит от исходной концентрации мЭВ в образце (рис. 1Г). Чем выше концентрация мЭВ, тем эффективнее солюбилизация, коэффициент корреляции Спирмена составил -0.93, р<0.0003. Коэффициент детерминации для данного приближения составил 0.42, что довольно неплохо.
ОБСУЖДЕНИЕ В работе была решена достаточно важная экспериментальная задача - определение чувствительности мЭВ к детергентам. Задача солюбилизировать мЭВ регулярно возникает в исследованиях. Например, разделение мЭВ на мембранную и растворимую фракцию требуется для изучения внутривезикулярной ферментативной активности. В данной работе мы показали, что анионный детергент DOC в относительно небольших концентрациях способен эффективно растворять мембрану мЭВ. Неионный детергент Brij 35 в концентрации 1% растворяет примерно половину везикул (рис. 1А), что, вероятно, может подойти для определенных экспериментальных задач. Практически неэффективен для солюбилизации мЭВ цвиттерионный детергент CHAPS, а катионный детергент CTAB совсем не подходит для солюбилизации мЭВ. Для некоторых методов анализа анионный детергент DOC не подходит, так как существенно денатурирует белки, в таком случае для эксперимента можно рассмотреть альтернативу - Brij 35. Одним из направлений дальнейших исследований является поиск субфракций мЭВ, селективно чувствительных к разным детергентам. Работы на клеточных культурах уже есть [5], теперь можно повторить эксперименты на мЭВ крови, имея в виду, что мЭВ крови значительно устойчивее к действию детергентов, чем мЭВ из культуральной жидкости (рис. 1А). Однако, даже обладая большей устойчивостью к детергентам по сравнению с культурой, мЭВ крови также могут иметь разную чувствительность к детергентам. Например, экзосомы более устойчивы к действию многих детергентов, чем микровезикулы [5]. В работе показан воспроизводимый результат действия 0.5% DOC на образцы с разной концентрацией мЭВ (рис. 1в), но с четкой зависимостью эффективности солюбилизации от концентрации мЭВ (рис. 1Г). Эффективнее всего солюбилизация проходит при большой исходной концентрации мЭВ. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все процедуры, выполненные в исследовании с участием людей, одобрены этическим комитетом Института ВНД и НФ РАН. От каждого из включенных в исследование участников было получено информированное добровольное согласие. БЛАГОДАРНОСТИ Авторы выражают искреннюю благодарность российскому представительству «Malvern Panalytical» и лично С.Л. Васину и Е.О. Дуплякину за помощь в разработке методов регистрации везикул с помощью динамического светорассеяния. ФИНАНСИРОВАНИЕ Работа выполнена по теме АААА-А19-119071990046-9 «Нейрогенетика» Государственного задания Института высшей нервной деятельности и нейрофизиологии РАН (Института ВНД и НФ РАН). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|