|
Влияние связывания гелданамицина с HSP90 на сайт фосфорилирования THR90
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: шаперон HSP90; рак простаты; молекулярная динамика; сеть взаимодействия аминокислотных остатков; RIN DOI: 10.18097/BMCRM00145 ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) остаётся одной из самых распространённых причин смерти среди мужчин в развитых странах. По этой причине значительные усилия направлены на выявления механизмов патогенеза заболевания, разработку способов его профилактики и лечения. РПЖ часто является гормон-зависимым видом рака [1], так как рост и пролиферация злокачественных клеток стимулируются при действии андрогенов. Поэтому основным направлением лечения РПЖ является снижение количества андрогенов в организме. Часто после лечения может наблюдаться рецидив этого заболевания, которое связывают с мутациями, придающими способность раковым клеткам отвечать на низкие концентрации андрогенов. Так, в случае рецидива может наблюдаться повышенная экспрессия нормальных и мутированных форм андрогенного рецептора (AR), способных активироваться в отсутствии андрогенов [2, 3]. В настоящее время используют два основных подхода для лечения РПЖ, основанных на ингибировании синтеза андрогенов, – блокирование цитохрома Р450 17А1 (17-α-гидроксилаза, 17,20-лиаза), например, абиратероном [4] и инактивация AR посредством его антагонистов (ципротерон, флутамид, бикалутамид и др.) [5]. В цитоплазме AR находится в комплексе с шапероном HSP90 и рядом других белков в конформации, в которой он может взаимодействовать с агонистом с высокой аффинностью. Связывание агониста с AR приводит к конформационным изменениям в AR, в результате чего его комплекс с шаперонами распадается, а рецептор транспортируется в ядро. Недавно было обнаружено, что для диссоциации комплекса шаперона HSP90 и AR недостаточно связывания с агонистом и необходимо дополнительное фосфорилирование остатка Thr-90 HSP90 [6]. Фосфорилирование осуществляется протеинкиназой РКА 1. Было установлено, что HSP90 фосфорилируется по единственному остатку Thr-90 [6]. В трансфицированных мутантным HSP90 T90A клетках LNCaP значительная часть AR оставалась в комплексе с HSP90 в цитоплазме, в то время как в клетках, экспрессировавших дикий тип HSP90, наблюдалась полная диссоциация комплекса AR-HSP90, а рецептор транслоцировался в ядро. Все это свидетельствует о том, что фосфорилирование HSP90 по остатку Thr90 является необходимым условием для диссоциации комплекса HSP90 и AR и последующей транслокации последнего в ядро. Ингибиторы HSP90, блокирующие АТР-связывающий карман, рассматриваются в качестве лекарств для лечения ряда опухолевых заболеваниях, в том числе и РПЖ [7-9]. Но для этого типа рака они показали низкую эффективность [10]. Кроме того, для ингибиторов HSP90 высок риск побочных эффектов [11]. Поэтому ингибиторы, способные блокировать фосфорилирование HSP90, могут оказаться перспективной альтернативой «классическим» ингибиторам этого белка. При этом остается неясным, способны ли «классические» ингибиторы препятствовать фосфорилированию Thr90. В работе методами молекулярного моделирования была исследована способность ингибитора HSP90 –гелданаминицина – влиять на этот процесс. МАТЕРИАЛЫ И МЕТОДЫ
В работе были использованы пространственные структуры N-концевого домена HSP90 в свободной форме (PDB ID: 3T0H) и в комплексе с гелданамицином (PDB ID: 1YET), полученные из PDB (www.rcsb.org). Поиск полостей на поверхности белков проводили с помощью сервера CASTp [12]. Расчеты молекулярной динамики (МД) проводили в пакете GROMACS 2020 (www.gromacs.org) [13]. Атомы белка были параметризованы с использованием силового поля ff14SB, лиганда — силового поля GAFF. Растворитель был задан в явном виде для чего в систему добавили ~15000 молекул воды (модель TIP3P). Для нейтрализации заряда системы были добавлены ионы Na+. Минимизацию обеих систем производили в течение 50000 шагов с использованием метода градиентного спуска. После чего обе системы были уравновешены с применением NVT ансамбля на траектории 5 нс с последующим уравновешиванием с NPT ансамблем на протяжении 10 нс. Расчеты МД проводили на траектории в 300 нс, с шагом в 2 фс при температуре 300 К и давлении 1 бар. Для поддержания заданных температуры и давления использовали термостат Берендсена и баростат Парринелло-Рахмана. На связи с атомами водорода были наложены ограничения с применением алгоритма LINCS. Расчет электростатических взаимодействий производили с использованием метода Particle Mesh Ewald (PME). Отсечку электростатических взаимодействий осуществляли на расстоянии в 12 Å. Визуализацию траекторий МД осуществляли при помощи пакетов VMD [14] и PyMol [15]. Анализ траекторий МД осуществляли при помощи внутренних инструментов GROMACS: gmx rmsf и gmx rmsd. Для вычисления расстояния между центрами масс амино- и карбоксильных групп боковых цепей остатков Glu178 и Lys185 был использован инструмент Salt Bridges, входящий в состав VMD. Сеть взаимодействий остатков (RIN, Residue-Interaction Network) была построена при помощи программы RING [16]. Для расчетов были использованы участки траектории МД 100-300 нс. Из каждой траектории было извлечено по 200 структур с интервалом в 1 нс. Все RIN были построены с использованием стандартных значений отсечек для различных типов контактов: солевой мостик – 4.0 Å; S-S связи –2,5 Å; π- π взаимодействия – 6.5 Å; π-катионные взаимодействия – 5.0 Å; Н-связь – 3.5 Å; VDW – 0.5 Å. Все построенные RIN для каждой из исследуемых структур были объединены в общую сеть. В процессе объединения все найденные близкие контакты собирали. в один файл, и для каждого были рассчитаны частоты появления. Для дальнейшего анализа использовали только те взаимодействия, которые были обнаружены более чем в 70 RIN. Единая сеть была построена на основе устойчивых контактов, представленных как минимум в 70 из 200 структур. Все необходимые пептидные связи были дополнительно добавлены вручную в виде ребер к графам RIN с весом равным 200. Визуализацию и дальнейший анализ RIN выполняли при помощи программы Cytoscape и подключаемых модулей DyNet и Presca [17, 18] (https://apps.cytoscape.org/apps/dynet). Объем полости на белке был оценен с помощью программы fpocket [19]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Анализ структуры HSP90 показал, что фосфорилируемый остаток Thr-90 распола-гается в полости, сформированная остатками Ile81, Asn83, Thr88, Thr90, Glu178, Lys185, Ile187 (рис. 1А). Данный карман расположен преимущественно на внешнем слое β-листа за исключением остатка Glu-178, который расположен на петле, соединяющей два анти-параллельных бета-тяжа (Рис. 1Б).
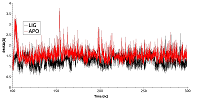
Для анализа влияния связывания ингибиторов HSP90 в АТР-связывающем кармане, были проведены расчеты молекулярной динамики свободного N-концевого домена HSP90 (PDB ID: 3T0H) и в комплексе с ингибитором гелданамицином (PDB ID: 1YET), находящимся в месте связывания АТР. В процессе молекулярной динамики обе структуры N-концевого домена HSP90 оставались стабильными. Величины RMSD приведены на рисунке 2. Для комплекса с гелданамицином наблюдалось возрастание значения RMSD до ~3Å в первые 90 нс динамики, после чего значение RMSD выходило на плато. RMSD для свободной формы достигало значения в ~1,4Å и выходило на плато в течении 30 нс. Однако график, описывающий участок траектории после выхода системы на плато, вел себя менее стабильно и показывал большие флуктуации значения RMSD (0.15 Å) по сравнению с лиганд-связанной формы белка (0.1 Å). Более низкие флуктуации значений RMSD у лиганд-связанной формы в сравнении с апо-формой указывают на то, что связывание лиганда способствует стабилизации общей структуры домена.
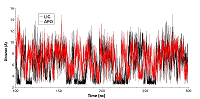
Далее была рассмотрена конформационная подвижность сайта в районе фосфорилируемого остатка. Для анализа были выбраны наиболее стабильные участки траектории молекулярной динамики в промежутке от 100 нс до 300 нс. Анализ изменения величин RMSD (рис. 3) показал, что в обоих формах белка рассматриваемый сайт остается стабилен.
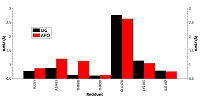
Однако у свободной формы HSP90 карман является более подвижным, что отражается в более высоком среднем значении RMSD (~1.54 Å против 1.27 Å) и характеризуется наличием большего числа пиков на графике по сравнению с лиганд-связанной формой. Для выявления вклада отдельных остатков в общую подвижность кармана HSP90 были рассчитаны их значения RMSF (рис. 4).
Остатки Asn83 и Thr88 в свободной форме оказались заметно более подвижными в сравнении с лиганд-связанной формой. Высокую подвижность для обеих форм в ходе динамики показал остаток Glu178, (RMSF 2.8-2.9Å). Для этого остатка наблюдали две основные конформации. В первой конформации Glu178 образует солевой мостик с другим остатком кармана Lys185 (рис. 5А). Во второй конформации боковая цепь Glu178 развёрнута на 180 градусов и обращена в сторону растворителя (рис. 5В).
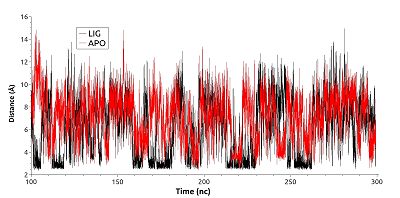
Для выявления стабильности солевого мостика между Glu178 и Lys185 были рассчитаны расстояния между центрами масс амино- и карбоксильных групп указанных остатков на участке траектории в 100-300 нс для обеих форм (рис. 6). Для первой конформации расстояние между центрами масс указанных функциональных групп варьировало в пределах 2.5-3.5 Å, для второй — в пределах 6-10 Å. Видно, что в отличие от свободного фермента в лиганд-связанной форме солевой мостик сохраняется в течение более продолжительных периодов (расстояние между центрами масс ~3Å), тогда как в свободной форме долгоживущая связь не формируется.
Чтобы выяснить, как связывание гелданамицина влияет на обнаруженные различия в конформационной подвижности исследуемого кармана HSP90 между свободной и лиганд-связанной формами, была построена сеть взаимодействий остатков (RIN) для остатков, составляющих исследуемый карман, с остатками Asn 51, Ser52, Asp54 Ala55, Lys58, Asp93, Asp95, Ile96, Gly97, Met98, Asp102, Asp106, Leu107, Lys112, Phe138, Val150, Thr184, непосредственно взаимодействующими с геладнамицином [20] (рис. 7). Для этого были найдены кратчайшие пути в RIN между указанными выше группами остатков. Для расчетов были использованы участки траектории МД 100-300 нс. Анализ сети показал, что взаимодействие между сайтами отличается для свободной и связанной форм белка. Так, в апо-форме в передачу взаимодействия между сайтом связывания лиганда и окрестностью Thr90 вовлечено 3 остатка (Leu48, Ile91, Val92), не входящих в эти сайты, в то время как для лиганд-связанной формы в передаче взаимодействия участвует уже 10 таких остатков (Val148, Ala141, Leu188, Val186, Thr149, Ile151, Ala161, Thr152, Leu103, Trp162). Таким образом, различаются не только количество остатков, участвующих во взаимодействии между сайтами, но и маршруты внутри сети RIN, по которым это взаимодействие осуществляется.
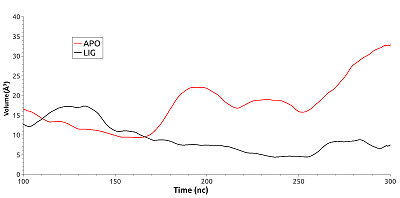
Дополнительно был оценен размер полости около фосфорилируемого остатка в процессе молекулярной динамики для свободного и связанного с ингибитором HSP90 (рис. 8). Видно, что изменения объема полости было разнонаправленным. Для свободного белка наблюдалось незначительное увеличение полости, тогда как для связанного с ингибитором – ее уменьшение. Так объём полости в свободном белке увеличился с ~16.5 Å3 на 100 нс до ~32Å3 к 300 нс, т. е. возрос на 94%. В лиганд-связанной форме объём полости на том же временном промежутке уменьшился на 28% - с ~12.8 Å3 до ~10 Å3. Но в обоих случаях они были незначительными. Никакой корреляции между изменением объема и образованием ионной связи остатками Lys185 и Glu178 отмечено не было.
Таким образом, можно заключить, что связывание ингибитора в АТP-связывающем кармане не влияет на структуру полости около фосфорилируемого Thr-90 HSP90, поэтому связывание лиганда не должно влиять на процесс фосфорилирования. «Классические» ингибиторы HSP90 не могут быть использованы для предотвращения фосфорилирования Thr90. Это требует разработки специальных ингибиторов, направленных на связывание с карманом, расположенным в непосредственной близости от Thr90. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с исполь-зованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена при поддержки РФФИ, грант 19-34-90057. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов/ ЛИТЕРАТУРА
|