К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ 1. АНТИ-БЕТА-АМИЛОИДНЫЕ АГЕНТЫ 2. ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА АГРЕГАЦИЮ БЕЛКА ТАУ 3. ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА РЕЦЕПТОРЫ ЦНС 4. ИНГИБИТОРЫ ФЕРМЕНТОВ, УЧАСТВУЮЩИХ В ПЕРЕДАЧЕ СИГНАЛА В НЕЙРОНАХ 6. ОДОБРЕННЫЕ К ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Рисунок 4 Структуры низкомолекулярных препаратов, влияющих на бета-амилоидную активность. Рисунок 6 Структуры препаратов, влияющих на агрегацию тау. Рисунок 7 Структуры препаратов, влияющих на рецепторы ЦНС. Рисунок 8 Структуры ингибиторов ферментов, участвующих в трансдукции нейронных сигналов. Рисунок 10 Одобренные к клиническому применению препараты для лечения болезни Альцгеймера. Таблица 1 Препараты для лечения БА на фазе I клинических испытаний. Таблица 2 Препараты для лечения БА на фазе II клинических испытаний. Таблица 3 Препараты для лечения БА на фазе III клинических испытаний. |
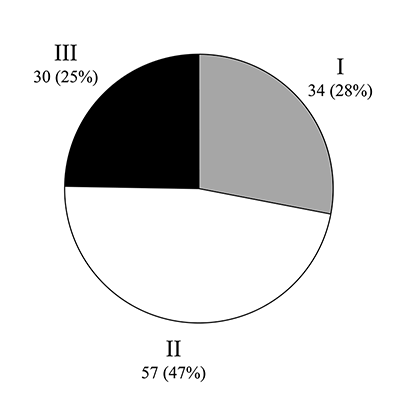
Современные тенденции в создании препаратов для лечения болезни Альцгеймера и их клинические испытания Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1, *e-mail: bovina_e@ipac.ac.ru Ключевые слова: болезнь Альцгеймера; нейродегенеративные заболевания; мультитаргетные соединения; болезнь-модифицирующие препараты; репозиционирование известных ранее лекарств DOI: 10.18097/BMCRM00015 ВВЕДЕНИЕ Исследование и разработка эффективных терапевтических средств для лечения нейродегенеративных заболеваний, в частности болезни Альцгеймера (БА), является одной из наиболее востребованных задач современной фармакологии. В то же время социально-экономическая значимость разработки таких лекарств перевешивает любые возможные риски и затраты на разработку. По данным ВОЗ количество больных болезнью Альцгеймера (БА) и близкими формами деменции в мире оценивается примерно в 30-35 млн и удваивается примерно каждые 10 лет [1]. Ожидается, что к 2030 году число больных БА достигнет 70 млн чел. Общие затраты на лечение больных БА во всем мире в 2015 году составили 818 миллиардов долларов США и могут возрасти до 2 триллионов к 2030 году [2]. Мировой рынок фармпрепаратов для лечения БА в 2015 году составлял 5.2 млрд долларов США, и ожидается, что к 2020 году рынок увеличится более чем вдвое, до 11,3 млрд долларов США [3]. С 2007 года, когда Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration) в США ввело обязательную регистрацию клинических исследований, около ста препаратов достигли третьей фазы, однако ни один не вышел в клинику. Таким образом, несмотря на огромные усилия и затраты на поиск новых эффективных препаратов для лечения БА в последнее десятилетие, на рынке все ещё нет новых лекарств. В общих чертах БА характеризуется хроническим и прогрессирующим нейродегенеративным процессом, возникающим в результате внутриклеточного и внеклеточного накопления фибриллярных белков: бета-амилоида (Aβ) и гиперфосфорилированного тау [4,5]. Избыточное накопление таких агрегатов приводит к синаптической дисфункции и последующей гибели нейронов. Точные молекулярные механизмы БА до сих пор изучены не полностью, однако понятно, что основным фактором риска развития заболевания является преклонный возраст. Существуют различные теории и гипотезы, описывающие факторы развития БА, и все они подтверждают, что БА является многофакторным заболеванием, и, следовательно, для борьбы с прогрессированием патологии не может быть использован только один лекарственный препарат [6,7]. Несмотря на самые популярные теории развития БА, гипотезы накопления Aβ [8] и тау [9] включают следующее: (а) химические факторы, приводящие к нарушению метаболизма ионов металлов (Zn2+, Mg2+, Ca2+) и изменению передачи нервного импульса; (б) сосудистые нарушения, приводящие к ухудшению кровоснабжения мозга; (в) предшествующие заболевания, такие как диабет, высокое артериальное давление и высокий уровень холестерина; (г) генетическая предрасположенность, включая мутации в генах предшественника амилоидного белка (APP) и пресенилина (PSEN), а также аллельные вариации в аполипопротеине E (ApoE); (д) дисфункция иммунной системы; (е) митохондриальная дисфункция; (ж) нарушение выработки факторов роста нервов и (з) факторы окружающей среды и инфекционные факторы [10-12]. Часть случаев развития БА связана с генетическими мутациями, приводящими к аутосомно-доминантной схеме наследования в трёх генах – APP, PSENs 1 и 2 [13-16]. У всех пациентов, имеющих мутации в этих генах, было выявлено преждевременное развитие БА. Таким образом, эти гены или, скорее, их белковые продукты являются мишенями при разработке лекарственного средства. Дальнейшие исследования выявили расщепление APP бета-секретазой и затем гамма-секретазой, что приводит к образованию бета-амилоида, который, агрегируя, образует токсичные олигомерные структуры, взаимодействующие с рецепторами нейронов. Это вызывает каскад событий, которые отвечают за дисфункцию митохондрий, дисбаланс ионов Са2+, перекисное окисление липидов, повреждение ДНК и другие факторы, приводящие к гибели нейронов. Генетическая предрасположенность не является основным фактором, а спорадический характер БА включает в себя другие факторы, которые также могут быть связаны с развитием болезни: курение, неправильное питание, уровень образования и низкий уровень физической и умственной активности. Несмотря на недостаточные знания о полном молекулярном механизме БА, патологические маркеры БА хорошо известны. Это нейрофибриллярные клубки, образованные агрегированным тау, а также бета-амилоидные бляшки. В нормальных условиях тау стабилизирует микротрубочки цитоскелета нейронов [17, 18]. Однако в патологических состояниях тау аномально гиперфосфорилируется и больше не связывается с микротрубочками, а образует нерастворимые агрегаты во внутриклеточном пространстве нейрона, что нарушает аксональный транспорт и неизбежно приводит к гибели нейронов. Сравнительный анализ спинномозговой жидкости (ликвора) и биомаркеров крови для диагностики БА показал, что основными биомаркерами нейродегенерации являются в первую очередь T-tau и P-tau, а также Aβ42 - нейрофиламентный белок. Кроме того, T-tau плазмы и нейрофиламентный белок из ликвора показали наибольший эффект при сравнении контрольной группы пациентов и пациентов с БА. Другие исследованные биомаркеры показали незначительный эффект либо не показали вовсе никакого различия между контрольными образцами и образцами пациентов, страдающих БА [19]. Нейрофибриллярные клубки образованы фрагментом из 39-42 аминокислот с молекулярной массой 4 кДа и присутствуют как во внеклеточном, так и во внутриклеточном пространстве [20,21]. Малые растворимые олигомеры и фибриллярные образования среднего размера наиболее токсичны для нервных клеток, в то время как конечные продукты агрегации относительно инертны. Это относится как к бета-амилоиду, так и к тау [22,23]. В последние годы опубликовано довольно много работ, в которых анализировались различные аспекты патогенеза и терапии БА, а также связанной с ними деменции [24-29]. На сегодняшний день наиболее широко применяемыми в клинической практике «анти-альцгеймеровскими» препаратами являются Donepezil (Aricept, Донепезил), Galantamine (Reminyl, Галантамин), Rivastigmine (Exelon, Ривастигмин), и Memantine (Noojerone, Мемантин). Первые три являются ингибиторами ацетилхолинэстеразы (AChEI), а Мемантин является низкоаффинным неконкурентным антагонистом подтипа N-метил-D-аспартата (NMDA) глутаматных рецепторов (GluR). Препараты первого поколения ингибиторов холинэстеразы (ChEI), в частности Tacrine (Такрин), одобренный к клиническому применению с 1993 года, неселективно ингибируют ацетилхолинэстеразу (AChE) по отношению к другим ферментам этой группы, например, бутирилхолинэстеразе (BuChE), и проявляют низкую органную специфичность. В настоящее время популярность этих препаратов постепенно снижается. Один из подходов, используемых для модификации данного класса лекарств, состоит в повышении селективности ингибирования AChE по отношению к BuChE. Тем самым уменьшается периферическая токсичность лекарственного средства. Этот подход был реализован в разработке второго поколения ингибиторов холинэстераз, который включает в себя Aricept (одобренный с 1996 года) и Galantamine (одобренный с 2001 года). Оба препарата демонстрируют выраженную селективность по отношению к AChE. Ещё один успешный подход был реализован компанией Novartis при разработке препарата Rivastigmine (одобрен с 1998 года). Подход был основан на выраженной региоселективности, обеспечивающей избирательное ингибирование AChE мозга, а не изотропных периферических холинэстераз. Все эти препараты имеют лучшую переносимость по сравнению с Такрином и демонстрируют некоторую эффективность на ранних и умеренных стадиях БА. Кроме того, недавно было показано, что в дополнение к антихолинергической активности эти препараты также влияют на процессинг APP-белка и, таким образом, могут быть потенциально использованы для замедления нейродегенеративных процессов у пациентов с БА [30]. С другой стороны, ингибирование AChE часто приводит к повышенному уровню фосфорилированного тау, который может привести к ослаблению терапевтического эффекта [31]. Последним препаратом, который был выведен на рынок для лечения умеренных форм БА в 2003 году, был Мемантин. Препарат связывается с внутриканальным сайтом NMDA-рецептора. Первоначально считалось, что когнитивно-стимулирующие свойства Мемантина объясняются улучшенным отношением «сигнал-шум» при глутаматергической нейротрансмиссии из-за блокады канала NMDA-рецептора мозга [32]. Недавние исследования показали, что терапевтический эффект Мемантина может быть связан также со способностью блокировать токсический эффект бета-амилоида, реализуемый путём взаимодействия с NMDA-рецепторами мозга [33]. В последние годы была значительно изменена стратегия поиска и разработки лекарственных средств для лечения БА. Для выявления основных тенденций в поиске новых «анти-альцгеймеровских» препаратов мы проанализировали имеющиеся данные о препаратах, которые в настоящее время находятся на разных фазах клинических исследований. В обзоре обобщены результаты, представленные в базе данных «Integrity» (Thomson Reuters), в базе данных Alzforum.org, а также на веб-сайте www.clinicaltrials.gov, где отслеживаются клинические исследования с 2007 года. На конец 2017 года на фазе I клинических исследований на пациентах с БА находилось 34 (28%) препарата, 57 (47%) соединений находились на фазах I/II и II, а 30 препаратов (25%) перешли на фазу III клинических исследований (рис. 1).
Все препараты можно разделить на несколько групп в соответствии с основными мишенями и/или механизмами их действия (рис. 2).
1. АНТИ-БЕТА-АМИЛОИДНЫЕ АГЕНТЫ В амилоидном каскаде бета-амилоид образуется в результате протеолитического расщепления белка-предшественника амилоида (англ. Amyloid Precursor Protein, APP), который принадлежит к семейству мембранных белков типа I с большим внеклеточным доменом и короткой цитоплазматической областью, которая получается в результате альтернативного сплайсинга одной транскрипции гена, расположенного на длинном плече хромосомы 21 [34]. Неамилоидогенные пути включают расщепление APP альфа-секретазой внутри бета-амилоидного пептида, предотвращающее образование потенциально токсичных пептидов, которые образуются посредством расщепления APP по двустадийному протеолитическому механизму с участием бета- и гаммы-секретаз, что приводит к образованию фрагментов Aβ40 и Aβ42 [35]. Оба пептида обнаружены в амилоидных бляшках, однако Aβ42 имеет бóльшую склонность к формированию агрегатов токсических олигомеров, которые далее упаковываются в амилоидные бляшки [36] (рис. 3).
Aβ42-позитивные отложения также формируются на ранних стадиях у больных БА и больных с синдромом Дауна. Внутриклеточная сборка происходит ступенчато от мономерной формы к олигомерам, протофибриллам и фибриллам. Мономеры не являются патогенными, однако уже начальное образование фибрилл, связанное с нарушением синтеза белка, делает бета-амилоид токсичным. Образование бета-амилоидных отложений связано с гиперфосфорилированием тау, нарушением функции митохондрий, дисрегуляцией гомеостаза кальция, синаптической недостаточностью и когнитивной дисфункцией. На сегодняшний день наиболее привлекательным подходом к лечению БА является разработка лекарств, которые влияют на стабильность, удаление или агрегацию бета-амилоида. Гипотеза об участии иммунной системы получила свое подтверждение, и с тех пор разрабатывается всё большее число вакцин для использования в качестве антиамилоидных агентов.
1.1. Вакцины Наиболее известной вакциной является препарат Solanezumab компании «Ely Lilly» (США) [37], который действует на растворимые мономерные формы белка. Интересно, что вакцина потерпела неудачу в двух обширных клинических исследованиях на фазе III, но для некоторого числа пациентов, находившихся на ранних стадиях заболевания, были получены неплохие результаты. Поэтому компания «Ely Lilly» решила провести исследования по фазе III для тестирования препарата на более узкой группе пациентов. На начало 2018 года появились первые сообщения о невысокой эффективности препарата на третьей фазе испытаний и переводе его на испытания у пациентов с умеренными когнитивными нарушениями (MCI) [38]. Ожидаемый успех препарата Solanezumab помог компании «Biogen Inc.» (США) получить разрешение на проведение клинических исследований фазы III после завершения фазы I своей вакцины Aucanumab, которая представляет собой моноклональные антитела IgG1 человека, полученные от пациента с БА методом обратной трансляционной медицины с использованием клеток яичника китайского хомяка. Вакцина действует на агрегированные формы бета-амилоида [39]. Параллельно компания «Hoffmann-La Roche» (Швейцария) инициировала исследования препарата Gantenerumab, в основе которого также лежит иммуноглобулин IgG1 [40]. Кроме того, на пациентах с формами БА от лёгкой до умеренной компания «Grifols» (Испания) провела испытание препарата, представляющего собой комбинацию IGIV [41] – жидкой формы пастеризованного высокоочищенного IgG иммуноглобулина человека с альбумином. Другая вакцина, Gammagard [42,43], основанная на иммуноглобулине IgG, была исследована компанией «Baxalta Inc.» (США), однако данные о продолжении разработки этого препарата отсутствуют. Серьезным провалом закончились исследования препарата Bapineuzumab компании OOP&Johnson [44,45]. Bapineuzumab представляет собой моноклональные антитела, действующие на растворимые формы амилоида. В результате клинические исследования фазы III Bapineuzumab для лечения лёгкой и умеренной форм БА были прекращены. Это было самое серьёзное разочарование в области исследований препаратов для лечения БА за последние годы. Убыток от отрицательных результатов этих исследований оценивался в 340 млн долл. США [46]. В компании «AFFiRiS» (Австрия) была разработана технология «аффитопа», в которой специфические антитела действуют против коротких фрагментов антигенов и не вызывают аутоиммунных побочных эффектов. В настоящее время компания тестирует препарат AD-04 [47,48]. Ранее та же компания проводила исследование фазы II вакцины AD-02 [49], избирательно действующей на пептиды Aβ40 и Aβ42, однако данные о дальнейшей судьбе этого препарата недоступны. ACI-24 – олигоспецифическая вакцина на основе липосом, содержащая пептид с тетрапальмитатом Aβ1-15, разработана компанией «AC Immune’s Supramolecular Technology» (Швейцария) [50]. Компанией «Eisai» (Япония) разработан препарат BAN-2401 на основе моноклональных антител, который селективно связывает, нейтрализует и удаляет растворимые протофибриллы, являющиеся токсичными агрегатами бета-амилоида [51]. В сентябре 2015 года транснациональная фармацевтическая компания «United Biomedical» запустила препарат UB-311 – вакцину, объединяющую последовательности N-конца амилоидного фрагмента Aβ1-14 и иммуногенов с чужеродными эпитопами Т-лимфоцитов [52,53]. Другой препарат, Crenezumab, представляющий собой моноклональные антитела человека IgG4kappa, воздействующий на растворимый и агрегированный бета-амилоид, был разработан компаниями «AC Immune» (Швейцария) и «Genetech» (США) [54] и вначале не прошёл фазу II клинических исследований, однако был повторно введён в фазу I в более высокой дозе (в настоящее время он находится на фазе II). В отличие от Crenezumab, препарат Ponezumab (PN-1219, разработанный компанией «Pfizer» (США)) [55], представляющий собой моноклональные антитела человека IgG2kappa, не прошёл II фазу клинических исследований на пациентах с БА. В настоящее время он проходит фазу II исследований на пациентах с церебральной ангиопатией. Прошедшее десятилетие было посвящено разработкам эффективных вакцин на основе различных форм иммуноглобулинов для лечения БА и лёгких когнитивных нарушений (англ. Mild Cognitive Impairments, MCI). Обычный иммуноглобулин человека содержит в основном иммуноглобулин G (IgG) с широким спектром антител против инфекционных агентов. IgG конкурентно блокирует Fc-гамма-рецепторы, предотвращает связывание и поглощение фагоцитов и уменьшает количество тромбоцитов. Он широко используется для лечения синдромов первичного иммунодефицита, таких как агаммаглобулинемия и гипогаммаглобулинемия, связанных с X-хромосомой, тяжелых комбинированных иммунодефицитных состояний, хронического лимфоцитарного лейкоза с тяжелой вторичной гипогаммаглобулинемией и ряда других заболеваний. Компания «Octapharma AG» (Германия) разрабатывает иммуноглобулин (IVIG) для внутривенного применения, также известный как Octagam. Препарат находится на фазе II клинических исследований для лечения лёгких и умеренных форм БА и на фазе III для лечения рассеянного склероза. Эффективность препарата была ранее показана на пациентах с БА [56]. Хотя объёмы и продолжительность исследований были недостаточными для окончательных выводов, МРТ-исследования показали значительное дозозависимое ослабление снижения метаболизма глюкозы. У всех пациентов с БА, получавших 10% Octagam, было зафиксировано снижение метаболизма глюкозы по сравнению с показателями в группе, получавшей плацебо. Было также отмечено, что лечение низкими дозами было более эффективным, чем высокими дозами. В 2017 году в клинических исследованиях на фазе I находилось девять вакцин, из которых пять являются препаратами, влияющими на бета-амилоид (без указания типа амилоидной формы). К ним относятся препараты на основе моноклональных антител SAR-228810 («Sanofi», Франция) [57], MEDI-1814 («AstraZeneca», Великобритания) [58], KHK-6640 («Kyowa Hakko Kirin», Япония) [59] и два препарата Lu-AF-20513 («Lundbeck», Дания) [60] и TTP-4000 («Trans Tech Pharma», США) [61] на основе рекомбинантных белков, сочетающих повторы пептида бета-амилоида с последовательностями столбнячного токсина. 1.2. Ингибиторы процессинга белка-предшественника амилоида (APP) Помимо вакцин существует множество химических соединений, которые влияют на патологию амилоида путём замедления накопления патогенного бета-амилоида. Один из наиболее привлекательных подходов заключается в ингибировании ферментов, участвующих в процессинге APP, который приводит к образованию бета-амилоидных отложений. Эта группа ферментов включает бета- и гамма-секретазы, непосредственно связанные с образованием бета-амилоидных включений и активацией альфа-секретазы, которая катализирует расщепление APP, генерируя непатогенный амилоидный пептид. Большинство разрабатываемых лекарственных кандидатов представляют собой ингибиторы бета-секретазы (BACE-1). В частности, препараты MK8931 (или Verubecestat) [62] компании «Merck & Co.» (Германия); препарат AZD-3293 (LY-3314814) для перорального введения [63], разработанный совместно компаниями «AstraZeneca» и «Eli Lilly»; а также препарат JNJ-54861911 («Janssen Research & Development», Италия) [64], который в настоящее время находится на фазе III клинических исследований для лечения лёгкой и умеренной форм БА. Ингибитор BACE-1 препарат E-2609 компании «Eisai» [65] находится на фазе II, тогда как препарат BI-1181181, разработанный «Boehringer Ingelheim» (Германия) [66], — на фазе I клинических исследований. В настоящее время в клинических исследованиях участвуют два ингибитора гамма-секретазы: EVP-0962 компании «FORUM Pharm» [67], который является модулятором этого фермента (фаза II клинических исследований), а также BMS-932481 компании «Bristol-Myers Squibb» [68], тоже ингибирующий гамма-секретазу (I фаза клинических исследований). 1.3. Препараты против агрегации бета-амилоида В дополнение к вакцинам и ингибиторам ферментов, действующих на процессинг APP, существует ещё одна довольно разнообразная группа соединений, предотвращающих агрегацию бета-амилоида, что приводит к остановке его накопления и формирования амилоидных бляшек. В настоящее время проводятся клинические исследования фазы III для препарата ALZT-OP1, разработанного компанией «AZ Therapeutics» [69] для профилактики и лечения ранней стадии БА. Это комбинированная лекарственная терапия, состоящая из введения двух ранее одобренных препаратов (cromolyn sodium и ibuprofen), которые, как было показано, способны ингибировать агрегацию бета-амилоида. Препарат GV-971, разработанный в Китае для перорального лечения лёгкой и умеренной форм БА [70], является олигоманнуратом натрия и в настоящее время проходит клинические исследования на фазе III. Препарат показал способность снижать токсичность бета-амилоидного пептида in vitro. На фазе II клинических исследований находятся ещё несколько низкомолекулярных соединений, которые могут быть отнесены к общей группе «антиамилоидогенных» препаратов. Несколько лет назад препарат Phenserine, известный ингибитор AChE, находился на клинических исследованиях на фазе III для терапии когнитивных нарушений, связанных со старением и БА, с целью определения его способности к снижению уровня APP и самого бета-амилоида в плазме и ликворе. Статистический анализ результатов не показал заметных улучшений у пациентов экспериментальной группы по сравнению с группой пациентов, принимающих плацебо. Однако более подробные анализы показали положительный эффект у пациентов, получавших самую высокую дозу препарата. Компания «QR Pharma» в настоящее время тестирует препарат Posiphen, который представляет собой (+)-изомер Пансерина, действующего как антиамилоидогенный агент, в клинических исследованиях на фазе II для лечения лёгких когнитивных нарушений, БА и болезни Паркинсона (БП). В доклинических исследованиях на грызунах препарат показал способность к снижению уровня APP и бета-амилоида, при этом побочные эффекты отсутствовали [71]. Scyllo-Inositol (ELND005) [72], низкомолекулярный ингибитор агрегации бета-амилоида, находится на фазе II/III клинических исследований для перорального применения при лечении БА. Основные положительные эффекты, связанные с уменьшением агрегации бета-амилоида у пациентов с БА, до сих пор не опубликованы, хотя результаты клинических исследований были неоднозначными [73]. Также препарат проходит фазу II клинических испытаний для лечения молодых людей с синдромом Дауна без деменции. Препарат Ro-63-8695 компании «GlaxoSmithKline» [74,75] позиционируется как агент, предотвращающий амилоидоз в головном мозге. Ro-63-8695 известен и как селективный ингибитор сывороточного амилоидного белка (SAP). Это было показано в клиническом исследовании лечения деменции альцгеймеровского типа, которое проводила компания «Pentraxin Therapeutics». Препарат ALZ-801 компании «Alzheon» [76], известный ранее как BLU-8499, является «пролекарством» антиамилоидогенного агента Tramiprosate, мишенью которого является агрегация амилоидного белка. В настоящее время он находится на фазе I клинических исследований. Особое внимание следует обратить на группу соединений, действие которых нацелено на процесс формирования амилоидных бляшек и нейрофибрилл. Фаза I клинических исследований начата для препарата SAN-61, разработанного компанией «Diamedica Company» [77]. Это первый в своем классе препарат, который стимулирует пролиферацию нервных стволовых клеток, действующих одновременно на амилоидные бляшки и нейрофибриллярные агрегаты. Другим препаратом с двойным действием является небольшая молекула Exebryl-1 компании «ProteoTech» [78]. Препарат модулирует активность альфа- и бета-секретаз, что приводит к значительному уменьшению образования и накопления бета-амилоида в головном мозге трансгенных животных, моделирующих БА. Первоначальные результаты исследований позволяют предположить, что Exebryl-1 может иметь двойное действие – ингибировать синтез и уменьшать количество тау, что предотвращает образование парных спиралей, необходимых для формирования нейрофибрилл. Структуры низкомолекулярных лекарств, влияющих на производство бета-амилоида, приведены на рисунке 4.
2. ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА АГРЕГАЦИЮ БЕЛКА ТАУ В настоящее время хорошо известно, что нейрофибриллы, один из основных признаков БА, состоят из агрегированного гиперфосфорилированного тау. Как правило, связанный с микротрубочками тау, по-видимому, имеет решающее значение в активности нейронов, поскольку способствует стабилизации микротрубочек в клетках. Однако при патологических состояниях тау фосфорилируется различными киназами, что уменьшает его связывание с микротрубочками и вызывает секвестрирование гиперфосфорилированного тау в нейрофибриллярных пучках. Потеря функции тау приводит к дестабилизации микротрубочек и уменьшению аксонального транспорта, а также к выраженному токсическому эффекту агрегированного гиперфосфорилированного тау, что способствует развитию нервной патологии [79] (рис. 5).
Как и в случае с разработкой антиамилоидных препаратов, в настоящее время существует несколько вакцин, влияющих на агрегаты тау. Одна из них – препарат RG-7345 компании «Genetech, Hoffmann-La Roche» – представляет собой препарат для пассивной иммунотерапии на основе тау [80] и в настоящее время находится на I фазе клинических исследований. Другая вакцина, AADvac-1, разработанная компанией «Axon Neuroscience» [81], прошла исследования фазы I и последующий 18-месячный этап на пациентах с лёгкой и умеренной формами БА. Компания «Axon» в настоящее время набирает пациентов для фазы II исследований. Препарат ACI-35 компании «ACImmune» [82,83] прошёл исследования фазы I на пациентах с лёгкой и умеренной формами БА. Соединение BMS-986168, препарат, предотвращающий связывание тау с микротрубочками, находится на ранних клинических исследованиях в «Bristol-Myers Squibb» как средство для лечения таупатий и прогрессирующего супрануклеарного паралича [84]. Большие ожидания в последние годы связаны с известным красителем и дезинфицирующим средством – метиленовым синим (Methylene blue, MB). Хотя способность блокировать агрегацию тау белка метиленовым синим и его аналогами была показана ещё 20 лет назад [85], исследование его в качестве препарата против болезни Альцгеймера в последнее время набирает обороты в основном из-за многочисленных неудач в разработке антиамилоидных препаратов. Препарат TauRx, который представляет собой модифицированную форму MB, успешно прошёл фазу II клинических исследований (TRx-0014) на пациентах с БА [86,87] и перешёл на фазу III на пациентах с когнитивными расстройствами (Stanley Medical Research Institute – Институт медицинских исследований Стэнли). Также доступны данные исследований препарата TRx-00237 на фазе III для пациентов с БА. Препарат TRx-00237 представляет собой лейко-форму MB [88]. Этот препарат показал свойство ингибировать моноаминооксидазу B, синтез оксида азота и блокировать агрегацию тау. Этот препарат также находится в клинических исследованиях фазы III как препарат для лечения пациентов с деменцией Пика. Недавно был опубликован подробный обзор последних результатов клинических исследований метиленового синего (MB) [89]. Другой препарат – TPI-287, представляет собой производное Таксана. Он способен стабилизировать структуру микротрубочек. В настоящее время проходит фаза I клинических исследований данного препарата для лечения пациентов с легкой и умеренной формами БА, а также некоторых других расстройств, связанных с нарушением внутриклеточного транспорта [90]. Структуры препаратов, влияющих на агрегацию тау, представлены на рисунке 6.
3. ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА РЕЦЕПТОРЫ ЦНС Большая группа соединений была разработана в качестве потенциальных препаратов для лечения БА, направленных на рецепторы различных типов, вовлечённые в сигнальную трансдукцию в нейронах. Часто такие соединения рассматриваются как «сигнальные модуляторы», влияющие на уровень синаптической передачи. Структуры препаратов, влияющих на рецепторы центральной нервной системы (ЦНС), и модуляторы ионных каналов показаны на рисунке 7.
3.1. Лиганды рецепторов серотонина Серотонин (5-гидротриптамин, 5-НТ) участвует в регулировании множества физиологических функций, действуя через разнородное семейство рецепторов, которое включает в себя рецепторы, связанные с G-белком, а также лиганд-ионные каналы. Хотя серотонинергические нейроны содержат разветвленную и сложную сеть, которая связана почти с каждой структурой мозга, серотониновая медиаторная сигнальная система находится под строгим временным и пространственным контролем. Дисбаланс в серотонинергической системе связан со многими патофизиологическими состояниями, включая шизофрению, БА, тревожные и депрессивные расстройства. Среди различных групп рецепторов 5-НТ наибольшее внимание уделяется 6-му и 4-му подтипам серотониновых рецепторов, связанных с процессами когнитивной консолидации памяти [91]. Наиболее изученным препаратом является Lu-AE-58054 компании «Lundbeck», который представляет собой селективный антагонист 6-го подтипа серотониновых рецепторов (5-HT6R) и в настоящее время проходит фазу III клинических исследований для лечения деменций альцгеймеровского типа в умеренной стадии как дополнение к лечению Донепезилом (Donepezil) [92]. Препарат Intepirdine (SB-742457) [93] также является антагонистом 5-HT6R и проходит клинические исследования фазы III в компании «Axovant Sciences» для лечения пациентов в легкой и умеренной стадиях БА, а также в фазе II клинических исследований для лечения пациентов с деменцией с тельцами Леви. Ранее препарат проходил клиническую оценку в «GlaxoSmithKline» для лечения деменции альцгеймеровского типа, однако о результатах исследований не сообщалось. Препарат SUVN-502 компании «Suven Life Science» [94] – мощный селективный мозговой пенентрант и активный антагонист 5-HT6R, который в настоящее время проходит клинические исследования фазы II в компании «Suven Life Science» для симптоматического лечения БА. Продукт, структурно близкий к Intepirdine, AVN-322, разработан компанией Avineuro [95] и в настоящее время проходит фазу I клинических исследований. Препарат RP-5063 компании «Reviva Pharma» [96] представляет собой соединение с выраженным мультитаргетным действием для перорального применения в клинических исследованиях фазы I для лечения биполярных расстройств, депрессии, БА и болезни Паркинсона (БП), а также других расстройств с гиперактивностью и дефицитом внимания. В дополнение к ингибированию серотониновых рецепторов (5-НТ6R и 5-НТ7R) этот препарат является частичным агонистом дофаминовых рецепторов D2, D3 и D4. 3.2. Лиганды ацетилхолиновых (никотиновых) рецепторов Никотиновые рецепторы ацетилхолина (ACh) (nAChR) и семейство мускариновых рецепторов (mAChR) являются мишенями ацетилхолина в головном мозге. При болезни Альцгеймера поражаются оба семейства рецепторов. Недавно было продемонстрировано, что бета-амилоид взаимодействует с nAChR. В частности, было показано, что экспрессия и функция nAChRs при БА регулируются прямым взаимодействием с бета-амилоидом. Таким образом, соединения, мишенью которых являются эти взаимодействия, могут открыть новое направление разработки лекарственных средств для улучшения когнитивных функций у больных БА [97,98]. Препарат Encenicline hydrochloride, агонист никотинового 7-го подтипа альфа-nAChR (α-7-nAChR) рецепторов, был разработан компанией «Bayer» для перорального применения. Он проходит фазу III клинических исследований для лечения когнитивных расстройств, связанных с БА и шизофренией, а также находится на фазе II клинических исследований для лечения никотиновой зависимости. В сентябре 2015 года глобальная программа, проводимая «FORUM Pharmaceuticals», была приостановлена FDA из-за серьёзных случаев вредного воздействия на желудочно-кишечный тракт, о которых сообщалось в исследованиях. В ноябре 2015 года ограничение было снято для лечения когнитивных нарушений у пациентов с шизофренией. Ещё два агониста nAChR находятся на фазе II клинических исследований. К ним относятся два препарата: агонист α-7-nAChR Nelonicline (ABT-126 компании «AbbVie») [99] и агонист альфа-4-beta-2-nAChR, AZD-3480 (Isproniciline, разработанный компанией «Targacept») [100], оба препарата были предложены в качестве средств для лечения когнитивных расстройств у взрослых пациентов с шизофренией и для лечения легкой и умеренной форм БА. Данные о ходе работы в настоящее время недоступны. 3.3. Лиганды глутаматных рецепторов Глутаматные рецепторы (GluRs) играют ключевую роль в синаптической передаче сигнала, которая, как полагают, лежит в основе обучения и памяти. Роль этих рецепторов послужила основанием для разработки одной из первых стратегий в поиске лекарственного средства для лечения БА среди лигандов GluR разных типов [101]. Ранее уже упоминалось, что один из немногих препаратов, используемых в настоящее время для лечения БА – Мемантин – является антагонистом ионотропного глутаматного рецептора (NMDAR). Этот подтип GluR вызывает большой интерес, и многие компании продолжают целенаправленный поиск подходящих лигандов для NMDA-рецептора. Однако только один из прямых аналогов Мемантина в настоящее время находится на стадии доклинических исследований – препарат Nitromemantine, производное Мемантина, разработанный компанией «S. Lipton» [102]. Другим антагонистом NMDA-рецептора является соединение AVP-786 (CTP-786). Это лекарственный препарат, содержащий дейтерированную форму декстрометорфана и хинидинсульфата, который находится в клинических исследованиях на фазе III в компании «Avanir» для лечения тревожности у пациентов с БА, а также тестируется на пациентах с депрессией и невротической болью [103]. Препарат обладает мультитаргетным механизмом действия и включает блокаду P-гликопротеинов, а также активацию Sigma-1 рецепторов, расположенных в мембранах эндоплазматического ретикулума. Препарат PXT-864 компании «Pharnext» [104], представляющий собой комбинацию Баклофена и Акампросата, также имеет выраженное мультитаргетное действие. Он показал себя как антагонист NMDA-рецептора, агонист ГАМК-рецептора (ГАМК – гамма-аминомасляная кислота) и модулятор метаботропных рецепторов GluRs. Препарат проходит фазу II клинических исследований. Альтернативные подходы, связанные с активацией NMDA-рецепторов, были изучены группой исследователей из Мемориальной больницы Чан Гунн (Chang Gung Memorial Hospital). Разработанное соединение, DAOI-B, представляет собой производное бензоата натрия. Препарат ингибирует оксидазы D-аминокислот, отвечающие за деградацию D-серина и D-аланина, повышая уровень D-аминокислот, которые, в свою очередь, действуют как лиганды сайта-коагониста NMDA-рецептора [105]. Исследователи предположили, что DAOI-B может быть эффективным для улучшения когнитивных функций у пациентов с лёгкими когнитивными расстройствами или лёгкой формой БА. Однако хотя исследования фазы II были завершены в 2013 году, результаты этих исследований по-прежнему недоступны. Другой ионотропный подтип глутаматных рецепторов (GluR), так называемый рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPAR), играет ключевую роль в консолидации памяти [106] и является мишенью для соединения S-47445 (ранее известного как CX-1632) [107]. Это позитивный модулятор AMPAR, который находится в клинических исследованиях фазы II в компании «Servier» как препарат для лечения БА. Продукт был разработан совместно компаниями «Servier» и «Cortex Pharma» (ныне «RespireRx Pharmaceuticals») с использованием технологии Ampakine. 3.4. Лиганды других рецепторов и ионных каналов В 2016-2017 годах были проведены клинические исследования III фазы препарата Memryte для лечения деменции альцгеймеровского типа [108]. Memryte представляет собой лейпролид ацетат, производимый с использованием технологии биоразлагаемых имплантов «Durin», действующий как агонист рецептора гонадотропин-релизинг-гормона 1-го типа GnRH (LHRH). Технология биоразлагаемых имплантатов Durin, которая используется как длительно действующая платформа для парентеральной доставки ацетата лейпрорелина, была разработана компанией «Durect» в сотрудничестве с фирмой «Curaxis Pharmaceutical». Результаты проводимых исследований пока не опубликованы. Препарат Masitinib mesylate также находится на фазе III клинических исследований, проводимых компанией «AB Science» для лечения ряда заболеваний, включая БА, рассеянный склероз, множественную миелому, меланому и метастатический колоректальный рак. Masitinib mesylate является селективным ингибитором рецепторной тирозинкиназы c-KIT (рецептор c-KIT), рецептора фактора роста тромбоцитов и фактора роста фибробластов – рецептора тирозинкиназы-3 (FGFR-3) [109]. Препарат для лечения БА Nilvadipine (ARC-029) [110] проходит фазу III клинических исследований в Институте Роскампа (Roskamp Institute) и Институте неврологии в Тринити Колледже (Trinity College Institute of Neuroscience). Препарат Nilvadipine, который был запущен в 1989 году компанией «Astellas Pharma» для перорального лечения гипертонии, показал свойства блокатора кальциевых каналов. Препарат является антагонистом обоих каналов кальциевых ионов L- и T-типа и оказывает антиоксидантное действие. Модифицированный препарат ARC-031 [111] компании «Archer Pharmaceuticals» работает так же, как его предшественник ARC-029, но при этом в сопоставимых дозах не обладает антигипертензивным эффектом. В настоящее время клинические исследования фазы II проходят около 20 различных лигандов рецепторов и модуляторов ионных каналов. Два потенциальных лекарственных препарата представляют собой специфические антагонисты H3-гистаминовых рецепторов (H3R), которые вырабатываются в основном в ЦНС и следовательно, представляют собой привлекательную фармакологическую мишень, в частности, для лечения БА и лёгких когнитивных расстройств [112]. Препарат S-38093 компании «Servier» [113] исследовался на II фазе клинических исследований для лечения БА, однако о последних результатах не сообщалось. Другим антагонистом H3-рецептора является препарат SUVN-G3031, который проходит фазу I клинических исследований в компании «Suven Life Sciences» для лечения когнитивных расстройств, связанных с БА [114]. Среди других лигандов рецепторов в нейронах следует упомянуть следующие соединения: AUS-131 – негормональный селективный бета-агонист рецептора эстрогена, который направлен на улучшение функциональной активности митохондрий головного мозга [115]. Препарат ORM-12741 компании «Orion» [116] – антагонист альфа 2С-адренорецептора, препарат AN2/AVex-73 (Anavex-2-73 компании «Anavex Life Science») [117] блокирует натриевые каналы и действует как агонист рецепторов Sigma-1 и мускариновых рецепторов M1, а также как ингибитор AChE и находится в клинических исследованиях в сочетании с Донепезилом. В сентябре 2015 года было объявлено о завершении фазы II исследований препарата Dexpramipexole компании «Biogen» [118], который ранее предлагался для лечения бокового амиотрофического склероза. Препарат представляет собой стереоизомер агониста рецептора дофамина – Pramipexole [119] и близкого аналога Рилузола (Riluzole). Basmisanil (RG-1662) является агонистом рецептора ГАМК. Препарат разработан компанией «Roche» для улучшения когнитивного поведения при лечении деменции типа БА. Препарат Levetiracetam, разработанный компанией «AgeneBio», блокатор кальциевого канала N-типа (Ca (v) 2,2), был первоначально запущен в качестве средства для вспомогательной терапии при лечении парциальных припадков со вторичной генерализацией или без неё у взрослых людей, страдающих эпилепсией. Сейчас он находится на фазе II клинических исследований на пациентах с БА с умеренными когнитивными нарушениями [120,121]. Для препарата Рилузола (Rockefeller University) [122,123], который в настоящее время используется для лечения бокового амиотрофического склероза, начались клинические исследования фазы II на пациентах с БА. Препарат обладает мультитаргетным механизмом действия, включающим группу мишеней в глутаматергической системе, а также различные типы ионных каналов [124]. 4. ИНГИБИТОРЫ ФЕРМЕНТОВ, УЧАСТВУЮЩИХ В ПЕРЕДАЧЕ СИГНАЛА В НЕЙРОНАХ Стратегия модуляции ферментов основана на улучшении или восстановлении способности переноса сигнала. Мишенями являются специфические ферменты, обнаруженные при исследовании механизма БА. Структуры ингибиторов ферментов, влияющих на передачу нейронных сигналов, показаны на рисунке 8.
4.1. Ингибиторы холинэстеразы Исторически ингибиторы холинэстераз (ChEI) – это первая и наиболее изученная группа препаратов, предлагаемых для лечения БА. Согласно классической концепции воздействия ингибиторов AChE на нейротрансмиссию, считается, что основной эффект ингибиторов холинэстеразы связан с увеличением продолжительности действия и концентрации нейротрансмиттера ацетилхолина (ACh) в синаптическом пространстве. Это приводит к потенцированию активности холинергических рецепторов, которая уменьшается при патологических процессах у пациентов с БА [125,126]. Однако величина эффекта ингибиторов холинэстераз зависит от целостности пресинаптических нейронов. По-видимому, эффект будет уменьшаться на поздних стадиях заболевания, когда наблюдается значительное снижение количества холинергических нейронов [127]. В настоящее время исследования ChEI все ещё продолжаются, хотя и не такими высокими темпами. В настоящее время наряду с изучением ингибиторов ацетилхолинэстеразы активизировался поиск селективных ингибиторов бутирилхолинэстеразы (BuChE) [128] и специфических блокаторов периферических сайтов AChE, которые предположительно участвуют в действии на бета-амилоид [30,129]. Особый интерес представляет специфический ингибитор BuChE – Bisnorcymserine компании «QR Pharma» [130,131] и неселективный ингибитор BuChE и AChE – Memogain (GLN-1062 компании Neurodyn Life Sci.) [132], который является производным известного средства для лечения БА – препарата Galantamine. Оба соединения проходят клинические исследования фазы I. Ярким примером направленного дизайна мультитаргетного препарата, действующего на два ключевых фермента, ответственных за метаболизм нейротрансмиттеров, является Ladostigil компании Avraham. Препарат действует как ингибитор AChE, а также моноаминоксидаз A и B. Он показал обнадеживающие результаты в клинических исследованиях фазы II, однако не прошёл фазу III. В настоящее время препарат проходит исследования фазы II на пациентах с мягкими когнитивными расстройствами [133].4.2. Ингибиторы 11β-гидроксистероиддегидрогеназы В настоящее время клинические исследования потенциальных препаратов для лечения БА проводятся на двух препаратах с одним механизмом действия: препарат UE-2343 проходит исследования фазы II, которые проводит компания Actinogen [134], и препарат ASP-3662 – клинические исследования фазы I, которые проводит компания Astellas Pharma [135]. Препарат ASP-3662 исследуется и как средство для лечения диабетической периферической нейропатии и проходит в настоящее время фазу II клинических исследований. 4.3. Ингибиторы моноаминоксидазы Rasagiline – селективный и мощный необратимый ингибитор моноаминоксидазы B (MAO-B) – разработан компанией «Teva» на основе исследований препарата Technion Технологического института Израиля (Israel Institute of Technology). Rasagiline проходит фазу II клинических исследований как средство для лечения БА, а также фазу III клинических исследований как препарат для перорального применения при лечении прогрессирующего супрануклеарного паралича. Препарат разрабатывается и как средство для лечения множественной системной атрофии паркинсонического подтипа (исследования фазы II проводятся компанией «Teva»). К сожалению, данных о проведенных исследованиях опубликовано не было. Известно, что в настоящее время препарат находится в фазе II клинических исследований, проводимых компанией «Teva» как препарат для монотерапии у пациентов с ранней стадией болезни Паркинсона и как дополнительный препарат в лечении от умеренной до поздней стадий болезни Паркинсона [136]. 4.4. Фосфолипаза А2 Ингибирование фосфолипазы A2 считается основным механизмом действия препарата Rilapladib (SB-659032), разработанного компанией «GlaxoSmithKline» [137]. Клинические исследования препарата на пациентах с БА завершены в 2015 году, однако результаты этих исследований пока не опубликованы. Ингибирование фосфолипазы A2 также упоминается как основной механизм действия препарата GSK-2647544, который находится на клинических исследованиях фазы I, инициированных компанией GSK [138]. Данных по результатам исследований этого соединения опубликовано не было. 4.5. Ингибиторы фосфодиэстеразы (PDE) Препарат BI-409306, разработанный компанией Boehringer Ingelheim [139] и действующий на фермент PDE-9A, в настоящее время проходит фазу II клинических исследований. В конце 2015 года компания «Tetra Discovery Partners» начала фазу I клинических исследований низкомолекулярного соединения BPN14770 – нового гетероарильного производного, представляющего собой отрицательный аллостерический модулятор другого фермента этого класса – PDE-4D [140]. 4.6. Ингибиторы киназ и циклаз Bryostatin 1 (Blanchette Rockefeller Neurosciences Institute) [141] – мощный активатор дельта- и эпсилон-изомеров протеинкиназы C, в настоящее время находится в фазе II клинических исследований как препарат для лечения пациентов с лёгкой и умеренной стадиями БА. Фаза II клинических исследований начата также для препарата VX-745 [142,143], который ингибирует MAPK p38 (митоген-активированную протеинкиназу p38) – сигнальную киназу, принимающую участие в формировании воспалительных процессов в глиальных клетках. Препарат PQ-912 – низкомолекулярный ингибитор глутаминилциклазы – проходит фазу I клинических исследований в компании «Probiodrug AG» [144]. 5. ПРОЧИЕ ПРЕПАРАТЫ, В ТОМ ЧИСЛЕ АНТИОКСИДАНТЫ И СОЕДИНЕНИЯ С НЕРАЗГЛАШЁННЫМИ МИШЕНЯМИ ИЛИ МЕХАНИЗМАМИ ДЕЙСТВИЯ 5.1. Нейротрофические препараты, в том числе на основе стволовых клеток В настоящее время имеется несколько препаратов, проявляющих нейротрофическую активность. Так, препарат T-817MA показал себя как нейропротектор для перорального применения при лечении БА на фазе II исследований в компаниях «Toyama» и «FUJIFILM» [145]. Препарат стимулирует рост нейритов и проявляет нейропротекторный эффект за счёт снижения окислительного стресса. Короткий олигопептид Davunetide (AL-108) [146,147], содержащий восемь аминокислотных остатков, – наименьший по размеру активный компонент нейропротекторного белка ADNP (Activity-Dependent Neuroprotective Protein), который представляет собой глиальный клеточный медиатор – нейрогормон (вазоактивный интестинальный полипептид). Доклинические исследования показали, что он обладает мощными нейропротекторными и нейротрофическими свойствами, усиливающими память. Клинические исследования компании Paladin проводились для лечения лёгких когнитивных расстройств, вызванных шунтированием артерий сердца, а также для лечения БА и некоторых других деменций. Результаты исследований AL-108 опубликованы не были. Компания «Medipost» проводит клинические исследования совмещённой фазы I/II препарата Neurostem-AD [148,149], основу которого составляют мезенхимальные стволовые клетки. Известно, что препарат прошел фазу I и перешёл на фазу II, однако результаты исследований в доступных источниках не опубликованы. Известны несколько препаратов, которые показали своё нейротрофическое действие на ранних фазах клинических исследований. Так, препараты FGL-2 [150], FGL-lop peptide [151] компании Enkam представляют собой макромолекулярные стимуляторы фактора роста фибробластов, а препарат NsG-0202 компании «NsGene» стимулирует секрецию факторов роста нейронов [152]. Недавно было начато новое исследование макромолекулярного препарата Copaxone (Glatiramer acetate компании «Cedar-Sinai Medical Center») [153]. Препарат относится к классу иммуномодуляторов и ранее использовался для лечения рассеянного склероза. Клинические исследования фазы II начаты и для препарата Sargramostim (Leukine), разработанного Университетом Колорадо (University of Colorado) для лечения нейропатии и рака простаты [154,155]. Показано, что Sargramostim действует как гранулоцитарно-макрофагальный колониестимулирующий фактор. 5.2. Противовоспалительные агенты и антиоксиданты Иммунная система является важным участником патогенеза БА [156,157]. Модуляторы иммунной системы, такие как нестероидные противовоспалительные препараты (НПВС), изучаются в качестве препаратов для снижения риска развития БА. Поскольку долгосрочное использование НПВС связано с уменьшением числа случаев БА в эпидемиологических исследованиях, то рандомизированные контролируемые клинические исследования не повторяли эти результаты. Тем не менее, предпринимаются новые попытки поиска более эффективных лекарств для лечения БА среди противовоспалительных препаратов [158]. В частности, компания «GNT Pharma» разрабатывает препарат AAD-2004 [159] в качестве ингибитора синтеза цитокинов. Препарат проходит клинические исследования фазы I. Исследуется также соединение GC -021109 компании «GliaCure» [160], действующее как индуктор фагоцитоза. Одной из наиболее известных нейропротекторных стратегий поиска препаратов для лечения БА является терапия антиоксидантами, основанная на многочисленных наблюдениях того, что процессы нейродегенерации в ЦНС часто инициируются или поддерживаются окислительным стрессом [161]. В настоящее время в клинических исследованиях находятся несколько препаратов, которые известны как антиоксиданты с мультитаргетным механизмом действия. Это диетические добавки: Lu-AF-2053 компании «Lundbeck» [60], Etanercept компании «Life Extension Found» [162], куркумин, кверцетин, рыбий жир и несколько других физиологически активных веществ, а также растительный экстракт HX-106 от «VitroMed» [163]. В конце 2015 года в Университете Шарите (Charite University) завершились исследования фазы III лекарственного средства на основе компонента экстракта японского зеленого чая Epigallocatechin gallate [164]. Результаты пока не опубликованы, однако есть предположение, что Epigallocatechin gallate имеет мультитаргетный механизм действия, аналогичный механизму действия большинства препаратов на основе растительных экстрактов, обладающих выраженным антиоксидантным действием. Ещё один растительный препарат – SK-PC-B70M [165] представляет собой обогащённый олеанолгликозидом сапонина экстракт Pulsatilla koreana, применяемого в традиционной корейской медицине. Препарат разработан компанией «SK Chemicals» как средство для лечения БА и проходит клинические исследования (фаза III), результаты которого пока не опубликованы. Ряд препаратов доступен в качестве пищевых добавок для улучшения состояния пациентов с БА и другими когнитивными патологиями. Например, фитоэстроген – экстракт Ginkgo biloba зарегистрирован в 1992 году в компании «Ipsen and Schwabe» как диетическая пищевая добавка. Препарат улучшает когнитивные функции пациентов с возрастными и периферическими сосудистыми деменциями [166]. Препарат INM-176 (Alzhima 176) компании «SciGenic» – ещё один растительный препарат, основанный на комплексах железистой кислоты. Alzhima 176 был зарегистрирован в 2003 году и используется в ряде пищевых добавок. Обнаружено, что препарат обладает болеутоляющим действием и улучшает состояние пациентов с БА, стимулируя кровообращение. Кроме того, отмечено снижение психических расстройств у больных [167]. Препарат AC-1202 был зарегистрирован в 2009 году как первая пищевая добавка для улучшения метаболических процессов у пациентов с лёгкой и умеренной формами БА. Препарат улучшает энергетический обмен и гомеостаз липидов в головном мозге, нарушенные при БА и других формах деменции [168]. Resveratrol – типичный мультитаргетный препарат и антиоксидант, мишенями которого являются MAO-A, бета-секретаза, оксиданты ксантина, транскрипционный фактор NF-κB и другие [169,170]. Препарат прошёл фазу II клинических исследований на пациентах с БА, но был отозван из исследований на фазе III. Сейчас он используется в сочетании с другими пищевыми добавками в клинических исследованиях на пациентах с лёгкими когнитивными нарушениями. Широко распространенный растительный препарат Curcumin неоднократно изучался в клинических исследованиях на пациентах с БА, однако пока никаких существенных положительных результатов получено не было [171]. В 2015 году тестирование препарата продолжалось на пациентах с умеренными когнитивными нарушениями (University of California Los Angeles – Калифорнийский университет в Лос-Анджелесе). Для девяти препаратов, которые находятся в фазе I клинических исследований, к сожалению, не уточняется механизм действия и не раскрываются структуры этих препаратов. 5.2. Противовоспалительные агенты и антиоксиданты Существует множество препаратов, которые действуют на мишени нервной системы, отличные от установленных причинных факторов БА. Эти препараты часто используются либо для лечения других заболеваний, не обязательно связанных с деменциями, либо в качестве пищевых добавок, поскольку безопасны при длительном применении. Например, Telmisartan в настоящее время находится в клинических исследованиях фазы I для лечения пациентов с БА. Первоначально более 15 лет назад данный препарат был одобрен для лечения гипертонии [172,173]. Компания «Accera» анонсировала совмещённую фазу II/III исследований препарата Axona (AC-1204) [174], первого в своем классе, запущенного в качестве диетического препарата для контроля над метаболическими процессами, связанными с БА, у пациентов в лёгкой и умеренной стадиях. Препарат устраняет дефицит энергии, наблюдаемый в мозге пациентов с БА. Продолжаются исследования препарата Enbrel (Neurokine), рекомбинантного слитного белка, состоящего из части рецептора фактора некроза опухоли (1-235) и Fc-фрагмента человеческого иммуноглобулина IgG1 (236-467) [162]. Первоначально препарат использовали в качестве противовоспалительного средства для лечения ревматоидного артрита. Клинические исследования проводятся также для аналога витамина B1 – Benfotiamine (Burke Medical Research Institute) [175], который применяется в качестве пролекарства как нейропротектор широкого спектра действия против невропатий, неврологических патологий и нарушений коронарного кровообращения. В последние годы внимание исследователей привлёк онколитик Bexarotene, использовавшийся ранее для лечения некоторых форм лимфомы [176,177]. Доклинические исследования на животных показали, что Bexarotene вызывает резкое, но обратимое уменьшение амилоидных бляшек, улучшающее когнитивные функции. Поэтому Кливлендский клинический Фонд (Cleveland Clinic Foundation) начал клинические исследования этого многообещающего препарата в качестве средства для лечения БА. В настоящий момент Bexarotene находится на фазе II, однако данные о результатах исследований пока недоступны. Также проходят клинические исследования другие онколитики, структурно сходные с Bexarotene. Например, Tamibarotene (Osaka City University – Университет Осаки) [178] и Isotretinoin (Oxford University Hospital – Больница Оксфордского Университета), которые широко используются для лечения воспаления сальных желёз [179]. Предлагаемый механизм действия этих препаратов, вероятно, связан с ретиноидными рецепторами ЦНС [180]. Исследования обоих препаратов недавно были завершены, но результаты исследований ещё не опубликованы. Основываясь на результатах, свидетельствующих о сокращении числа случаев БА в группах пациентов с длительной терапией статинами [181], первоначально предназначенными для снижения уровня холестерина (липопротеинов низкой плотности) в крови, были начаты клинические исследования этого класса препаратов на пациентах с БА. С 2004 по 2012 год пациенты с БА были включены в несколько клинических исследований статинов: Pitavastatin компании «Kowa» [182], Atorvastatin (известного как Lipitor), разработанного компанией «Pfizer» [183,184] и Simvastatin компании «NIA» [185,186]. Достоверных положительных результатов этих исследований не было получено до сих пор [187]. Тем не менее, Массачусетский университет в 2015 году инициировал фазу II исследований Simvastatin в сочетании с L-аргинином и тетрагидробиоптерином. Параллельно Университет Шарите (Charite University) продолжает фазу IV исследований статинов на пациентах с умеренными когнитивными расстройствами. Кроме того, проводятся исследования группы препаратов, действующих на гомеостаз инсулина. В частности, на клинических исследованиях находятся рекомбинантный человеческий инсулин короткого действия – Humulin RU-100 компании NIH, представляющий собой раствор кристаллов цинка и инсулина в виде интраназального спрея [188,189]; Insulin detemir (Levemir/Levemir300) – аналог инсулина длительного действия [190]; Liraglutide (Imperial College) [191] и Exenatide («NIH») [192] – рекомбинантные пептидные агонисты глюкагоноподобного пептида-1 человека (7-37 аминокислот); и MSDC-0160 («Metabolic Solutions»), который был первоначально разработан для лечения сахарного диабета 2-го подтипа [193]. Pioglitazone гидрохлорид – активный сенсибилизатор инсулина, который находится в клинических исследованиях фазы III в компании «Takeda» для профилактики умеренных когнитивных нарушений, вызванных БА, в сочетании с биомаркером TOMM40 [194]. На II фазе исследований находятся ещё шесть препаратов, однако исследовательские группы не раскрывают их структуры и механизмы действия: LND-101001 компании «Lupine» [195], MK-7622 компании «Merck & Co.» [196,197], JNJ-54861911 компании «Janssen Research & Development» [64], AVN-397 [198] и AVN-101 [199] компании «Avineuro», а также растительный препарат RPh-201 от компании «Regenera Pharma» [200]. Структуры препаратов (антиоксидантов и соединений с нераскрытыми мишенями или механизмами действия) приведены на рисунке 9.
Полный список препаратов, находящихся на разных стадиях клинических исследований, представлен в таблицах 1-3.
6. ОДОБРЕННЫЕ К ПРИМЕНЕНИЮ ЛЕКАРСТВЕННЫЕ СРЕДСТВА Фармакотерапия БА включает в себя четыре основных препарата, которые наиболее часто используются в настоящее время (рис. 10): Aricept (Donepezil, Донепезил), Rivastigmin (Exelon, Ривастигмин), Galantamine (Reminyl, Галантамин) и Memantine (Namenda, Nougaro, Мемантин и т.д.).
Необходимо отметить, что для терапии БА и/или иных форм деменции был разработан ряд других лекарств, которые в настоящее время применяются реже. В 1986 году компания «Takeda» зарегистрировала препарат Idebenone (Mnesis) в качестве высокоэффективной антиоксидантной ловушки свободных радикалов для перорального применения при лечении деменции альцгеймеровского типа [201]. Известно, что этот препарат используется и для лечения других патологий. В 2015 году сообщалось о лечении мышечной дистрофии Дюшена. В середине 1980-х годов Всероссийским научным центром по безопасности биологически активных веществ был разработан препарат Ipidacrine (Ipidacrinum, Neuromedin, Amiridine (Амиридин), Amiridinum), а в 1990-х годах он был утвержден в качестве стимулятора обучения и памяти для лечения БА и других форм старческого слабоумия, а также для лечения детей, испытывающих трудности в обучении при минимальной церебральной дисфункции [202]. Лицензия на распространение Амиридина (NIK-247) в Японии принадлежит компании «Nikken». Структурно связанный с Такрином, Амиридин значительно снижает токсичность, особенно гепатотоксичность. Компания «Xel Pharmaceuticals» разработала растительный алкалоид – препарат Huperzine (Hupersine A, Cerebra) [203], который действует как ингибитор AChE и антагонист NMDAR. В настоящее время этот препарат широко используется в Китае для лечения БА. Препарат в форме аппликатора для кожи находится на фазе I клинических исследований на пациентах с БА. ЗАКЛЮЧЕНИЕ Таким образом, анализируя современные подходы к исследованию и разработке новых эффективных препаратов для лечения БА, можно определить следующие основные тенденции: 1. Разработка соединений, действующих на основные звенья патогенеза – «болезнь-модифицирующие лекарства» Создание препаратов, действующих на основные звенья патогенеза заболевания (так называемые «болезнь-модифицирующие лекарства») является приоритетной задачей, так как такие препараты способны замедлять развитие структурных и функциональных нарушений в ЦНС, а также обеспечивать устойчивое улучшение когнитивных функций (в случае БА), которое сохраняется даже после отмены препарата [204]. В случае с БА основные направления поиска таких препаратов направлены на снижение образования и стимулирование деградации или удаления основных патоморфологических структурных образований – амилоидных пептидов и нейрофибриллярных клубков. Принципиально важное внимание при этом уделяется поиску и валидации новых молекулярных мишеней и путей, участвующих в патогенезе заболевания. В качестве молекулярных мишеней наибольшее внимание привлекают ферменты, участвующие в формировании и деградации бета-амилоидного пептида (бета-, гамма- и альфа-секретазы), а также ферменты, участвующие в каскаде фосфорилирования тау (Cdk-5). Отдельное внимание уделяется возможности фармакологической коррекции белков системы АроЕ как способа удаления патогенных олигомеров бета-амилоида. В последние годы было предложено несколько перспективных подходов к фармакологической коррекции БА, в частности, стабилизация функций митохондрий (митопротекторы), блокада патологической агрегации белков при нейродегенеративных заболеваниях (препараты, препятствующие развитию протеинопатии), активация эндогенных механизмов защиты клеток путём стимулирования аутофагии и нейрогенеза. Предложено несколько перспективных групп соединений, реализующих эти механизмы на модельных системах. 2. Мультитаргетные лекарства Многофакторный характер БА выражается в том, что в патогенезе этого нейродегенеративного заболевания участвует ряд нейробиологических мишеней, включающих бета-амилоидный пептид и белок тау. В этом контексте концепция мультитаргетных лекарственных препаратов, интегрированно действующих на ряд биологических мишеней, участвующих в патогенезе болезни, при разработке препаратов для лечения БА представляется весьма перспективной. Можно ожидать, что эти препараты смогут не только компенсировать или восстанавливать утраченные когнитивные функции, но и подавлять дальнейшее развитие нейродегенеративного процесса. К таким препаратам относятся лекарства, где в одной структуре совмещаются фармакофоры, действующие как ингибиторы холинэстераз, моноаминоксидаз, антиоксиданты, металлохелаты, либо являющиеся лигандами рецепторов ЦНС и т.п.3. Репозиционирование известных ранее лекарственных препаратов Исследования и разработка новых лекарств – долгосрочный (10-15 лет), дорогостоящий (сотни миллионов долларов) и рискованный процесс. В области лечения БА за последнее десятилетие более 50 лекарственных кандидатов успешно прошли фазу II клинических испытаний, однако ни один из них не прошёл фазу III. По-видимому, основными причинами являются отсутствие знаний о механизме(-ах) развития болезни, которые часто представляют собой близкую группу патологий с различной этиологией, а также сложность воспроизведения основных элементов патологии таких заболеваний на трансгенных моделях животных. Поэтому весьма привлекательным, с точки зрения упрощения прохождения клинических исследований, является исследование возможности использования уже известных препаратов по новому применению. Такое «репозиционирование» существующих лекарств представляется крайне привлекательным для инвестиций, поскольку оно сводит к минимуму риск неизвестных побочных эффектов, сокращает общее время клинических исследований, так как характеристики безопасности этих лекарств уже изучены ранее [205]. Интересно, что изучение случаев успешного применения известных препаратов для лечения нейродегенеративных заболеваний часто приводит к открытию новых фармакологических мишеней, как это произошло с препаратами Bexarotene и Dimebon [206]. Со времени выхода последнего препарата для лечения БА – Мемантина (одобрен к применению в 2003 году) было проведено более 500 клинических исследований. Свыше 50 соединений успешно прошли клинические исследования фазы II, однако ни один из препаратов не прошёл фазу III. Поэтому стоит вопрос о возможных причинах неудачи клинических исследований лекарственных препаратов для лечения БА, которые активно обсуждаются в многочисленных обзорах и научных статьях [2,207]. Одна из возможных причин неудач может быть связана с гетерогенностью патологии БА [208,209]. Эти соображения привели к парадоксальному выводу, что развёрнутые клинические исследования, содержащие разнородную популяцию пациентов, не всегда приводят к успеху. Действительно, в такой популяции может быть труднее найти признак эффективности препарата, который работает только (или главным образом) против определенной формы или стадии заболевания. Сравнения подгрупп могут в принципе указывать на реальные эффекты лечения, которые затем могут быть подтверждены дальнейшими исследованиями этих подгрупп. Эта логика была использована компанией «Eli Lilly», разрабатывающей антиамилоидный агент Solanezumab – антитела, предназначенные для связывания и стимулирующие удаление бета-амилоидного белка. В двух предыдущих исследованиях Solanezumab, названных EXPEDITION и EXPEDITION II, исследователи компании «Eli Lilly» использовали когнитивные тесты и функциональные измерения для отслеживания реакции пациентов с БА в лёгкой и умеренной стадиях болезни. Оба исследования не показали значительных преимуществ препарата по сравнению с плацебо. Однако комбинируя данные из второго исследования, в «Eli Lilly» заметили, что участники с лёгкой формой БА показали лучшие результаты в тестах когнитивных функций, чем пациенты из контрольной группы. Это послужило толчком для компании к дорогостоящим (примерно миллиард долларов) исследованиям на примерно 2100 пациентах с БА умеренной тяжести EXPEDITION III. Но даже при таком отборе пациентов заметного положительного эффекта установлено не было. Другая довольно неожиданная причина, тоже связанная с проблемой гетерогенной популяции пациентов в исследованиях, заключается в различной индивидуальной чувствительности к лекарствам пациентов, которые до проведения исследования могли принимать другие препараты. Например, в клинических исследованиях препарата LMTX (на основе метиленового синего), инициированных компанией «TauRx», было отмечено, что препарат лучше действовал на группу пациентов, которые не принимали других «анти-альцгеймеровских» препаратов. «Оказалось, что препарат работал только в том случае, когда пациенты не принимали других лекарств», – сказал в интервью исполнительный директор «TauRx» Клод Вишик [210]. Даже разное соотношение полов в группах пациентов может привести к отклонениям в результатах клинических исследований, поскольку недавно было обнаружено, что у женщин наблюдались лучшие способности к словесной памяти, чем у мужчин, которые маскировали ранние признаки БА [211]. Важная проблема, которая препятствует разработке эффективных препаратов для лечения БА, заключается в ограниченном числе и узком применении животных моделей, воспроизводящих основные признаки БА. Эксперт по БА в Mayo Clinic, доктор Д. Нопман считает, что имеющиеся модели «являются недостаточно надежными для предсказания действия препарата (в клинике), и не подходят для применения в случае поздних форм болезни Альцгеймера» [212]. Подробный анализ проблем, возникающих в ходе клинических испытаний препаратов для лечения БА дан в обзоре [213]. Несмотря на то, что за последние десятилетие ни один препарат не смог пройти III фазу клинических исследований, активный поиск новых перспективных структур продолжается и есть надежда, что в ближайшие годы будут созданы препараты, действующие на патогенез болезни Альцгеймера и способные существенно затормозить прогрессирование этого заболевания. БЛАГОДАРНОСТИ Работа выполнена по теме 48.8. «Поиск и исследование механизмов действия нейропротекторов и стимуляторов когнитивных функций» в рамках Государственного задания ИФАВ РАН (тема по ГЗ № 0090-2017-0019). ЛИТЕРАТУРА
|