|
Исследование чувствительности к протеолизу полноразмерной и укороченной форм рекомбинантной реналазы человека, экспрессированных в прокариотической системе Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121 Москва, Погодинская ул., 10; * e-mail: valfed38@yandex.ru Ключевые слова: реналаза, трипсин, протеолиз DOI: 10.18097/BMCRM00164 ВВЕДЕНИЕ RNLS — недавно открытый многофункциональный белок [1], играющий разные роли внутри и снаружи клеток. Внутри клеток полноразмерная RNLS действует как FAD-зависимая оксидоредуктаза, катализирующая окисление никотинамидных коферментов, образующихся при неспецифическом восстановлении β-NAD(P)+ [2]. Секреция RNLS во внеклеточное пространство сопровождается удалением N-концевого пептида, который необходим для размещения кофактора FAD, поэтому внеклеточная укороченная RNLS (truncated RNLS, tRNLS) не может осуществлять FAD-зависимые функции [3]. Считают, что внеклеточные RNLS проявляют различные защитные эффекты посредством неферментативных механизмов [4]. Механизмы действия внеклеточной RNLS остаются предметом активного изучения [4-7]. Следует отметить, что ряд синтетических пептидов, воспроизводящих некоторые аминокислотные фрагменты последовательности RNLS, проявляют биологическую активность в модельных клеточных системах, свойственную полноразмерной рекомбинантной RNLS [6]. Если принять во внимание наши данные об отсутствии протеотипического пептида RNLS (100-116 аминокислотные остатки (а.о.) последовательности) в плазме крови [8], это свидетельствует в пользу того, что внеклеточная RNLS подвергается дальнейшему протеолитическому процессингу, а биологические эффекты, приписываемые этому белку, обусловлены действием образовавшихся пептидов. Целью данной работы было изучение чувствительности полноразмерной RNLS и укороченной tRNLS к действию трипсина. МАТЕРИАЛЫ И МЕТОДЫ
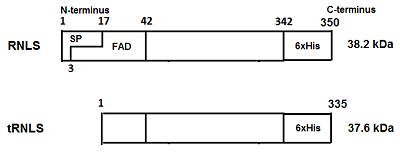
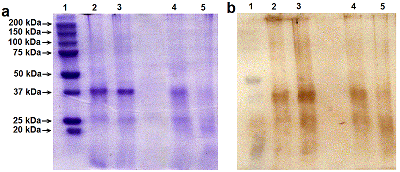
Реагенты В работе использовали реактивы производства «Sigma-Aldrich» (США), а также белковые маркеры молекулярной массы PageRuler™ PrestainedProteinLadder от 2 кДа до 250 кДа производства «Bio-Rad» (США). Полноразмерная рекомбинантная реналаза человека (RNLS) [9, 10] и рекомбинантная реналаза человека, лишенная N-концевого сигнального пептида (tRNLS) [11], были получены в прокариотической системе в виде белков, содержащих С-концевую гексагистидиновую метку (рис. 1), при помощи которой эти белки были очищены на Ni-агарозе [9, 11, 12]. Масс спектрометрический анализ рекомбинантной полноразмерной RNLS, экспрессированной в такой системе, выявил присутствие кофактора FAD в препарате этого белка (неопубликованные данные).
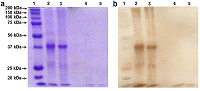
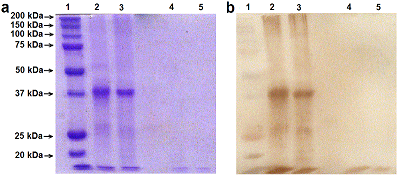
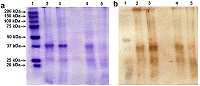
Индивидуальные поликлональные антитела овцы были получены против антигена полноразмерной человеческой рекомбинантной RNLS человека и очищены в «Покард» (Россия). Моноклональные антикроличьи/овечьи IgG-антитела, конъюгированные с пероксидазой хрена, были приобретены в «ИМТЭК» (Россия). Протеолиз рекомбинантной реналазы трипсином Протеолиз рекомбинантных реналаз (RNLS, tRNLS) человека трипсином проводили в объеме 20 мкл с добавление 0.2 мкг реналазы в трипсиновом буфере («Sigma-Aldrich»), содержащем 1 ед. или 0.01 ед. трипсина. После инкубации в течение 30 мин при 37°С реакцию останавливали нагреванием при 90°С в течение 5 мин, а реакционную смесь использовали для электрофореза в 12% полиакриламидном геле (ПААГ) в присутствии SDS (SDS-PAGE). Электрофорез Электрофорез проводили в 12% полиакриламидном геле (ПААГ) в присутствии SDS в системе Лэммли [13]. Вестерн-блоттинг Вестерн-блоттинг проводили по стандартному протоколу, описанному в [14], с небольшими модификациями, описанными в [9]. После блоттинга нитроцеллюлозные мембраны иммуноокрашивали хромогенным субстратом 3,3'-диаминобензидином с использованием первичных антител овцы против RNLS и моноклональных антител IgG против кролика/овцы, конъюгированных с пероксидазой хрена. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Для изучения возможной протеолитической деградации реналаз в крови человека мы исследовали действия трипсина на две формы реналаз (RNLS, tRNLS). Первая форма - рекомбинантная форма реналазы (RNLS) была получена нами ранее [9, 10]. Она включает в себя N-концевой сигнальный пептид (1-17 а.о.), отвечающий за секрецию реналазы из клеток и участвующий в формировании т.н. укладки Россмана (2-35 а.о.), необходимой для «размещения» кофактора FAD (3-42 а.о.), и С-концевой гистидиновый остаток 6хHis(8 а.о.), необходимый для выделения белка с помощью Ni-аффинной хроматографии [12] (рис. 1). Вторая полученная нами форма реналазы лишена N-концевого сигнального пептида (1-17 а.о.) (tRNLS) [11] (рис. 1). Инкубация препаратов очищенных рекомбинантных реналаз человека (RNLS и tRNLS) с трипсином (1 ед.) приводит полному исчезновению этих белков на электрофореграмме и иммуноблоте (рис. 2; ср. дорожки 2 и 4, 3 и 5). При снижении концентрации трипсина в среде инкубации на два порядка (0.01 ед.) полноразмерная RNLS демонстрировала большую устойчивость к действию этой протеазы, в то время как tRNLS практически полностью подвергалась расщеплению (рис. 3; ср. дорожки 2 и 4, 3 и 5).
Мы предполагаем, что различная чувствительность RNLS и tRNLS к действию низкой концентрации трипсина, по-видимому, определяется присутствием кофактора FAD в полноразмерном рекомбинантном белке, который способствует формированию пространственной структуры, более устойчивой к действию некоторых протеаз. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Данная работа не содержит каких-либо исследований с использованием людей и животных в качестве объектов исследования.
ФИНАНСИРОВАНИЕ Исследования выполнены в рамках проекта РФФИ №20–015–00104. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|