|
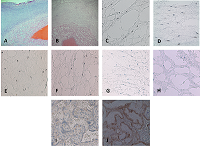
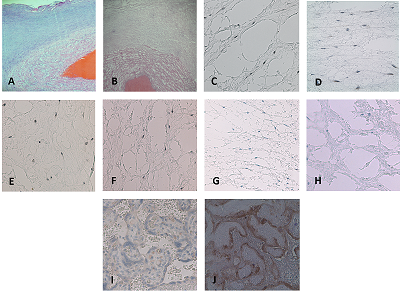
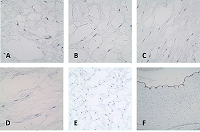
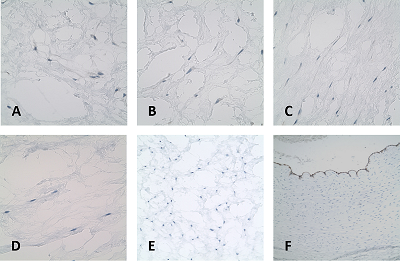
СОДЕРЖАНИЕ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 1Гистологические и иммуногистохимические особенности пуповины у женщин, заболевшихCOVID-19. Рисунок 2Экспрессия CD105, CD117, CD34 в образцах пуповиныу женщин, заболевших Сovid-19. Таблица 1Клиническая характеристика беременных женщин, включенных в исследование, и новорожденных |
Обнаружение n-белка SARS-Cov-2 в мезенхимальных клетках Вартонова студня пуповины у женщин с COVID-19
1Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова, 2Научно-исследовательский Институт морфологии человека им. академика А.П. Авцына, Москва Ключевые слова: SARS-Cov-2; Вартонов студень; плацента; пуповина; фибробластоподобные клетки DOI: 10.18097/BMCRM00165 ВВЕДЕНИЕ
Несмотря на большое количество исследований, посвященных новой коронавирусной инфекции SARS-Cov-2, вопрос о влиянии вируса на систему «мать-плацента-плод» остается открытым, а патогенетические особенности данного заболевания изучены не полностью. На сегодняшний день подробно исследованы и описаны в литературе особенности поражения сосудов различных органов при Covid-19 [1-6]. Изучение плаценты (ворсинчатого дерева плаценты, плодных оболочек, пупочного канатика) представляет особый интерес ввиду того, что данные эмбриональные структуры выступают в качестве барьера на пути проникновения вирусных и микробных агентов. Плаценту и плод соединяет пуповина, которая содержит две артерии и одну вену, окруженные студенистым веществом, представляющую эмбриональную соединительную ткань, которое получило название Вартонов студень (Wharton's jelly) по имени английского анатома Томаса Вартона, впервые описавшего строение пуповины в 1656 г. Данное желеобразное вещество обеспечивает механическую защиту сосудов от пережатия на протяжении формирования плода и во время акта родов. Однако на сегодняшний день существует мнение, что Вартонов студень играет роль в процессе не только механической, но и иммунологической защиты плода, также механизмах формирования адаптивного иммунитета [7-9]. Учитывая, что патогенез настоящего заболевания до конца не изучен, особенно при передаче вируса от матери к плоду, а также не исключена возможность вовлечения в данный процесс структур пупочного канатика [10-17]. Целью исследования было выявить N-белок вируса SARS-Cov-2 в структурах пупочного канатика у женщин, заболевших COVID-19. МАТЕРИАЛЫ И МЕТОДЫ В исследовании приняли участие 40 беременных с подтвержденным диагнозом COVID-19 (выявленным методом ПЦР в мазке из носоглотки). Пациентки, включенные в основную группу, проходили лечение в 2020 г. в ковидном госпитале, сформированном на базе Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (НМИЦ АГП им. В.И. Кулакова). Группу сравнения составили 40 беременных женщин с негативным результатом ПЦР- теста на COVID-19. После родоразрешения у всех родильниц проведено гистологическое исследование плаценты. С целью исключения перенесённого COVID-19 в стертой форме дополнительно была сформирована группа контроля 10 женщин с неосложненной беременностью, родоразрешенных в период с 2017 по 2018 гг. (архивный материал –парафиновые блоки). Критериями исключения были: тяжелая экстрагенитальная патология, пороки развития плода, многоплодная беременность. Был проведен анализ образцов пупочного канатика толщиной 0,3 см (по 2 образца от каждой женщины) плацент родильниц, включенных в исследование. Полученные фрагменты были фиксированы в 10%-м растворе нейтрального формалина (рН 7.4) («Biovitrum», Россия) в течение 24 ч с дальнейшим заключением в парафин. На серийных парафиновых срезах было проведено гистологическое (окраска гематоксилином и эозином) и иммуногистохимическое (ИГХ) исследование с помощью иммуностейнера Ventana («Roche», Великобритания). Протокол автоматизированного окрашивания образцов включал все этапы стандартной процедуры иммуногистохимии: депарафинацию срезов, демаскировку, блокирование эндогенной пероксидазы, инкубацию с первичными и вторичными антителами. Была использована система визуализации Ultra View Universal DAB, Detection Kit («Roche»). Исследование проводили при температуре 37оС. Для выявления вирусных частиц в ткани плаценты использовали первичные моноклональные антитела SARS-CoV-2 (N-белок (NP), (клон 1518, разведение 1:800, «Bialexa», Россия). Предварительно антитела к SARS-CoV-2 были проверены методом иммуноблотинга с использованием рекомбинантного таргетного белка. Кроме того, для идентификации мезенхимальных клеток были использованы первичные антитела к виментину (SP20, готов к использованию, «Spring Bioscience», США), CD105 (клон 3А9, разведение 1:500, «Abcam», Великобритания), CD117 (клон YR145, разведение 1:300, «Cell Marque», США, готов к использованию), CD34 (клон QBE nb/10, готов к использованию с дополнительным разведением 1:5, «Spring Bioscience»), SMA (smooth muscle actin-а, гладко-мышечный актин, клон 1A4, «Cell Marque»). Продукты положительной иммуногистохимической реакции визуализировались в виде коричневого окрашивания мембраны и цитоплазмы клеток. Для проведения отрицательного контроля образцы исследуемых срезов подвергали стандартной ИГХ процедуре без инкубации с первичными антителами. В качестве положительного контроля был взят образец ворсинчатого дерева плаценты, полученной от женщины с тяжелым течением Covid–19 и внутриутробной гибелью плода. Статистическая обработка полученных данных была проведена в пакете программ «Statistica 8.0». При сравнении средних величин использовали t-критерий Стьюдента и дисперсионный анализ, проводили проверку равенства дисперсий тестом Бартлетта. Различия оценивали как статистически значимые при p<0.05. РЕЗУЛЬТАТЫ При анализе клинических данных средний возраст пациенток составил (30.3 ± 6.2) года. Основные клинические симптомы, выявленные у пациенток, были: кашель (n=34, 85%), потеря обоняния (n=23, 57.5%) и гипертермия (n=22, 55%). В 6 (15%) случаях зарегистрировано бессимптомное течение COVID-19. В 19 случаях (47.5%) – легкое; в 12 (30%) – средне-тяжелое; в 3 (7.5%) – тяжелое течение заболевания. Случаев COVID-19 у новорожденных зарегистрировано не было. Новорожденные сразу после рождения были изолированы от матерей, до момента получения матерью двух отрицательных результата теста на SARSCoV-2. Клиническая характеристика беременных женщин, включенных в исследование, и новорожденных представлена в таблице 1.
На первом этапе исследования для всех образцов пуповин обеих групп было проведено гистологическое исследование с окрашиванием гематоксилином и эозином. Пуповины в группе родильниц с COVID-19 имели умеренно выраженный отёк Вартонова студня, в части пуповин отмечено присутствие единичных макрофагов. Вторым этапом было выполнено ИГХ исследование пуповин в обеих группах (рис. 1, 2). В результате исследования пуповин было обнаружено неравномерное окрашивание цитоплазмы фибробластоподобных клеток и единичных макрофагов Вартонова студня в группе пациенток, инфицированных COVID-19 (р<0.05). В микропрепаратах пуповин от женщин с легкой формой заболевания, а также в группе контроля с отрицательным тестом на COVID-19, включая дополнительную группу 2017-2018 гг., продукты ИГХ окрашивания к N-белку отсутствовали (рис.1 E, F).
При этом единичные положительно окрашенные клетки N-белком отмечены как при умеренном клиническом течении, так и при тяжелом течении заболевания (р<0.05) (рис. 1 А-I, рис. 2 А, B). Для характеристики мезенхимальных клеток Вартонова студня было выполнено ИГХ исследование с первичными антителами к vimentin, SMA, CD117, CD105, СD34. Кроме того, CD117 и CD105 относятся к маркерам мезенхимальных стволовых клеток (Рис.2 С-J).
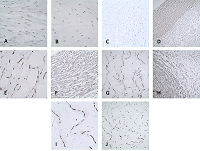
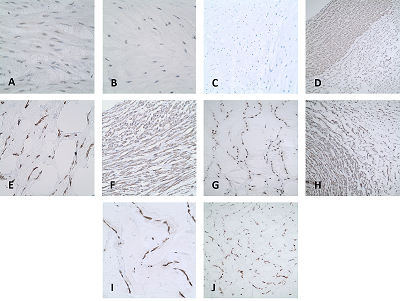
В результате исследования фибробластоподобные мезенхимальные клетки были интенсивно окрашены к vimentin+ и SMA+ и слабо позитивны для CD117, CD105. Гладкомышечные клетки пуповины были SMA+ и vimentin+ позитивны. Эндотелий сосудов пуповины экспрессировал СD34 и CD105 (рис. 3 А-F).
Важно отметить, что у пациенток с тяжелым течением COVID-19 отмечена тенденция ослабления ИГХ окрашивания CD117 в мезенхимальных клетках Вартонова студня (менее 3-5 полей из 10, при х400) (р=0.06). Экспрессия CD105 слабо положительна в мезенхимальных клетках Вартонова студня пуповины в обеих группах исследования, значимых отличий в экспрессии не было (р>0.05). Ранее нами было показано, что у пациенток с легкими формами COVID-19 отсутствовало окрашивание в большинстве ворсин плаценты. У женщин с умеренным и тяжелым течением заболевания и выявлено очаговое окрашивание мембраны и цитоплазмы отдельных ворсин синцитиотрофобласта, синцитиальных узелков, мелких участков базальной мембраны, эндотелия отдельных сосудов ворсин, макрофагов (рис. 1. I, J) [18-21]. ОБСУЖДЕНИЕ Несмотря на большое количество проведенных в мире исследований, патогенез заболевания COVID-19 не до конца изучен. Макрофаги, наряду с естественными киллерами (NK-клетки), являются наиболее многочисленной популяцией иммунокомпетентных клеток в маточно-плацентарном комплексе. Цитокины, вырабатываемые местными макрофагами, выступают посредниками в развитии воспалительных и иммунных реакций в системе «мать-плацента-плод» с нарушением морфологических и функциональных свойств и энергетического обмена клеток, приводя к истощению их защитного резерва. Однако при наступлении беременности макрофаги, находящиеся в базальной децидуальной оболочке, а также ворсинах плаценты (клетки Гофбауэра) [7], приобретают специфический фенотип, который участвует в поддержании местного гомеостаза, развитии плаценты, и обеспечении толерантности материнского организма к полуаллогенному плоду [14, 22, 23]. При наличии инфекции, в условиях сниженной общей иммунореактивности беременной клетки Гофбауэра и децидуальные макрофаги участвуют в клеточном иммунном ответе, реализуют иммунные реакции, располагаясь в непосредственной близости к «объекту реакции» [24]. Тканевые макрофаги могут проникать в Вартонов студень, в том числе и из кровотока, защищая плод от патогенного воздействия, способствуя формированию иммунного ответа. Однако, несмотря на защитную роль макрофагов, по аналогии с некоторыми другими возбудителями нельзя исключить, что в макрофагах (или в клетках другого типа) могут сохраняться не только вирусы, но и вирусные белки, обладающие способностью влиять на иммунный статус организма. При этом, микроорганизм может сохраняет свою жизнеспособность внутри клетки, защищаясь таким образом от иммунной системы хозяина. Данное явление получило название незавершённый фагоцитоз и его нельзя исключить и при инфицировании SARS-Cov2. Как правило, причины незавершенного фагоцитоза нередко связаны с самим патогеном или обусловлены дефектами иммунной системы [25-27]. Ввиду наличия рецептора ACE2, который присутствует на многих клетках, и прежде всего на клетках мезенхимального ряда [9, 28, 29], проникновение вируса SARS-Cov-2 в эти клетки вполне вероятно. Персистенция вирусных частиц и белков в клетках фибробластоподобного ряда и миофибробластах описана ранее при поражении лёгких при СOVID-19 [30-33] (учитывая, что способностью к фагоцитозу могут обладать не только клетки иммунного ряда, но мезенхимального происхождения) [30]. Описанные ранее изменения, обусловленные SARS-Cov-2, характеризовались поражением артерий среднего и мелкого калибра (микроскопический полиангиит, узелковый полиартериит [3, 5, 34], поэтому патоморфологические изменения со стороны пуповины, представляющей сосудистый комплекс, вполне вероятны. Таким образом, в настоящем исследовании впервые описаны патоморфологическое изменения Вартонова студня и структур пуповины. Нельзя исключить, что представленные данные вероятного персистирования вирусных частиц СOVID-19 в мезенхимальных клетках пуповины могут иметь значение при формировании иммунной защиты плода от вирусных агентов, хотя данный вопрос еще требует дальнейшего изучения. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследование одобрено этическим комитетом НМИЦ АГП им. В. И. Кулакова (протокол №13 от 10 декабря 2020 г.) Все пациентки подписали добровольное информированное согласие на участие в исследовании. Исследование соответствовало требованиям Хельсинской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики, Международной конференции по гармонизации (ICF), Стандартов надлежащей клинической практики (GCP), ФЗ «Об основах охраны здоровья граждан в Российской̆ Федерации» № 323-ФЗ от 21 ноября 2011 г. БЛАГОДАРНОСТИ Выражаем благодарность с.н.с. лаборатории протеомики и метаболомики репродукции человека НМИЦ АГП им. В.И. Кулакова А. В. Бугровой. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке РФФИ грант №20-04-60093. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|