|
Высокопроизводительный скрининг с помощью оптического SPR-биосенсора низкомолекулярных соединений на взаимодействие с CYP51 Сandida Krusei 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: поверхностный плазмонный резонанс; скрининг; цитохром P450 51; низкомолекулярные соединения DOI: 10.18097/BMCRM00183 ВВЕДЕНИЕ
Дрожжевой гриб Candida krusei (C. krusei) является возбудителем нозокомиальных инфекций [1], в первую очередь обнаруживаемых у людей с ослабленным иммунитетом и у пациентов с гемобластозами. C. krusei обладает естественной устойчивостью к флуконазолу – стандартному противогрибковому средству [2]. Смертность при фунгемии, ассоциированной с C. krusei, гораздо выше, чем в случае C. albicans [3]. В настоящее время препаратами выбора для терапии микозов, вызываемых C. krusei, являются вориконазол, амфотерицин В и эхинокандины [2, 4]. Основной мишенью действия противогрибковых препаратов является фермент ланостерол 14-альфа деметилаза грибов (цитохром P450 51, CYP51, КФ 1.14.14.154), катализирующий одну из ключевых стадий биохимического пути синтеза эргостерола [5]. Эргостерол играет структурную роль в мембране клетки гриба, поэтому нарушение его синтеза ведёт к гибели клетки. Кроме того, фунгицидный эффект ингибиторов CYP51 может быть связан с нарушением многих функций интактной клетки гриба, в которых прямо или косвенно принимает участие CYP51 [5]. Однако в последнее время у выявляемых в клинике штаммов C. krusei наблюдается развитие резистентности к азолам [2, 4]. В связи с этим представляется актуальным поиск новых соединений неазольной природы, способных проявлять противогрибковую активность в отношении C. krusei. Одним из возможных способов поиска новых потенциальных лекарственных соединений является скрининг библиотек коммерчески доступных соединений различной химической структуры, а также коллекций соединений природного происхождения. Одним из инструментов для такого скрининга может быть оптический биосенсор, действие которого основано на эффекте поверхностного плазмонного резонанса (SPR-биосенсор) [6]. Часто подобный скрининг выполняется с использованием обширных библиотек, что повышает вероятность нахождения потенциальных соединений-кандидатов. Однако реализация такого подхода сопряжена с генерацией большого объёма данных, анализ и интерпретация которых представляют значительную сложность из-за необходимости ручной обработки огромного числа полученных сенсограмм. Программное обеспечение нового поколения Biacore Insight Evaluation Software v. 3.0.11.15423 к SPR-биосенсору Biacore 8K (“Cytiva”, США) позволяет выполнять автоматический анализ больших объёмов данных, полученных в ходе скрининга библиотек соединений. Для решения вышеизложенной проблемы мы разработали протокол скрининга библиотеки низкомолекулярных соединений природного происхождения по взаимодействию с CYP51 C. krusei с помощью SPR биосенсора Biacore 8K. Данный протокол будет полезен исследователям, ведущим поиски новых соединений, способных связываться с потенциальными белками-мишенями, что имеет большое значение для создания новых лекарственных средств. МАТЕРИАЛЫ И МЕТОДЫ В качестве белка-мишени был использован рекомбинантный цитохром Р450 51 дрожжевого гриба C. krusei (CYP51) (препарат с чистотой >95% по данным электрофореза в полиакриламидном геле в денатурирующих условиях), полученный по протоколу, описанному ранее [7]. Библиотека низкомолекулярных веществ, использованная в работе, представляла собой часть коллекции соединений, выделенных из морских организмов в ТИБОХ ДВО РАН. От фирмы-производителя оборудования (“Cytiva”, США) были получены: буферный раствор HBS-N (150 мМ NaCl, 10 мМ HEPES, pH 7.4), 1-этил-3-(3-диметиламинопропил)карбодиимид-HCl (EDC), N-гидроксисукцинимид (NHS), ацетатные буферные растворы (10 мМ ацетат натрия, pH 4.0, 4.5, 5.0, 5.5). Остальные реактивы аналитической чистоты были получены от отечественных поставщиков. Поверхностный плазмонный резонанс (SPR) SPR анализ был выполнен с применением оптического биосенсора Biacore 8K (“Cytiva”, США) аналогично процедуре, описание которой приведено в [8]. В работе были использованы стандартные оптические чипы типа СМ5 (“Cytiva”, США), поверхность которых покрыта карбоксиметилированным декстраном. Белок-лиганд (CYP51) был иммобилизован ковалентно, путём образования амидных связей между карбоксильными группами декстрана и свободными аминогруппами белка. В качестве рабочего буфера был использован HBS-N. Все измерения проводили при температуре 25°С. Полученные сенсограммы представляли собой запись сигнала биосенсора в реальном времени, выраженного в резонансных единицах RU (1 RU соответствует 1 пг белка на поверхности оптического чипа). Результирующий сигнал биосенсора представлял собой разницу между рабочим (с иммобилизованным белком-лигандом) и контрольным (без белка) каналами биосенсора. Обработку и визуализацию результатов скрининга взаимодействия низкомолекулярных соединений с CYP51 выполняли с использованием лицензионной компьютерной программы Biacore Insight Evaluation Software v. 3.0.11.15423 (“Cytiva”, США). Выбор оптимального значения рН иммобилизационного буфера (рН-скаутинг) Для выбора оптимального значения pH иммобилизационного буфера были приготовлены образцы растворов CYP51 с концентрацией 20 мкг/мл в 10 мМ ацетатном буфере с pH 4.0, 4.5, 5.0, 5.5. Полученные тестовые растворы CYP51 были последовательно инжектированы в течение 2 мин при скорости потока 5 мкл/мин в жидкостную систему биосенсора для оценки электростатического преконцентрирования белка у поверхности чипа СМ5. При этом активацию поверхности чипа смесью EDC/NHS не выполняли. После каждой инжекции поверхность чипа промывали 50 мМ NaOH в течение 30 с при скорости потока 35 мкл/мин. Ковалентная иммобилизация CYP51 на поверхности чипа СМ5 Для иммобилизации CYP51 на поверхности чипа СМ5 были выполнены следующие процедуры: (1) активация карбоксильных групп декстрана чипа СМ5 с помощью инжекции смеси равных объёмов 0.2 M EDC и 0.05 M NHS в течение 7 мин при скорости потока 5 мкл/мин, (2) инжекция раствора белка-лиганда (20 мкг/мл в иммобилизационном 10 мМ ацетатном буфере с pH 4.5) в течение 5 мин при скорости потока 5 мкл/мин, (3) инактивация не прореагировавших с белком активированных карбоксильных групп декстрана путём самопроизвольного гидролиза при промывке системы рабочим буфером в течение 1 ч. Отказ от использования 1 М раствора этаноламина гидрохлорида для инактивации остатка активированных групп декстрана (как описано в стандартном протоколе производителя) обусловлен исключением воздействия на иммобилизованный лабильный белок-лиганд (CYP51) щелочного раствора с pH 8.5. Подготовка образцов низкомолекулярных соединений для скрининга на SPR-биосенсоре Стоковые растворы низкомолекулярных соединений в диметилсульфоксиде (DMSO) готовили в концентрации 10 мМ. Рабочие растворы соединений получали путем разведения стоковых растворов рабочим буфером HBS-N до конечной концентрации 50 мкМ. При этом концентрация DMSO в анализируемых образцах составляла 0.5%. Для минимизации скачкообразного сдвига сигнала биосенсора, обусловленного разницей коэффициентов преломления образца и рабочего буфера, что может сильно влиять на значения и форму регистрируемой сенсограммы, в рабочий буфер добавляли DMSO до конечной концентрации 0.5%. Образцы последовательно инжектировали в течение 10 мин при скорости потока 10 мкл/мин. Для обеспечения регистрации кривых диссоциации в случаях образования комплексов тестовых соединений с белком-мишенью производили пропускание рабочего буфера в течение 5 мин. Запись сенсограмм выполняли с частотой регистрации сигнала биосенсора 10 Гц. После инжекции каждого образца проводили двукратную промывку рабочего и контрольного каналов биосенсора регенерирующим раствором (1 М NaCl, 0.25% масса/объём CHAPS) в течение 20 с при скорости потока 30 мкл/мин. Уровень сигнала биосенсора, при котором результат скрининга считали позитивным, рассчитывался с помощью программного обеспечения по определенным заранее параметрам оценки. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Подготовка поверхности оптического чипа Для эффективной ковалентной иммобилизации белка-лиганда на карбоксиметилированный декстран поверхности оптического чипа необходимо создать его высокую локальную концентрацию у поверхности чипа. Это достигается путём создания условий для электростатического притяжения между положительно заряженными молекулами целевого белка и отрицательно заряженным декстраном на поверхности оптического чипа. Карбоксиметилированный декстран стандартного CM5 чипа при pH >3.0 заряжен отрицательно. Для придания положительного заряда молекулам белка необходимо, чтобы pH среды был ниже точки pI белка. Кроме того, важна низкая ионная сила буферного раствора, в котором происходит преконцентрация, так как ионы солей препятствуют электростатическим взаимодействиям, экранируя заряды. В предварительных экспериментах (см. выше) было установлено, что для эффективной преконцентрации CYP51 достаточен pH среды 4.5 (предпочтение стоит отдавать значениям pH, приближённым к нейтральным). Приемлемым уровнем преконцентрации белка с молекулярной массой 50 кДа для детекции белок-белковых взаимодействий можно считать 1000-3000 RU, тогда как для детекции взаимодействий белок-низкомолекулярное соединение уровень иммобилизации составляет 5000-10000 RU. Способ оценки уровня иммобилизации и структура сенсограммы приведены в работе [8]. После того, как выбраны условия для наиболее оптимальной преконцентрации, активируют карбоксильные группы декстрана на поверхности оптического чипа биосенсора. Эта процедура выполняется путём инжекции в жидкостную систему биосенсора активирующей смеси 0.2 M EDC и 0.05 M NHS в пропорциях 1:1 по объёму, что ведёт к образованию активных эфирных сукцинимидных групп на декстране чипа. После окончания инжекции активирующей смеси наблюдается подъём базовой линии сенсограммы на 100-300 RU при работе с CM5 чипами. Подъём базовой линии более чем на 300 RU может говорить о гиперактивации поверхности чипа, что рассматривается как нежелательное явление вследствие конденсации декстрана и резкого снижения его заряда. Данное явление приводит к снижению преконцентрации белковых молекул на поверхности чипа и уменьшению количества иммобилизованных белковых молекул. Для устранения подобного эффекта гиперактивации рекомендуется разбавить активирующую смесь дистиллированной водой в два или более раз. Возможно также сокращение времени контакта активирующей смеси с поверхностью чипа с 7 мин до 3 мин. После активации поверхности чипа выполняют инжекцию целевого белка в иммобилизационном буфере со значением pH, ранее определённым в экспериментах по рН-скаутингу. Время контакта целевого белка с активированной поверхностью чипа обычно составляет от 1-2 мин до 10-15 мин. При этом следует стремиться к минимизации времени нахождения целевого белка в среде с низкими значениями pH и низкой ионной силой. В нашем случае уровень иммобилизации CYP51 составил 9600 RU при времени контакта 5 мин (рис. 1).
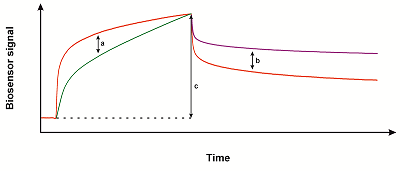
Стандартная процедура ковалентной иммобилизации за аминогруппы белка предполагает последующую инактивацию непрореагировавших активных групп декстрана путём короткой инжекции 1 М раствора этаноламина гидрохлорида с pH 8.5 [9]. Это гарантирует устранение непрореагировавших сукцинимидных групп декстрана. Однако существует вероятность повреждения лабильного целевого белка инжекцией сильно щелочного раствора. Для исключения этого фактора мы рекомендуем использовать растворы аминокислот (например глицина) или трис-буфера с нейтральным значением pH и концентрацией порядка 1 М. Ещё одним способом инактивации остаточных активных групп может быть самопроизвольный гидролиз непрореагировавших сукцинимидных групп при промывке измерительного канала рабочим буфером на протяжении 1 ч. В контрольных экспериментах было показано, что по истечении этого срока при повторных инжекциях белка-лиганда в иммобилизационном буфере дополнительная иммобилизация белка не наблюдается. Анализ результатов скрининга низкомолекулярных соединений по взаимодействию с CYP51 Нами выполнен скрининг 31 соединения природного происхождения (источник - морские иглокожие и растения) на взаимодействие с иммобилизованным CYP51 (все соединения представлены номерными шифрами). В ходе скрининга осуществлялась инжекция каждого соединения в концентрации 50 мкМ. В результате для каждого соединения была получена сенсограмма с фазой ассоциации 600 с и фазой диссоциации 300 с. При обработке полученных сенсограмм в программном комплексе Biacore Insight Evaluation Software v. 3.0.11.15423 проводится анализ максимальной амплитуды сенсограммы, наклона сенсограммы (slope), а также наличие медленной диссоциации (slow dissociation) (см. рис. 2). Для параметров, оценивающих наклон сенсограммы и скорость диссоциации, можно выставлять различную степень чувствительности от низкой к высокой. Чем ниже чувствительность, тем выше порог, при котором значение параметра оценивается как позитивный сигнал (наличие связывания). В зависимости от значений чувствительности параметров, оценивающих наклон сенсограммы и скорость диссоциации, определяется уровень отсечения для признания результата анализа конкретного взаимодействия положительным.
Мы выполнили анализ полученных нами данных для выборки из 31 соединения, варьируя настройки чувствительности следующим образом: максимальная чувствительность slope и slow dissociation (1 вариант), минимальная чувствительность slope и slow dissociation (2 вариант), минимальная чувствительность для slope и максимальная для slow dissociation (3 вариант), максимальная чувствительность для slope и минимальная для slow dissociation (4 вариант). Результаты представлены на рисунке 3.
Можно видеть, что в случае вариантов 1 и 4 настройки параметров анализа сенсограмм наблюдаются соединения, которые можно считать положительным результатом на основании двух критериев. В случае вариантов 2 и 3 таких соединений не наблюдается. Вариант 2 даёт минимальное количество соединений, взаимодействие которых с CYP51 C. krusei можно оценивать как положительный результат анализа. Тот факт, что соединения 1, 14, 17 и 27 соответствуют сразу двум критериям при 1 и 4 вариантах настройки и лишь одному критерию при 2 и 3 вариантах настройки говорит о том, что показатель slope для этих сенсограмм не является значимым. Данные сенсограммы можно охарактеризовать медленной диссоциацией, за счёт которой соединения 1, 14, 17 и 21 можно считать наиболее предпочтительными, в том числе при 2 и 3 вариантах настроек. Таким образом, если ориентироваться на максимальное сужение круга поиска, минимизируя число соединений, проходящих отбор на стадии скрининга, то эти 4 соединения можно выделить как наиболее приоритетные, так как наиболее перспективными прототипами лекарств принято считать соединения, взаимодействие которых с мишенью характеризуется медленной диссоциацией [10]. Также можно отметить, что 4 и 2 варианты настроек параметров анализа дают меньше всего положительных результатов - 8 соединений из 31. 1 и 3 варианты дают по 16 соединений. По результатам проведенных экспериментов, 4 вариант настроек выглядит наиболее предпочтительным для селекции наиболее перспективных соединений из большой выборки. В том случае, если ставится задача более гибкого подхода к оценке результатов скрининга, можно рекомендовать 1 вариант, так как он позволяет выбрать из большого числа хитов наиболее интересные, руководствуясь видом сенсограмм. Таким образом, результаты данной работы подтверждают, что многоканальные оптические SPR биосенсоры типа Biacore 8K являются достаточно эффективными инструментами для выполнения высокопроизводительного скрининга низкомолекулярных соединений по взаимодействию с целевыми белками-мишенями. Новые варианты программного обеспечения для автоматической обработки большого числа сенсограмм предоставляют возможности для гибкой селекции соединений-лидеров при проведении скрининговых исследований. На примере результатов данной работы можно сделать вывод, что для эффективного анализа данных скрининга предпочтительнее повысить до максимума оценку наклона сенсограммы в фазе ассоциации и минимизировать оценку скорости диссоциации. Это позволит отсеять значительную часть малоперспективных соединений. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Разработка протокола высокопроизводительного скрининга библиотеки низкомолекулярных соединений и оптимизация автоматизированного анализа полученных сенсограмм была выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№122030100168-2). Высокопроизводительный скрининг библиотеки низкомолекулярных соединений природного происхождения по их взаимодействию с CYP51 C. krusei, был выполнен в рамках гранта РФФИ №20-04-00014. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|