|
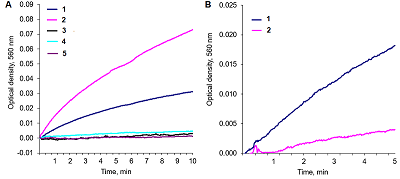
Генерация супероксида никотинамидными коферментами Институт теоретической и экспериментальной биофизики РАН, 142290, Пущино, ул. Институтская, 3; *e-mail: sirotatv@rambler.ru Ключевые слова: супероксид; никотинамидные коферменты; NADPH; NADP; NADH; NAD; нитросиний тетразолий; диформазан DOI: 10.18097/BMCRM00188 ВВЕДЕНИЕ Роль супероксида, выполняющего регуляторную и сигнальную функцию в биологических системах, активно обсуждается в литературе [1-4]. Образование О2─●, как известно, происходит при одноэлектронном восстановлении кислорода. Электроны в основном могут быть митохондриального происхождения и от NADPH-оксидазы [3]. Роль никотинамидных коферментов, как окисленных, так и восстановленных форм (NADP и NADPH, NAD и NADH) общеизвестна в энергетическом метаболизме. Окислительно-восстановительные процессы в живых системах происходят при непосредственном их участии. Возникло современное понятие и направление исследований – «редокс-состояние» клетки и организма в целом [5]. Относительно недавно открыты иные функции этих соединений, не связанные с окислительно-восстановительными реакциями: NAD и NADH участвуют в таких клеточных процессах, как регуляция гомеостаза кальция, гибель клеток и экспрессия генов [1, 6, 7]. Исходя из данных литературы и собственных исследований Weihai делает предположение, что «NAD и NADH вместе с ATP и Са2+ могут быть четырьмя фундаментальными компонентами жизни, которые могут существенно влиять почти на все основные биологические процессы», и обращает внимание, что «внеклеточный NAD может быть новой сигнальной молекулой» [6]. В настоящей работе установлено уникальное свойство исследованных соединений: NADPH, NADP, NADH и в меньшей степени NAD способны генерировать супероксиды в модельной системе. В аэробных условиях в присутствии этих веществ кислород, диффузно растворенный в щелочном буфере, восстанавливается до супероксида. Чтобы зарегистрировать и выявить супероксид, как известно, следует продлить время его существования, для чего необходимы щелочные условия [8-10]. В супероксидгенерирующих реакциях, таких как ксантин-ксантиоксидаза, автоокисление адреналина, глюкоза-глюкозооксидаза [10], ФМС/NADH [11] применяются буферы с щелочным рН. Используя такие условия, мы впервые показали образование супероксид анионов при функционировании фермента глюкозооксидаза [10]. Поиск естественных биологических супероксидгенерирующих систем в организме – актуальная проблема. На практике также необходимы химические и биологические модели in vitro для выявления фермента супероксидисмутазы (СОД), определения ее активности, а также для исследования анти/прооксидантных свойств различных материалов. Для этой цели могут быть использованы никотинамидные коферменты, способные генерировать О2─● в щелочной среде. В литературе это свойство никотинамидных коферментов не описано. Особо следует отметить, что генерация супероксида в условиях проводимого эксперимента происходит в отсутствии такого вещества как феназинметасульфат (ФМС), который использовали в модели ФМС/NADH [11]. В работах [11-14] авторы, используя систему ФМС/NADH и нитросиний тетразолий (НСТ), пытались объяснить химизм процесса, приписывая важную роль ФМС, считая его главным источником и/или переносчиком электрона в процессе образовании супероксида [11-14]. Их взгляды несколько различались, но основное место в применяемых схемах отводилось именно ФМС. В нашем исследовании ФМС не был использован, и генерация супероксида происходила при внесении в буфер только никотинамидного кофермента. Буфер содержал НСТ, необходимый для обнаружения супероксид анионов. Вопрос – откуда «берутся» электроны, поступающие на кислород – остается открытым. Основной результат настоящей работы – обнаружена способность никотинамидных коферментов создавать супероксид анионы. МЕТОДИКА Кинетические исследования Кинетические исследования проводили на спектрофотометре UVIKON 923 Double Beam UV/VIS Spectrophotometer («Kontron instruments», Италия) в 1-см кювете в режиме«time Driver» в течение 5-10 мин при длине волны 560 нм в 0.2 М карбонатном буфере, рН которого задавали в диапазоне 10.55-11.3, при комнатной температуре. В буфер вносили никотинамидные коферменты NADPH, NADP, NADH, NAD или другие вещества в качестве контрольных образцов. НСТ присутствовал во всех пробах (0.075 мМ). В работе также использовали спектрофотометр Specord UV/VIS («Carl Zeiss Jena», Германия). В некоторых экспериментах после записи кинетики реакции содержимое спектрофотометрической кюветы переносили в пробирки с плотно закрывающейся пробкой для изоляция от кислорода воздуха и оставляли на продолжительное время. Наблюдали появление или отсутствие окрашенных продуктов. Супероксидгенерирующая активность исследуемых соединений представляли в виде скорости реакции, которую рассчитывали как изменение оптической плотности при длине волны 560 нм в единицу времени (за 1 мин) на линейном участке кривой. В случае, если кинетика имеет гиперболический характер, брали для расчета начальный участок кривой. Выявленные различия активности исследуемых соединений сохранялись и в том случае, когда за интервал времени принимали 5 мин. Реактивы В работе использовали следующие реактивы: Na2CO3, нитросиний тетразолий, ADP, ATP, аденозин, NAD («Sigma», США; Диа-М, Россия), NADPH, NADP, NADH («Reanal», Венгрия; «Sigma-Aldrich» Fluka, Германии); СОД (супероксиддисмутаза, КФ 1.15.1.1) («Sigma», США); NaHCO3 («J. T. Baker», Голландия). Восстановленные формы пиридиннуклеотидов, NADH и NADPH, спектрально проверяли на наличие пика при длине волны 340 нм. Статистическая обработка Статистическую обработку результатов проводили с использованием t-критерия Стьюдента (Microsoft Excel): определяли среднее значение (M), стандартное отклонение (s.d.). Представленные ниже графики являются конкретными экспериментальными кривыми, выбранными из независимых многократно проведенных при 4-6 параллельных измерениях в каждом опыте. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В отсутствии ФМС в щелочной карбонатный буфер, содержащий НСТ, добавили NADH, создав таким образом условия постановки контрольной пробы для супероксидгенерирующей системы ФМС/NADH, и вели спектрофотометрическую регистрацию при длине волны 560 нм. Такой эксперимент не был проведен в работе, где представлена система ФМС/NADH [11]. Было обнаружено нарастание оптической плотности и появление сине-фиолетового окрашивания (рис. 1А, кривая 2). На рисунке 1А также показана более интенсивная кинетика генерации супероксида при использовании NADPH (кривая 1). В отсутствии НСТ при добавлении NADH или NADPH кинетика не была обнаружена, поскольку в пробе отсутствует индикатор, необходимый для идентификации супероксида (кривая 3 и 4). Нет кинетики (кривая 5) в контрольной пробе буфер + НСТ. Проведенные эксперименты показали, что скорость реакции зависела от величины рН буфера, температуры и концентрации кофермента. Были подобраны оптимальные условия для обнаруженного эффекта: прежде всего увеличили рН, а также исследовали диапазон концентраций кофермента (от 0.36 мМ до 1.5 мМ). Далее в оптимизированных условиях были проведены все последующие исследования, представленные на рисунке 1 и в таблице 1. На рисунке 1Б показано ингибирующее действие СОД в процессе накопления диформазана, что указывает на природу образующегося в этой системе радикала. NADH вызывал генерацию О2─●, ингибирующее действие СОД составляло около 80% (рис.1 Б).
В этих же условиях были исследованы и другие коферменты, супероксидгенерирующая активность которых, определяемая по скорости образования диформазана, представлена в таблице 1. В соответствии с полученными результатами был выстроен ряд активности исследованных соединений: NADPH > NADH ≥ NADP > NAD.
Результаты, полученные для NAD, отличались: в течение 10 мин регистрации появление диформазана не было обнаружено. Однако содержимое кюветы, перенесенное в пробирку и плотно закрытое пробкой, через 4 часа экспозиции стало окрашенным, т.е. образовался диформазан (Е560 нм = 0.256). Следовательно, генерация супероксида происходит и в присутствии NAD, только значительно медленнее. В ряд активности внесли и это соединение. Следует отметить, что супероксидгенерирующая активность NADH и NADP практически одинаковая. Были также исследованы и другие вещества – аденозин, ADP и АТP, содержащие, как и никотинамидные коферменты, в составе молекулы аденин (6-аминопурин). Эти соединения не вызывали генерацию супероксида в течение 10-минутной регистрации и более продолжительного времени инкубации. Длительная 19-часовая экспозиция этих проб (буфер + вещество + НСТ) в закрытой пробирке не выявила цветных продуктов реакции. Оптическая плотность при длине волны 560 нм исследуемых образцов была: ЕАденозин = 0.0001; ЕATP = 0.0001; ЕADP = 0.0001; ЕNADH = 0.6200. В экспериментах, результаты которых представлены на рисунках 2 и 3, была предпринята попытка установить, что происходит с коферментом в процессе образования супероксида, т.е. каким образом эти соединения выполняют функцию электронодонора, поставляя электрон на молекулярный кислород, растворенный в буфере, где и происходит одноэлектронное восстановление кислорода, согласно формуле (1):
На рисунке 2 показаны спектры восстановленных и окисленных NADPH и NADP (кривые 1 и 2 соответственно). Пик при 260 нм обусловлен наличием аденина, его присутствие характерно для всех никотинамидных коферментов (NAD, NADH, NADP и NADPH). Пик при 340 нм появляется только для восстановленных форм (NADH и NADPH), что обусловлено перестройкой пиридинового кольца: исчезает одна двойная связь и кольцо приобретает хиноидный характер (кривая 1). На рисуке 3 представлены спектры продуктов реакции после 10-минутной регистрации кинетики NADPH и NADP в щелочном буфере. Кривая 1 – это продукты NADP, кривая 2 и 3 – продукты NADPH до и после разведения дистиллированной водой 1 : 1 соответственно. Разведение позволило увидеть пик при длине волны 340 нм (кривая 3). Широкий спектр в области 560 нм (как описано в [15]) указывает на присутствие диформазана, а наличие пика при 340 нм – на сохранность молекулы восстановленного NADPH (рис. 3).
Таким образом, показано, что образование супероксид анионов в аэробных условиях в щелочном карбонатном буфере наблюдается при использовании всех исследованных никотинамидных коферментов, однако скорость генерации О2─● различна. Наиболее интенсивная – при использовании NADPH. Важная особенность обнаруженного феномена – не требуется присутствие ФМС, в отличие от [11-14], где из никотинамидных коферментов был использован только NADH и только совместно с ФМС. В настоящей работе показано, что никотинамидные коферменты в щелочных условиях «сами» создают супероксид анионы и источником электронов в этом процессе является, очевидно, собственно молекула кофермента, не зависимо от ее формы (окисленная или восстановленная). Вероятно, генерация О2─● связана со структурными перестройками молекулы вещества в щелочной среде в результате которых освобождаются электроны, поступающие в буфер и на кислород (формула 1). Можно предположить, что пиридиннуклеотиды работают как кофакторы ферментов, превращая конкретный субстрат в продукт в окислительно-восстановительных реакциях. С коферментом происходят именно структурные изменения на уровне молекулы, а не химическое их превращение. Химические превращения вещества в продукт реакции происходят, к примеру, в таких супероксидгенерирующих системах, как ксантин-ксантиноксидаза и автоокисление адреналина [16], где происходит сопряженное образование супероксид анионов. В системе in vitro кофермент + буфер + НСТ нет субстрата как такового, и электроны на кислород поставляют именно коферменты, т.е. они и являются электронодонорами. Следует отметить, что стабильность окисленной и восстановленной форм никотинамидных коферментов зависит от рН среды. Восстановленная форма устойчива в щелочных растворах [17]. Это особенно важно в описанных экспериментах, поскольку исследования были проведены при щелочном рН, необходимом для существования супероксида. Особенности обнаруженного феномена:
Полученные результаты демонстрируют обнаруженное нами уникальное свойство исследованных соединений. Можно предполагать их возможное участие как сигнальных молекул в регуляции различных биологических процессов, действие которых опосредуется через образование О2─● при изменении рН среды. Как может реализоваться в биологической системе обнаруженное свойство никотинамидных коферментов – быть электронодонорами для молекулярного кислорода, что и приводит к возникновению О2─● – требует дальнейшего исследования. Термин «электронодоноры» взят из обзорной статьи [18], посвященной супероксиду, в которой описаны различные способы генерации О2─● (химические, технологические на электродных поверхностях с применением в практике, биологические и др.), но нет информации о способности молекул никотинамидных коферментов создавать супероксиды. Выявленное нами свойство этих соединений в литературе из базы данных PubMed не описано. ЗАКЛЮЧЕНИЕ Обнаружено новое свойство никотинамидных коферментов (NADPH, NADH, NADP и NAD) – их супероксидгенерирующая активность, проявляющаяся в щелочной среде. Интенсивность генерации зависит от концентрации вещества, температуры, и, что особенно важно, от величины рН. Изменения рН – регуляторный механизм многих биохимических процессов: активация или торможение активности ферментов, поддержание протонных мембранных градиентов с участием АТP-аз и ионных обменников [19]. В настоящей работе показано, что никотинамидные коферменты при попадании в щелочную среду могут быть источником супероксидных радикалов: (NADPH, NADH, NADP, NAD) → pH ↑ → О2 ─●. Ряд активности исследованных никотинамидных коферментов, выстроенный по скорости генерации супероксида, имеет вид: NADPH > NADH ≥ NADP > NAD. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая работа не содержит описания исследований с использованием людей и животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Государственного задания ИТЭБ РАН № 075-01027-22-00. КОНФЛИКТ ИНТЕРЕСОВ Автор заявляет об отсутствии конфликта интересов. ЛИТЕРАТУРА
|