|
Исследование коллагена I типа методом иммуноблоттинга в образцах костнопластических биоматериалов
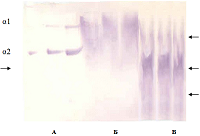
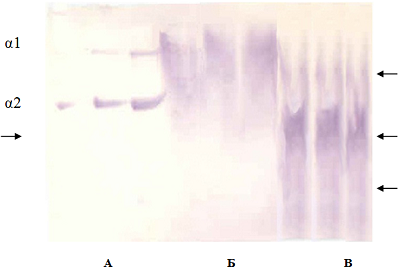
Самарский государственный медицинский университет, Ключевые слова:компактная и губчатая костная ткань; коллаген I типа; иммуноблоттинг DOI: 10.18097/BMCRM00189 ВВЕДЕНИЕ Костнопластические материалы успешно используются в медицинской практике для заполнения дефектов в костной ткани с целью активации репарационных процессов и ускорения восстановления структуры и функции кости. Деминерализованные костные имплантаты способствуют образованию кости путем остеоиндукции. Последняя представляет собой процесс, посредством которого трансплантированная ткань побуждает мезенхимальные клетки реципиента дифференцироваться в клетки остеобластов [1, 2]. Если морфологическая картина регенерации кости описана и вполне понятна, то внутренние механизмы постимплантационного остеогенеза остаются до настоящего времени недостаточно изученными. В связи с этим наряду с иммуногистохимическими важное значение приобретают биохимические и молекулярно-генетические методы исследования как костной ткани, так и интегрированных в нее костнопластических материалов. Так, в ранних работах специалистами Гарвардской школы дентальной медицины на крысах-самцах линии Sprague-Dawley была разработана экспериментальная модель, позволявшая исследовать молекулярно-биологические события на границе контакта ткань-имплантат. Титановые миниимплантаты (2 мм в длину и 1 мм в диаметре) были помещены в просверленные отверстия в альвеолярной кости или вблизи корней первого верхнечелюстного коренного зуба. Фазы регенерации исследовали гистологически через 28 дней и 56 дней после оперативного вмешательства. В первой группе животных начальная остеоинтеграция была отмечена через 28 дней, зрелая – через 56 дней. Во второй группе животных вокруг имплантатов, размещенных вблизи корней зуба, развивался фиброз. Изучали экспрессию коллагена XII типа, молекулярного маркера, специфичного для зрелой связки периодонта, in situ с помощью метода молекулярной гибридизации. Анализ синтезируемой мРНК позволил выявить отсутствие экспрессии коллагена XII типа на поверхности имплантата, в то время как зона экспрессии белка была обнаружена в поверхностных слоях костной ткани. Приведенные результаты свидетельствовали о значительных молекулярных изменениях в области контакта ткань - имплантат [3]. Коллаген является одним из важнейших белков соединительной ткани, обеспечивающих ее характерные биохимические свойства и осуществление связанных с этими свойствами специфических функций. Формирование костной ткани, ее структура, целостность, проявление функциональных свойств в значительной степени зависят от ее главного белкового компонента – коллагена I типа. Актуальными остаются исследования синтеза белка, его посттрансляционной модификации, укладки и сшивок, связи с дифференцировкой остеобластов [4]. Коллаген служит в качестве резервуара, депо морфогенетических белков костной ткани (BMP) – мультифункциональных цитокинов семейства трансформирующих факторов роста [5]. В связи с использованием в практическом здравоохранении костнопластических материалов, производимых в Научно-исследовательском институте биотехнологий Самарского государственного медицинского университета, представлялось важным дать оценку состояния сохраняющегося в них белка с помощью современных методов исследования. Существенную долю производимых материалов составляет деминерализованный костный матрикс, который получают из губчатой и компактной костной ткани человека. Один из рабочих этапов предусматривает обработку материала в растворах соляной кислоты слабой концентрации. Стерилизацию проводят с помощью γ - лучей [6]. Целью настоящей работы было исследование методом иммуноблоттинга коллагена I типа в биологических образцах костнопластических материалов, производимых в Научно-исследовательском институте биотехнологий (НИИ Биотех), и обсуждение возможного участия белка в механизмах регенерации костной ткани при остеопластике. МАТЕРИАЛЫ И МЕТОДЫ В работе использовали образцы лиофилизированных деминерализованных костнопластических материалов (регистрационное удостоверение № ФСР 2010/08120 от 24 июня 2010 года Срок действия не ограничен. Приложение к Регистрационному удостоверению на медицинское изделие от 14 марта 2012 года № ФСР 2012/12546, «НИИ Биотех», Россия) – порошок компактной кости и губчатую костную ткань, которую предварительно тщательно измельчали. Электрофорез белков проводили в 5%-ном (масса/объём) полиакриламидном геле (ПААГ) с додецилсульфатом натрия (ДДС) по методу Hayashi, Nagai [7]. Использовали стандартную камеру производства «Хеликон» (Россия) с размерами стекол 20×20 см. Электродный буфер содержал 324 г мочевины, 43.2 г глицина, 9 г триса и 1.5 г ДДС в 1500 мл раствора. ПААГ включал 3.6 М мочевину. Для солюбилизации белков исследуемого образца применяли 0.5 М трис-НСl буфер (рН 6.8), который включал 50% (объём/объём) глицерин, 4 М мочевину, 1% (масса/объем) ДДС, 0.5% (объём/ объём) ß-меркаптоэтанол. В качестве стандарта сравнения использовали коллаген I+III типа из кожи теленка (0.5 мг/мл) («Имтек», Россия), приобретенный для исследовательской работы с образцами костной ткани и кожи. Белки, ассоциированные с костнопластическими материалами, солюбилизировали в указанном буферном растворе в соотношении 50 мкг в 200-300 мкл. Перед нанесением на гель образцы выдерживали на кипящей водяной бане: коллаген I+III типа – 1 мин, опытные образцы – 5 мин. К каждому образцу добавляли каплю индикатора 0.05% (масса/объём) раствора бромфенолового синего. На дорожки наносили по 10 мкл, 15 мкл и 20 мкл раствора коллагена и по 25-50 мкл раствора исследуемых белков. Электрофорез проводили в два этапа. Первый в течение 1.5 ч при силе тока 1 мА на дорожку и напряжении 80 В. Второй – 3.5 ч при силе тока 3 мА и напряжении 120 В. По окончании электрофореза один гель окрашивали на белок в растворе 7% (объём/объём) уксусной кислоты, 10% (объём/объём) этилового спирта, 0.05% (масса/ объём) Кумасси G-250 в течение ночи и в последующем отмывали в водном растворе 7.5% (объём / объём) уксусной кислоты, 5% (объём/объём) этилового спирта. Второй гель использовали для иммуноблоттинга, который осуществляли по методу Towbin и соавт. [8]. Для этой цели вырезали средний участок геля, в котором происходит разделение молекул коллагена, размером 5×10 см. Гель выдерживали 5-10 мин в буфере для переноса белка на нитроцеллюлозную мембрану (25 мМ трис, 192 мМ глицин, 0.02% (масса/объём) ДДС, 20% (объём/объём) этиловый спирт, рН 8.3). За 30 мин до окончания электрофореза в этот же раствор помещали нитроцеллюлозную мембрану («Santa Cruz», США) с размером пор 0.45 мкм, фильтровальную бумагу и Super Thick Blot Paper («Sigma»). Блоттинг осуществляли посредством диффузии под грузом в течение ночи. На следующий день мембрану отделяли от фильтровальной бумаги и геля и инкубировали 1 ч при 4º С в блокирующем буфере: 5% (масса/объём) обезжиренное сухое молоко («Biorad», США) в 50 мМ трис-НСl буфере (рН 7.5), 200 мМ NaCl, 0.1% (объем/объем) Tween 20. В буферный раствор вносили первичные козьи поликлональные антитела к денатурированному коллагену («Millipore», США) в разведении 1: 500. Инкубацию продолжали при 4°С 18-19 ч. После промывки мембрану инкубировали 2 ч при комнатной температуре в буфере с молоком, содержащем вторичные антитела, конъюгированные с пероксидазой (мышиные против козы) («Sigma») в разведении 1:80000. Затем мембрану отмывали от буферного раствора с антителами согласно стандартной схеме. Белковые полосы выявляли с помощью субстрата для проявления активности пероксидазы тетраметилбензидина преципитирующего для блоттов. Эксперименты для выявления молекул коллагена на мембране проводили свыше трех раз. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Существенным преимуществом применяемой в работе системы электрофоретического анализа белков является возможность разделения коллагена I и III типа, а также коллагена I типа в виде двух цепочек: α1(I) и α2(I) [7]. Известно, что α2(I)-цепь коллагена из кожи теленка, содержащая 1029 аминокислотных остатков (а.о.), является более короткой за счет неспирализованных концевых участков молекулы, а α1(I)-цепь, состоящая из 1055 а.о., на N-конце содержит 16 а.о. и на С-конце 25 а.о. В нашей работе доступность коллагена для исследовательских целей обеспечивалась предварительным удалением значительной части минеральных соединений из костной ткани. Однако следует обратить внимание на то, что подобная обработка, а также стерилизация материала γ-лучами приводят к денатурации белка, нарушению его конформации и, возможно, высвобождению части а.о. Для коллагена I типа из кожи теленка, использованного в нашей работе в качестве стандарта сравнения, характерно четкое разделение α1(I) и α2(I) белковых полос в 5%-ном полиакриламидном геле (рис. 1). Основная масса белка, выделенного из порошка компактной кости, локализована между фракциями α1- и α2- коллагена I типа. Интенсивно окрашена верхняя часть выявляемой области, что свидетельствует о преобладании фракции α1 в коллагене I типа компактной кости. Можно сказать, что процесс получения имплантата в этом случае сопровождается незначительной редукцией молекулярной формы белка. Мы полагаем, что определенная часть коллагена компактной кости может сохранять свойства исходного белка, в то же время значительная его доля претерпевает изменения в экспериментальных условиях. Под денатурированным коллагеном в данном случае понимается размытость фракций, изменение их подвижности и одновременное появление полипептидов, мигрирующих в геле со скоростью, большей таковой у α1- и α2- цепочек коллагена I типа, и сохраняющих при этом способность реагировать с антителами. Наиболее вероятным нам представляется отщепление части молекулы белка в области N- и C-терминальных участков. в условиях обработки биологического материала Свидетельством этого является постепенно уменьшающаяся масса выявляемых молекул, а также появление фракций, мигрирующих в геле с большей скоростью, чем это характерно для α2-цепи коллагена I типа.
Иная картина наблюдается для коллагена, выделенного из губчатой костной ткани. Отмечается наличие серии полипептидов (показаны на рисунке 1 стрелками как для белка компактной кости, так и для полипептидов губчатой кости). Один из них занимает промежуточное положение между α1(I)- и α2(I)- цепями коллагена. Выявляются интенсивно окрашенная полоса с подвижностью, меньшей таковой α2(I), а также еще несколько полос с постепенно уменьшающейся молекулярной массой, мигрирующих в геле практически единым размытым фронтом до конца дорожки. Следует отметить, что редукция молекулярных форм коллагена в этом случае не сопровождается утратой антигенных свойств белка – реакция наблюдается как для денатурированного коллагена, так и для выявляемых полипептидов. Молекула коллагена I типа состоит из трех полипептидных цепей, переплетенных в виде палочковидной спирали, и включает С- (карбокси) и N- (амино) концевые участки. Полипептидную цепь коллагена можно представить как последовательность повторяющихся триплетов Gly–Х–У, где Х и У могут быть любыми а.о., но чаще в положении Х стоит остаток пролина или аланина, а в положении У – гидроксипролина или гидроксилизина. Коллаген содержит 33% глицина, около 11% аланина и примерно четверть пролина или гидроксипролина. Глицин обеспечивает прочность укладки трех полипептидных цепей, так как эта аминокислота не имеет боковой группы и находится внутри тройной спирали. Аминокислотный остаток пролина вызывает изгибы полипептидной цепи. В связи с высокой степенью упорядоченности организации молекулярной формы коллагена, фактической повторяемостью его субъединиц, логично предположить наличие однотипных маркеров антител на поверхности как исходной молекулы белка, так и на поверхности его редуцированных форм, что мы и наблюдаем при иммуноблоттинге. Таким образом, полипептиды коллагена сохраняют антигенные детерминанты, присущие исходному белку. Известно, что катепсин К, экспрессируемый остеокластами или остеоцитами, разрушает коллаген I типа и образует фрагменты, такие как N- и С-телопептиды, которые могут быть определены количественно с помощью ИФА [9]. Исследование природы выявляемых полипептидов и их количественная оценка в задачи настоящей работы не входили. Впервые техника получения денатурированного коллагена II типа из хрящевой ткани человека и быка была описана канадскими специалистами из хирургического отделения университета в Монреале [10]. В работе описаны способы анализа разрушения коллагена II типа с применением поликлональной антисыворотки, специфично реагирующей с нерасплетенными α-цепями и пептидами, происходящими из коллагенов типа II человека и быка под воздействием бромистого циана. Получаемые антитела специфично реагируют с фрагментированным и денатурированным коллагеном II типа и не реагируют с нативным спирализованным белком. Авторы [10] использовали два вида камер: 16×18 см (10% ПААГ) для разделения пептидов и 7×8 см (7,5% ПААГ) для исследования гетерогенности белка. В последующие годы поликлональные антитела, которые специфически реагировали с размотанными α-цепями и производными CNBr-пептидами человеческого коллагена II типа, применяли для выявления деградации волокон коллагена II типа в суставном хряще. Перегруженность дорожек белком позволяла выявить минорные компоненты, сохраняющиеся в имплантате после химической обработки и применения физических факторов, которые могли оставаться скрытыми в варианте оптимального нанесения белка. Выполненная работа является частью комплексной программы Научно-исследовательского института биотехнологий Самарского государственного медицинского университета по изучению микроструктуры, химического состава, физических характеристик получаемых из костной ткани пластических материалов (в основном аллоимплантатов) с целью изучения их остеоиндуктивных свойств и более эффективного применения в регенеративной медицине. В контексте этой программы получены результаты экспериментальных исследований образцов донорской костной ткани крысы, кролика и человека с различной степенью минерализации, выполненных с помощью метода комбинационного рассеяния (КР). Получены спектры КР для полос комбинационного рассеяния 950-962 см-1 (РО4)3-, 1065-1070 см-1 (СО3)2 и 1665 см-1 (амид I). В деминерализованной костной ткани наблюдается резкий (до 98%) спад интенсивностей пиков 950-962 и 1065-1070 см-1, который сопровождается появлением полосы 1079-1090 см-1, соответствующей гидратированному состоянию СО32- [11]. Также получены спектры КР для образцов кортикальной и губчатой костных тканей человека в зависимости от степени деминерализации. Исследована зависимость соотношения интенсивностей пиков КР 950-962 (РО4)3- и 1665 см-1 (амид I) от времени деминерализации, которая характеризует ее степень [12]. Для реализации персонифицированного подхода в лечении пациентов с различными костными дефектами необходимо учитывать и воссоздавать их индивидуальные особенности. Проведены доклинические испытания персонифицированных костных имплантатов с применением культур клеток человека при использовании различных технологий обработки первичного материала [13]. Экспериментально показано, что метод конфокальной флуоресцентной микроскопии обеспечивает динамический контроль процесса интеграции различных типов клеток в костный имплантат с разрешением не хуже 400 нм. Предложена оптическая методика оценки качества костных имплантатов и технологии их изготовления. Данный метод позволит проводить дооперационное тестирование и контроль различных имплантатов с прогнозированием их качества [14]. Внедренная в производство биоимплантатов технология обеспечивает сохранение полного комплекса биологически активных компонентов используемых тканей. Микроструктурные и биохимические свойства трансплантата анализировали с помощью сканирующей электронной микроскопии, микрокомпьютерной томографии, рамановской спектроскопии и протеомного анализа. Свойство клеточной адгезии трансплантата оценивали с использованием клеточных культур и флуоресцентной микроскопии. Микроструктурный анализ выявил иерархическую пористую структуру трансплантата с полным удалением клеточного дебриса и компонентов костного мозга. Протеомный анализ подтвердил сохранение коллагена и внеклеточных белков, стимулирующих и ингибирующих клеточную адгезию, пролиферацию и дифференцировку. Спектроскопия комбинационного рассеяния позволила установить, что коллаген является основным белковым компонентом костной ткани и образует фибриллярный каркас костного матрикса. Аминокислотная последовательность коллагена особенно богата пролином, около половины которого гидроксилируется во время распада коллагена с образованием гидроксипролина. Протеомный анализ деминерализованной губчатой ткани человека показал наличие коллагена и белков внеклеточного матрикса. Выявлены пять основных типов коллагена (I, IV, VI, XII, XIV), фибронектин, витронектин, остеопонтин, матричный Gla-белок, трансформирующий фактор роста TGF-β1, мимекан, костный сиалопротеин 2 и ряд других белков в органическом матриксе спонгиозы человека. Примечательна способность этих белков стимулировать и ингибировать клеточную адгезию, пролиферацию и дифференцировку [15]. ЗАКЛЮЧЕНИЕ Современные возможности лечения дегенеративной патологии костной и хрящевой ткани направлены на усиление регенерации посттравматических и послеоперационных дефектов с использованием различных биологических или синтетических препаратов. Аллогенные продукты включают в себя идентичные структурные и биологические компоненты и обеспечивают оптимальные условия для генетически запрограммированной физиологической регенерации в организме человека. Исследование химического состава костнопластических материалов проводится с целью изучения их остеоиндуктивных свойств, лежащих в основе процессов регенерации [15]. Применение в экспериментальных условиях клеточных технологий определяет направление современного поиска: взаимодействие компонентов биологических материалов с клетками костной ткани, изучение соединений, обладающих активирующими и ингибирующими свойствами, оптимизация процессов регенерации при использовании культур клеток. Результаты проведенных экспериментальных исследований вкупе с данными литературы позволяют сделать следующее заключение. На этапе получения образцов костнопластических материалов белок коллаген I типа, составляющий более 90% органического матрикса костной ткани, претерпевает ряд изменений, которые рассматриваются нами как благоприятные для инициации процессов восстановления кости в области дефекта. В образцах компактной кости значительная часть белка локализована между фракциями α1(I)- и α2(I)- коллагена. Обнаружены также молекулярные формы, мигрирующие в геле с большей скоростью, чем это характерно для цепи α2(I). В образцах, полученных из губчатой костной ткани, между цепями α1- и α2- коллагена I типа обнаружена единичная фракция. Выявлена также серия полос с постепенно уменьшающейся молекулярной массой вплоть до низкомолекулярных полипептидов. В целом это свидетельствует о более выраженной редукции молекулярных форм коллагена в биологических материалах, которые получают из губчатой костной ткани. В свете вышеизложенного можно предположить следующий механизм взаимодействия имплантатов, производимых в Научно-исследовательском институте биотехнологий Самарского государственного медицинского университета, с костной тканью. Область размещения костнопластических материалов рассматривается нами как ареал насыщения природным и денатурированным коллагеном, продуктами костной резорбции, низкомолекулярными полипептидами, которые могут проявлять себя в качестве неспецифических лигандов к рецепторам остеобластов кости. В отличие от рецепторов гормонов, обладающих высоким сродством к собственным лигандам и присутствующих в тканях в небольшом количестве, интегрины связывают свои лиганды с низким сродством и встречаются в большой концентрации. Это означает, что они могут слабо связываться с различными, но сходными молекулами матрикса [16]. Костные имплантаты, таким образом, могут служить источником биологически активных соединений, важных для ранней остеоинтеграции. В силу низкой специфичности интегринов остеобластов полипептиды коллагена, а также сохраняющиеся в имплантатах макромолекулы белка могут проявлять себя в качестве индукторов синтетических процессов в ядрах остеобластов, а также обеспечивать трансформацию остеопрогениторных клеток. Продукты фрагментации белка в имплантате в таком случае могут проявлять себя как сигнальные молекулы, запускающие каскады ферментативных реакций и внутриклеточные сигнальные пути. Представленные в статье результаты дополняют разрабатываемую общую модель взаимодействия соединений биологических материалов с клетками кости при остеопластике и могут служить объяснением эффективности применения костнопластических биологических материалов в процессах регенерации костной ткани. Возможно, что в будущем, изучая протекающие в костной ткани процессы, мы сможем выявить что-то подобное сопряженному сочетанию разных уровней наблюдаемых явлений. Такие представления могут привести к реализации новых научных идей. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. Использование биологического материала осуществлялось в соответствии с методическими рекомендациями и на основании предусмотренных документов. ФИНАНСИРОВАНИЕ Работа выполнена без привлечения внешнего финансирования. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют от отсутствии конфликта интересов. ЛИТЕРАТУРА
|