|
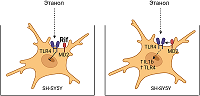
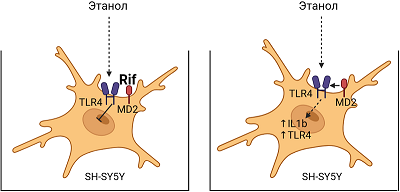
Рифампицин ингибирует экспрессию TLR4 и IL1β и повышает жизнеспособность клеток SH-SY5Y после длительного воздействия этанола в эксперименте in vitro
1Институт экспериментальной медицины, 197376, Санкт-Петербург, ул. Акад. Павлова, 12; 2Военно-медицинская академия им. С.М. Кирова, 194044, Санкт-Петербург, ул. Акад. Лебедева, 6 3Северо-Западный государственный медицинский университет имени И.И. Мечникова, 4Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики, 197022, Санкт-Петербург, ул. Ломоносова, 9 5Санкт-Петербургский политехнический университет Петра Великого, Ключевые слова: этанол; нейровоспаление; TLR4; SH-SY5Y; рифампицин DOI: 10.18097/BMCRM00208 ВВЕДЕНИЕ Хроническое поступление этанола в организм служит причиной развития нейровоспалительных и нейродегенеративных процессов в головном мозге [1-5]. Существуют предположения, что такие события усугубляют ход развития алкоголизма, ускоряя развитие более тяжелых форм алкогольной зависимости [2-4]. С целью коррекции таких состояний представляется актуальным проведение исследований по поиску новых потенциальных нейропротекторных средств, которые будут направлены на устранение причин развивающихся нейродегенерации и нейровоспаления [5]. Однако существует сложность в понимании того, каким образом поступающий в организм этанол опосредует развитие таких событий: способен ли этанол напрямую запускать развитие различных форм гибели нервных клеток или это эффект зависит от синтеза провоспалительных соединений, запускающих процесс гибели нейронов впоследствии посредством паракринных и эндокринных воздействий. Таким образом, представляется интересным изучение воздействия этанола на отдельные типы клеток нервной ткани в экспериментах in vitro. Длительная алкоголизация приводит к активации путей TLR4-сигнализации, что служит причиной повышенной экспрессии провоспалительных генов, а ингибирование TLR4-зависимых путей передачи сигналов снижает развитие нейровоспаления [1-5]. Имеются сведения, что антибиотик рифампицин (Rif) способен устранять признаки нейровоспаления [6-10] Предполагается, что эффект реализуется посредством взаимодействия Rif с MD2 (миелоидный фактор дифференцировки 2) – корецептором TLR4,– что может приводить к снижению активности TLR4-сигнализации [11-12]. Цель нашей работы заключалась в оценке жизнеспособности и состояния экспрессии генов Tlr4 и Il1b при добавлении Rif в эксперименте in vitro к культуре клеток нейробластомы человека SH-SY5Y до и после длительного воздействия этанола. МЕТОДИКА Клеточная культура SH-SY5Y Культивирование клеток SH-SY5Y проводили в среде DMEM, содержащей 10% фетальной бычьей сыворотки («Capricorn Scientific», США в увлажненной атмосфере, содержащей 5% CO2 37°С. Далее клетки помещали в 96-луночный планшет. Длительное воздействие алкоголя моделировали путем добавления этанола (100 мМ) в культивируемую среду на 24 ч (5 лунок). Жизнеспособность клеток Оценку жизнеспособности клеток после инкубации проводили с помощью AlamarBlue-анализа [13]. Для этого после инкубации клеток удаляли клеточную среду и добавляли АlamarBlue («Sigma-Aldrich», США) (10% w/w) к каждой лунке. Лунки инкубировалив течение 4 ч при 5% CO2 и 37°C и повторно проверяли на изменение цвета. Поглощение анализировали с помощью спектрофотометрического ридера микропланшетов Multiskan SkyHigh Microplate Spectrophotometer («Thermo Fisher Scientific Inc.», США) при длинах волн 570 нм и 600 нм. Результаты оценивали по формуле:
Культивирование культура SH-SY5Y с рифампицином Рифампицин (рифампицин, лиофилизат для приготовления концентрата для приготовления раствора для инфузий 150 мг, «Белмедпрепараты», Беларусь) растворяли в диметилсульфоксиде (ДМСО) («Merck KGaA», Германия) и вносили в среду в трех концентрациях – 25 мМ, 50 мМ, 100 мМ за 2 ч (по 5 лунок каждая) до добавления этанола и на 2 ч после добавления этанола (5 лунок каждая). В качестве контроля использовали с содержанием культивируемой среды (10 лунок) и лунки с добавлением ДМСО (5 лунок). Выделение РНК и ОТ-ПЦР Выделение тотальной РНК выполняли реагентом ExtractRNA («Евроген», Россия) в полном соответствии с инструкцией производителя. Концентрацию полученной РНК измеряли на спектрофотометре Implen NanoPhotometer P330 («Implen», Германия), чистоту выделенного продукта оценивали по отношению А260/А280 (в норме ≥ 1.8). Синтез кДНК проводили методом обратной транскрипции (ОТ) в 20 мкл с использованием набора реактивов MMLV RT kit («Евроген», Россия) в полном соответствии с инструкцией производителя. Полимеразную цепную реакцию (ПЦР) с детекцией в режиме реального времени (Mx3005P, «Stratagene», США) проводили в 10 мкл реакционной смеси, содержащей SYBR Green («Biolabmix», Россия), смесь специфических прямых и обратных праймеров («Beagle», Россия) (табл. 1), подобранных с использованием программного обеспечения Primer-BLAST. Полученные данные нормировали к уровню гена Gapdh и рассчитывали в относительных единицах по отношению к содержанию мРНК изучаемого гена методом 2ΔΔСt [14].
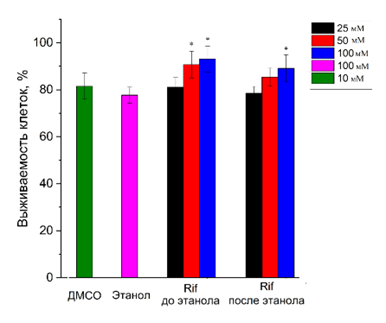
Статистическая обработка данных Для статистической обработки полученных результатов использовали программное обеспечение Graph Pad Prizm v. 6. Для сравнения групп применяли U-критерий Манна-Уитни для независимых малых выборок. Нормальность распределения полученных значений проверяли тестом Д'Агостино-Пирсона. Различия считали статистически значимыми при значении р≤0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Была выполнена оценка жизнеспособности клеток нейробластомы SH-SY5Y при моделировании длительного воздействия этанола на организм. Представленные данные были нормированы по уровню значений в группе контроля, не содержащей этанола и ДМСО (рис. 1). Выживаемость культуры клеток после инкубации в этаноле (100 мМ) в течение 24 ч составила более 70 %, в ДМСО в течение 2 ч более 80%. Добавление к культуре клеток раствора Rif на 2 ч повысила выживаемость клеток SH-SY5Y как в случае добавления до инкубации клеток в этаноле, так и в случае добавления Rif после инкубации, однако в последнем случае значимым эффект был лишь только при добавлении Rif в самой высокой дозировке (100 мМ).
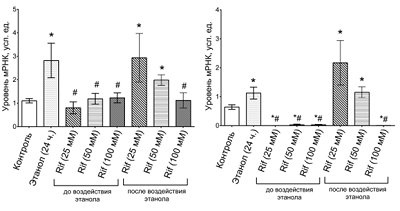
Длительная инкубация клеток в этаноле вызвала повышение относительного уровня мРНК TLR4 и IL1β. Предварительная инкубация клеток с Rif (25-100 мМ) до инкубации клеток в растворе этанола сохраняла уровень мРНК TLR4 на уровне контрольных значений во всех трех экспериментальных группах, при этом инкубация клеток с Rif после длительной инкубации клеток с этанолом дозозависимо снижала содержание мРНК TLR4. Rif 100 мМ оказал наиболее выраженный эффект. Предварительная инкубация клеток с Rif (25-100 мМ) блокировала экспрессию IL1β, При этом использование Rif после воздействия этанола дозозависимо снижало уровень мРНК IL1β, блокируя экспрессии цитокина при применении Rif 100 мМ.
Нейропротекторный эффект Rif был обнаружен в ходе эпидемиологических исследований пациентов с лепрой, которые принимали Rif в качестве терапии. Было замечено, что у таких пациентов низкий уровень заболеваемости нейродегенеративными патологиями [12]. Дальнейшие экспериментальные наблюдения на разных моделях нейровоспаления показали способность Rif снижать уровень провоспалительных цитокинов [6-10, 15], содержание β-амилоида при моделировании болезни Альцгеймера [16], α-синуклеина при моделировании болезни Паркинсона [17-18]. На модели демиелинизации мозолистого тела было показано снижение апоптотической активности, а предварительное введение Rif подавляло индуцированную литий-пилокарпином нейродегенерацию гиппокампа, снижая уровень цитохрома с в гиппокампе [8-9]. В исследовании на культуре микроглиальных клеток были получены сведения о конкуренции Rif и липополисахарида за связывание с белком MD2. Белок MD2 является корецептором TLR4 и необходим для связывания лиганда TLR4 с последующей активацией TLR4-сигнализации. Rif, связываясь с MD2, способствовал ингибированию TLR4-сигнальный путей в эксперименте [11-12].
Результаты нашего эксперимента показали активацию генов Il1β и Tlr4, данные подтверждают полученные ранее другими исследователями результаты с использованием модели длительного воздействия этанола на культуру клеток SH-SY5Y [19-21]. Однако еще остается открытым вопрос относительно механизма воздействия этанола на активацию генов нейровоспаления. Клетки нейробластомы SH-SY5Y часто используютв качестве in vitro моделей для изучения механизмов дифференцировки нейронов; они являются адренергическими по фенотипу, но также экспрессируют дофаминергические маркеры. Данная клеточная культура не является зрелой нейроглиальной клеткой, однако при воздействии этанола отмечается реакция к активации генов воспаления без поступающих сигналов от кокультивируемых каких-либо других клеток, как это было показано ранее в другом эксперименте, где добавление питательной среды от культивируемых клеток микроглии к клеткам SH-SY5Y вызвало их активацию [21]. Таким образом, мы наблюдаем механизм ответной защитной реакции одних лишь клеток SH-SY5Y на воздействие этанола. Результаты эксперимента позволяют предположить, что провоспалительный ответ на этанол опосредуется TLR4-зависимым путем, так как добавление Rif, который способен нарушать проведение TLR4-сигнализации, до инкубации клеток в этаноле значимо ингибировал экспрессию генов Il1β и Tlr4. При этом эффект был получен независимо от используемой дозировки Rif. Добавление же Rif после длительной инкубации клеток в растворе этанола снижало уровень экспрессии генов Il1β и Tlr4 дозозависимо и эффект был значим лишь только при применении Rif в самой высокой концентрации в нашем эксперименте (100 мМ). ЗАКЛЮЧЕНИЕ Выполненное исследование подтверждает способность Rif оказывать влияние на экспрессии генов нейровоспаления, при этом наиболее значимый эффект был получен при добавлении Rif (20-100 мМ) до инкубации клеток SH-SY5Y в растворе этанола, что указывает на способность Rif ингибировать пути активации провоспалительного ответа клетками SH-SY5Y на длительно присутствующий этанол в питательной среде. Представляется интересным в дальнейшем исследовать данный эффект на других клеточных линиях нервной ткани, а также в экспериментах in vivo. Дальнейшие исследования нейропротекторых механизмов, оказываемых Rif, могут способствовать его внедрению в качестве нейропротектора в клиническую наркологическую практику для коррекции нейровоспалительных событий в ЦНС, развивающихся при длительном употреблении алкоголя. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ В работе не проводились исследования с использованием людей или животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках государственного задания Минобрнауки России (2022-2025 гг.) «Поиск молекулярных мишеней для фармакологического воздействия при аддиктивных и нейроэндокринных нарушениях и создание новых фармакологически активных веществ, действующих на рецепторы ЦНС», шифр FGWG-2022-0004. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|