К 40-летию Института физиологически активных веществ РАН
|
Влияние эндогенных пептидов на токи NMDA- И AMPA-рецепторов нейронов коры, гиппокампа и мозжечка головного мозга крыс
Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
*e-mail: bovina_e@ipac.ac.ru
Ключевые слова: NMDA-рецепторы; AMPA-рецепторы; дельта-сон-вызывающий пептид (DSIP); кортикотропин-подобный промежуточный лобный пептид (CLIP); соматостатин, уридин, мурамиловые дипептиды (MDP) DOI: 10.18097/BMCRM00021 ВВЕДЕНИЕ В последнее время вновь возрос интерес к изучению влияния эндогенных гормонов и пептидов на нейрональные и, в первую очередь, на глутаматные рецепторы [1]. С одной стороны, эти исследования могут составить основу фундаментальных знаний о механизмах внутренней саморегуляции организма, с другой – имеют практическое значение: уточнение механизма патогенеза ряда нейродегенеративных заболеваний, а также когнитивных функций, учитывая важнейшую роль глутаматных рецепторов в этих процессах. Нами отобран ряд физиологически активных веществ, в механизме действия которых можно предположить их влияние на глутаматные рецепторы ЦНС. В связи с этим знания о механизмах регуляторного действия эндогенных пептидов, направленность их действия, количественные показатели могут иметь крайне важное значение при отборе новых соединений в качестве лекарственных средств и оценке терапевтического эффекта новых соединений. Целью работы было исследование действия ряда эндогенных гормонов и пептидов на глутаматные рецепторы NMDA- и AMPA-типов, играющих важнейшую роль в механизмах памяти. МАТЕРИАЛЫ И МЕТОДЫ Для измерения трансмембранных токов исследуемых нейронов Пуркинье мозжечка и нейронов коры головного мозга крыс, а также культивируемых нейронов гиппокампа крыс был использован электрофизиологический метод patch-clamp в конфигурации whole cell [2]. Нейроны Пуркинье выделяли из мозжечков 12–16-дневных крыс популяции Вистар. Для выделения использовали модифицированный метод Канеды [3]. Срезы мозжечка толщиной 400–600 мкм помещали в термостатируемую камеру объемом 10 мл. Раствор для выделения имел следующий состав (в мM): NaCl 150.0; KCl 5.0; CaCl2 2.0; MgSО4 x 7 H2O 2.0; HEPES 10.0; глюкоза 15.0 (pH 7.42). Срезы инкубировали в этом растворе в течение 60 мин, после чего раствор заменяли на аналогичный, содержащий проназу (2 мг/мл), коллагеназу (1 мг/мл), и инкубировали в течение 70 мин. После отмывки первоначальным раствором в течение 20 мин срезы помещали в чашку Петри и разъединяли механическим способом при помощи пастеровской пипетки. Растворы во время инкубации нейронов непрерывно продували 100% О2 при 34°C. Аналогичным образом получали и обрабатывали срезы коры головного мозга крыс с той разницей, что возраст крыс составлял 7–9 сут, а время инкубации с ферментами составляло 14–16 мин в зависимости от возраста животных. Исследуемые нейроны помещали в рабочую камеру объемом 0.6 мл. Рабочий раствор имел состав (в мM): NaCl 150.0; KCl 5.0; CaCl2 2.6; MgSО4 x 7 H2O 2.0; HEPES 10.0; глюкоза 15.0 (pH 7.36). Часть экспериментов выполнена на культуральных нейронах гиппокампа крыс. Нейроны получали из гиппокампов новорожденных крыс (1–2 сут) при помощи трипсинизации с последующим пипетированием. Суспендированные в культуральной среде клетки вносили по 3 мл в лунки 6-луночного планшета («Nunc», США) или в чашки Петри, куда предварительно помещали стекла, покрытые поли-L-лизином. Концентрация клеток, как правило, составляла 2.5 x 10–6–5 x 10–6 клеток/мл. Культуральная среда состояла из минимальной среды Игла и среды DME/F12 (1 : 1), дополненной 10% телячьей сыворотки, глютамином (2 мM), гентамицином (50 мкМ), глюкозой (15 мM) и KCl (20 мM), рН среды доводили NaHCO3 до 7–7.4. Планшеты с культурами помещали в CO2-инкубатор при 37°С и 100% влажности. На 2–3 сутки культивирования добавляли цитозинарабинозид в концентрации 10–20 мкМ. Через 6–7 дней культивирования в среду добавляли 1 мг/мл глюкозы или проводили смену среды. Трансмембранные токи вызывались активацией АМРА-рецепторов аппликацией растворов агониста этих рецепторов — каиновой кислоты (КК) и активацией NMDA-рецепторов — аппликацией растворов агониста этих рецепторов NMDA методом быстрой суперфузии растворов. Регистрация токов осуществлена при помощи боросиликатных микроэлектродов (сопротивление 2.5–5.5 мОм), заполненных следующим составом (в мM): KСl 140.0; EGTA 11.0; CaCl2 1.0; MgCl2 1.0; HEPES 10.0; ATP 5.0; pH 7.2. Для регистрации использовали прибор EPC-9 («HEKA», Германия). Запись токов осуществлялась при помощи лицензионной программы Pulse («HEKA») на жесткий диск компьютера Pentium-3. Обработка результатов осуществлялась при помощи программы Pulsefit («HEKA»). Статистическую обработку полученных результатов проводили с использованием статистического пакета программы Microsoft Excell. Результаты представлены в виде средних арифметических величин ± ошибка средней. Достоверность различий определяли по t-критерию Стьюдента; различия считали статистически значимыми при p ≤ 0.05. Построение графиков осуществляли также с помощью программы Microsoft Excell. В работе исследованы следующие вещества: дельта-сон-вызывающий пептид (DSIP — Тrр-Аlа-Gly-Gly-Asp-Ala-Ser-Gly-Glu), кортикотропин-подобный промежуточный лобный пептид (CLIP — L-arginyl-L-prolyl-L-valyl-L-lysyl-L-valyl-L-tyrosyl-L-prolyl-L-asparaginyl-L-glycyl-L-alanyl-L-α-glutamyl-L-α-aspartyl-L-α-glutamyl-L-seryl-L-alanyl-L-α-glutamyl-L-alanyl-L-phenylalanyl-L-prolyl-L-leucyl-L-α-glutamyl-L-phenylalanine), соматостатин, уридин, мурамиловые дипептиды (MDP - N-ацетил-глюкозаминил-N-ацетил-мурамил-L-аланил-D-глутаминовая кислота). Структуры соматостатина и уридина представлены на рисунке 1. Все препараты производятся компанией «Sigma».
РЕЗУЛЬТАТЫ Электрофизиологические эксперименты показали, что DSIP в диапазоне концентраций 1 x 10–13– 1 x 10–7 M оказывает концентрационно-зависимую блокаду NMDA-активируемых токов в нейронах коры (рис. 2). Начиная с концентрации DSIP 1 x 10–13 M величина ответов в нейронах коры составляла в среднем 40% от контрольных величин. В нейронах гиппокампа его действие несколько отличается: блокирующий эффект наблюдается с концентраций DSIP на порядок выше — 1 x 10–12 M и имеет волнообразный характер (рис. 2).
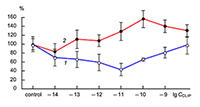
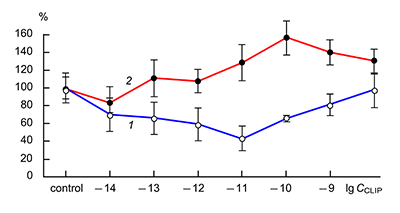
Хотя блокада начиналась с очень низких концентраций DSIP, дальнейшее увеличение концентрации DSIP не приводило к усилению блокирующего эффекта: максимум блокады наблюдался при концентрациях 1 x 10–12 M для нейронов коры и 1 x 10–11 M — для нейронов гиппокампа. Высокие концентрации в нейронах гиппокампа оказывали даже меньший блокирующий эффект, а в нейронах коры колебались незначительно около максимального значения, достигнутого при концентрации 1 x 10–12 M. В нейронах гиппокампа DSIP практически не влиял на амплитуду токов АМРА-рецепторов в диапазоне концентраций 1 x 10–13– 1 x 10–7 M [4]. CLIP почти во всем диапазоне исследованных концентраций вызывал статистически достоверную блокаду NMDA-активируемых токов в культивируемых нейронах гиппокампа крыс. Зависимость величины блокады от концентрации носила почти U-образный характер, достигая своего максимума в дозе 1 x 10–11 М, а затем несколько снижаясь (рис. 3).
Однако в этих же нейронах CLIP действовал на токи, активируемые каиновой кислотой (КК), совсем по-другому. CLIP только в концентрации 1 x 10–14 M вызывал незначительную блокаду каинат-индуцированных токов, однако во всех других исследованных концентрациях он вызывал потенциацию токов. Величина этой потенциации была максимальной при концентрации CLIP 1 x 10–10 M и составляла 156% по сравнению с контрольными значениями (рис. 3). Блокада постсинаптических токов полностью снимается только при концентрации CLIP 1 x 10–8 M [5]. Блокирующий эффект соматостатина на NMDA-активируемые токи в культивируемых нейронах гиппокампа носит U-образный характер: он достигает максимума при концентрации 10–12 M (ответы составляют 36%) и практически отсутствует при концентрации 10–8 M (ответы составляют 90% от контроля) (рис. 4). Соматостатин во всем диапазоне концентраций 1 x 10–14–1 x 10–7 M увеличивал ответы на каинат в нейронах мозжечка (рис. 4). Величина потенциации составляла 22–62%. Следует заметить, что вариабельность влияния соматостатина на амплитуду КК-активируемых токов в разных нейронах была значительной, что нашло свое отражение в величине стандартного отклонения от средних значений.
Таким образом, соматостатин блокировал NMDA- и потенцировал АМРА- рецепторы в широком диапазоне доз. Полученные данные свидетельствуют о том, что соматостатин способен эффективно модулировать глутаматергическую синаптическую передачу [6]. Как показали наши исследования, уридин во всем диапазоне исследованных концентраций (1 x 10–14–1 x 10–7 M) вызывал блокаду NMDA-активируемых токов: незначительную в концентрации 1 x 10–14 M (на 7%) и выраженную в концентрации 1 x 10–10 M (на 62%). Достоверные отличия от контроля были показаны для концентраций уридина 1 x 10–13 и 1 x 10–10 M (рис. 5). Уридин в концентрации 1 x 10–13 M вызывал незначительное увеличение КК-активируемых токов. При концентрациях уридина 1 x 10–12 и 1 x 10–11 M ответы составляли 88 и 69% от контрольных значений соответственно, а в концентрации 1 x 10–10 M уридин не оказывал какого-либо влияния на амплитуду КК-активируемых токов (рис. 5). Дальнейшее увеличение концентрации уридина вызывало незначительное увеличение его блокирующего действия. Полученные результаты говорят о блокирующем влиянии уридина на NMDA- и каинатные рецепторы в нейронах гиппокампа мозга крыс.
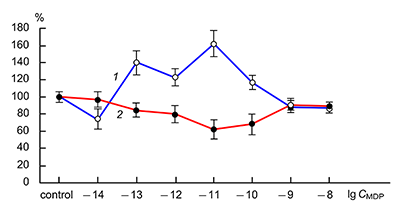
В диапазоне концентраций 1 x 10–13–1 x 10–8 M MDP вызывали уменьшение амплитуды NMDA-активируемых токов в нейронах гиппокампа крыс. В диапазоне концентраций 1 x 10–11–1 x 10–10 M ответы составляют в среднем 60–70% от контроля (р ≤ 0,05) (рис. 6). Кроме того, MDP вызывали уменьшение КК-вызванных токов в нейронах гиппокампа в концентрации 1 x 10–14 M на 25%. Однако начиная с концентрации 1 x 10–13 M и до 1 x 10–9 M MDP вызывали увеличение КК-активируемых токов, но в концентрации 1 x 10–8 M MDP вновь вызывали небольшую блокаду КК-вызванных токов (рис. 6) [7].
МАТЕРИАЛЫ И МЕТОДЫ Таким образом, установлено, что исследованные эндогенные пептиды играют важную роль в регуляции глутаматергической медиаторной системы мозга. Они действуют в очень низких концентрациях, начиная с концентрации 1 x 10–14 M, концентрационно зависимо и обратимо, что говорит об исключительной специфичности соответствующих рецепторов. Диапазон оказываемого ими влияния на ответы постсинаптических глутаматных рецепторов достаточно узок и, как правило, не превышает 60–70% изменения от уровня контрольных значений. Показано, что DSIP блокирует NMDA-рецепторы. Вероятно, его действие имеет нейропротекторное значение как важный компонент сна — необходимого охранительного и восстановительного состояния организма [8]. Определенный интерес, на наш взгляд, имеют выявленные различия в действии DSIP на NMDA-рецепторы в нейронах коры и гиппокампа. Если для нейронов коры характерно значительное торможение NMDA-рецепторов практически во всем исследованном диапазоне концентраций, то для нейронов гиппокампа это торможение наблюдается только в узком диапазоне концентраций, а в других концентрациях блокирующий эффект имеет минимальное значение. Возможно, это связано с особой ролью гиппокампа в процессах памяти. В то же время, мы не смогли обнаружить влияния DSIP на АМРА-рецепторы. Уридин вызывал значительную концентрационно-зависимую блокаду NMDA-рецепторов. Учитывая сомногенное действие уридина, можно предположить, что он играет важную роль как в процессах общего торможении ЦНС, так и нейропротекторную роль во время сна [9]. Нами предположен вероятный механизм участия CLIP в механизмах памяти. Как было показано ранее, концентрация CLIP в мозге увеличивается во время фазы парадоксального сна, во время которого происходит консолидация памяти [10,11]. Мы предполагаем, что усиление памяти происходит, в первую очередь, за счет потенциации ответов АМРА-рецепторов, которую вызывает CLIP в широком диапазоне концентраций. Кроме того, CLIP блокирует ответы NMDA-рецепторов. Соматостатин в наших экспериментах блокировал NMDA-рецепторы, но активировал АМРА-рецепторы практически во всем диапазоне концентраций. Это хорошо согласуется с его противосудорожным действием и участием в процессах памяти [12]. Авторы исследования [13] показали, что соматостатин, так же как и в наших экспериментах, блокировал токи NMDA. Полученные нами данные подтверждают нейропротекторную роль соматостатина. Мурамиловые дипептиды потенцировали АМРА- и блокировали NMDA-рецепторы, хотя их роль в когнитивных процессах пока не установлена. Наибольший интерес представляют данные о действии CLIP — фрагмента адрено-кортикотропного гормона (АКТГ) — на глутаматные рецепторы. CLIP оказывает стимулирующее влияние на память во время фазы парадоксального сна [14,15]. Нами впервые установлено, что CLIP блокирует NMDA-рецепторы и потенцирует АМРА-рецепторы в широком диапазоне концентраций (6 порядков), что является крайне важным для проявления такого память-стимулирующего эффекта. Данное положение полностью относится и к соматостатину, который также блокирует NMDA-рецепторы и потенцирует АМРА-рецепторы, а также играет важную роль в механизмах формирования памяти [12]. Очевидно большое сходство в действии обоих пептидов на АМРА- и NMDA-рецепторы. Полученные нами результаты показывают, как эндогенные соединения могут осуществлять регуляцию когнитивных процессов и памяти. Этот механизм заключается в регуляции АМРА- и NMDA-рецепторов. БЛАГОДАРНОСТИ Работа выполнена по теме 48.8. «Поиск и исследование механизмов действия нейропротекторов и стимуляторов когнитивных функций» в рамках Государственного задания ИФАВ РАН (тема по ГЗ № 0090-2017-0019). ЛИТЕРАТУРА
|