|
Влияние температуры дериватизации и бутилгидрокситолуола на содержание малонового диальдегида в гомогенатах печени
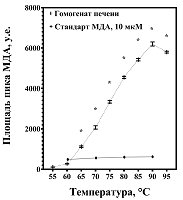
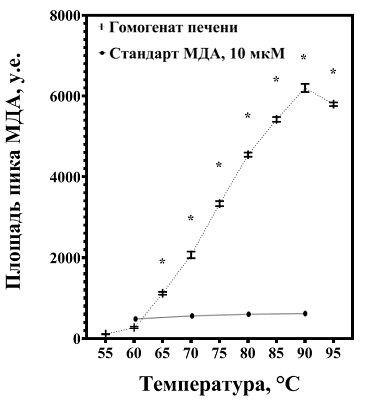
1Федеральный исследовательский центр питания, биотехнологии и безопасности пищи, Ключевые слова: перекисное окисление липидов; малоновый диальдегид; температура дериватизации; бутилгидрокситолуол; 2-тиобарбитуровая кислота; гомогенат печени DOI: 10.18097/BMCRM00215 ВВЕДЕНИЕ Окислительный стресс тесно связан с патогенезом целого рда заболеваний [1] и характеризуется интенсивным образованием активных форм кислорода, что приводит к интенсификации перекисного окисления ненасыщенных жирных кислот и их распаду до малонового диальдегида (МДА) [2]. МДА является распространенным маркером окислительного стресса [1-3]. При этом, согласно данным литературы, выявленное количество МДА в печени может существенно варьировать: от 3.78 нмоль/мг белка [4, 5] до 5000 нмоль/мг белка [6, 7]. Различия могут быть обусловлены образованием МДА в условиях in vitro при нагревании до 100°С на этапе дериватизации с 2-тиобарбитуровой кислотой (ТБК) [2, 8]. Методическим подходом для предупреждения образования МДА из-за высоких температур инкубации и окисления биоматериала может являться включение синтетического антиоксиданта бутилгидрокситолуола (БГТ) в состав реакционной смеси [9, 10]. Цель исследования – анализ методических причин завышения содержания МДА в печени и поиск подходов для устранения недостатков метода. МЕТОДИКА Содержание МДА изучали в приготовленном согласно [11] однократно размороженном пулированном гомогенате печени (масса навески / объём буфера (154М КСl в 0.05М Трис‑HCl (рН 7.4)) = 1/4; концентрация белка - 34 мг/мл) крыс самцов линии Wistar, получавших стандартный полусинтетический рацион [12]. В работе использовали 1,1,3,3‑тетраметоксипропан (≥99%,“Acros Organics”, Бельгия) в качестве стандарта МДА, а также ТБК (≥98%,“Sigma”, США), H3PO4 (85%,“Merck”, Германия), додецилсульфат натрия (≥97%,“Merck”), БГТ (≥99%,“CDH”, Индия), CH3OH (≥99.8%,“J.T.Baker”, Нидерланды), КН2PO4 (хч,“Реахим”, Россия), деионизованную воду. При изучении влияния температурного фактора в реакционную смесь объемом 1.0 мл, включающую 740 мкл 0.1% H3PO4, 200 мкл 0.6% ТБК, 60 мкл 8.1% додецилсульфата натрия, вносили 100 мкл 10 мкМ стандартного раствора МДА или разведенных в 10 раз гомогенатов печени. Реакционную смесь инкубировали 30 мин при каждой температуре в диапазоне от 55°С до 95°С с шагом в 5°С; охлаждали на ледяной подложке 10 мин. После центрифугирования при 10000 g и 4°С в течение 15 мин отбирали надосадок, который исследовали с использованием системы высокоэффективной жидкостной хроматографии (“Хроматрон 1411”, Россия). Хроматограф был оснащён колонкой Eclipse XDB-C18 (4.6x150 мм, 5 мкм; “Agilent”, США), флуориметрическим детектором RF-20A/20Axs (“Shimadzu”, Япония). Измерения проводили при длинах волн λех=527 нм, λem=551 нм. Подвижная фаза состояла из 0.05 мМ КН2PO4 (pH 6.8) и CH3OH в соотношении 6/4 соответственно; скорость потока – 1 мл/мин; объём вкола – 50 мкл; продолжительность анализа – 6 мин. При изучении эффектов БГТ его растворяли в CH3OH для получения растворов с концентрацией 2.5-125000 мкМ и добавляли полученные растворы в объёме 27.5 мкл к реакционной смеси для получения диапазона концентраций антиокислителя 0.0625 мкМ - 3125 мкМ, снижая содержание кислоты (0.1% H3PO4) до 712.5 мкл. Реакционную смесь инкубировали при 90°С. Для установления статистически значимых (р<0.05) различий использовали дисперсионный анализ и post hoc тест множественного сравнения Tukey после предварительной проверки на нормальность распределения (тест D’Agostino & Pearson) и равенство дисперсий (тест Brown-Forsythe) с помощью программы GraphPad Prism 8.0.1 (“GraphPad Software”, США). Данные представлены в виде среднего арифметического и его стандартной ошибки (М±m). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Для стандартного 10 мкМ раствора МДА возрастание температуры инкубации реакционной смеси с 60°С до 90°С не оказывало значимого влияния на интенсивность образования комплекса МДА-ТБК (рис. 1). В гомогенатах печени повышение температуры с 55°С до 90°С сопровождалось резким возрастанием уровня МДА (в 57 раз), наиболее выраженным при нагревании с 60°С до 65°С (в 4 раза). При этом содержание МДА статистически значимо увеличивалось при каждом подъёме температуры, за исключением результатов, полученных при 60°С (р > 0.05) и 95°С.
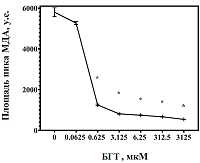
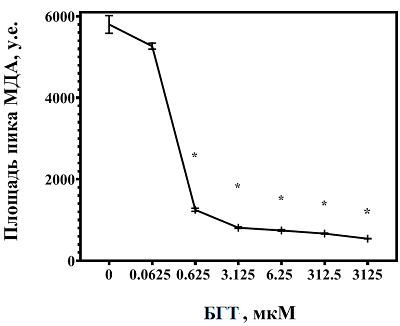
Добавление к реакционной смеси антиоксиданта БГТ дозозависимо препятствовало росту уровня МДА в гомогенате печени при нагревании до 90°С (рис. 2). В максимальной изученной концентрации (3125 мкМ в реакционной смеси) БГТ на 92% уменьшал содержание МДА по сравнению с образцом, не содержащим БГТ. При этом каждое пошаговое увеличение концентрации БГТ в реакционной смеси приводило, начиная с уровня в 0.0625 мкМ, к статистически значимому снижению уровня МДА в гомогенате печени, наиболее выраженному при возрастании содержания БГТ с 0.0625 мкМ до 0.625 мкМ (в 4,5 раза).
Таким образом, в результате проведенных исследований было установлено последовательное возрастание содержания МДА в гомогенатах печени при увеличении температуры реакционной смеси до 90°С, чему дозозависимо препятствовало внесение БГТ. Возможной причиной накопления МДА при повышении температуры инкубации может являться интенсификация перекисного окисления липидов in vitro вследствие катализа образования свободных радикалов металлами переменной валентности (в т.ч. железо и медь) (как входящими в состав геминовых соединений (в т.ч. гемоглобин и цитохромы), так и высвобождающимися вследствие разрушения их комплексов с белками) [13-15], что подтверждается установленным в настоящей работе эффектом антиоксиданта БГТ. Наряду с этим, при увеличении температуры инкубации образование нового МДА полностью не подавлялось внесением БГТ (при 90°С антиоксидант лишь в 11 раз уменьшал 57-кратный рост МДА-ТБК относительно 55°С), что свидетельствует о дополнительном вкладе иных процессов, например связанных с выходом МДА из его комплексов с биомолекулами [3, 16-18]. ЗАКЛЮЧЕНИЕ В результате проведенных исследований показано, что:
Таким образом, введение нового этапа с БГТ при определении МДА в печени препятствует искусственному завышению результатов, что следует учитывать при оптимизации схожих методик анализа и интерпретации релевантных данных, полученных в медико‑биологических исследованиях. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследование было выполнено с использованием биологического материала (печень), полученного от крыс в рамках эксперимента, проводимого согласно ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами» и одобренного Этическим комитетом Федерального исследовательского центра питания, биотехнологии и безопасности пищи. ФИНАНСИРОВАНИЕ Работа проведена за счет средств субсидии на выполнение государственного задания (НИР № FGMF-2023-0006). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|