|
Возрастные зависимости длин теломер клеток мышечной ткани хищных видов рыб с потенциально различным механизмом старения
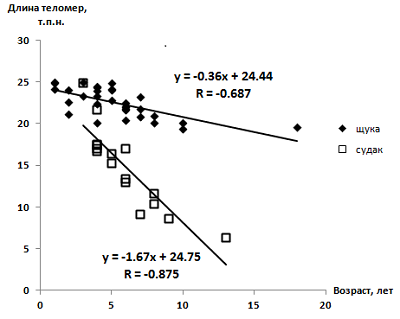
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: старение рыб; обыкновенная щука (Esox lucius); обыкновенный судак (Sander lucioperca); длина теломер; физиология мышечной ткани DOI: 10.18097/BMCRM00222 ВВЕДЕНИЕ Механизмы старения животных являются объектом пристального интереса геронтологов [1], пытающихся выяснить закономерности старения человека и разработать способы его замедления и повышения качества жизни в пожилом возрасте [2]. Рыбы представляют собой удобный объект изучения эволюции механизмов старения, поскольку они являются дальними эволюционными предками млекопитающих. В отличие от последних, многие виды рыб способны к размножению вплоть до максимального обнаруживаемого в природе возраста [3]. Ранее существовала гипотеза Bidder [4], основанная на наблюдениях за морской камбалой (Pleuronectes platessa), согласно которой рыба может избежать старения, если ей дать необходимые условия для бесконечного роста. Позднее эта гипотеза была опровергнута, например, данными, полученными на рыбах Danio rerio, выращиваемых в оптимизированных лабораторных условиях: при достижении полового созревания их рост прекращается и начинается фаза старения [5]. При этом известно, что ряд видов рыб являются долгоживущими с максимальным регистрируемым возрастом >100 лет: осётр (Acipenser spp.), морской окунь (Sebastes spp.), угольная рыба (Anoplopoma fimbria), лунник (Allocyttus verrucosus) [3], большеротый буффало (Ictiobus cyprinellus) [6]. Основываясь на этих и других известных к тому времени фактах или предположениях, Finch предложил выделить ряд видов рыб (осетровые, веслоносовые, камбалообразные, морской окунь, щука) в отдельную группу по механизмам старения – т.н. «пренебрежимо стареющие» (negligibly senescent) [7]. Однако другие исследователи считали, что отсутствие старения или очень медленное старение у этих видов рыб недостаточно обоснованно [8]. С развитием молекулярной биологии стало возможным описывать механизмы старения на молекулярном уровне. Теломеры представляют собой ДНК-белковые структуры на концах хромосом, состоящие из коротких тандемных повторов ДНК и многокомпонентного белкового комплекса, называемого шелтерином [9]. Из-за проблемы недорепликации концов ДНК, то есть неспособности системы репликации синтезировать двойную цепь ДНК до самого конца, теломеры укорачиваются по мере деления клеток. Укорочение теломер до определённого предела, изменение их структуры, разрушение комплекса теломер с шелтерином способствуют повреждению ДНК и нарушению клеточной пролиферации, что приводит к старению или апоптозу клетки. Эти два процесса – концевая недорепликация и укорочение теломер – лимитируют потенциал клеток той или иной ткани к регенерации и способствуют старению ткани [10]. Таким образом, зависимость длины теломер от возраста является важным молекулярно-генетическим критерием для описания механизма старения той или иной ткани животного [1], поэтому построение таких зависимостей выбрано в качестве метода текущего исследования. В качестве объекта данного исследования была выбрана обыкновенная щука (Esox lucius) – вид рыбы, возможно, относящийся к группе «пренебрежимо стареющих», а также в последнее время являющийся всё более распространённым объектом исследования в области эволюционной биологии и экологии. Так, в журналах, индексируемых в Web of Science, число публикаций, посвящённых щуке в контексте физиологии, токсикологии, эволюционных процессов и других аспектов исследования, выросло примерно с 20 в год в 1980-х гг. до 90–100 в 2010-х [11]. В качестве объекта сравнения выбран обыкновенный судак (Sander lucioperca) – один из наиболее близких видов по типу питания, среде обитания и морфометрическим характеристикам. Для выживаемости и качества жизни обоих этих хищников старение мышечной ткани имеет критически важное значение, поэтому для решения поставленной исследовательской задачи была выбрана именно эта ткань. МЕТОДИКА Для эксперимента использовали особей щуки (11 самцов и 15 самок) и судака (7 самцов и 9 самок) разного размера, выловленных в летний период 2018–2022 гг. в Угличском водохранилище (на территории Тверской области). Выловленных рыб подвергали анестезии в ледяной воде. У экспериментальных рыб отбирали чешую (для определения возраста), затем отбирали около 0.5 г спинных мышц в криопробирки, помещали в жидкий азот и транспортировали в нём в лабораторию, где хранили при -70°C. Возраст рыб определяли путём подсчёта кольцеобразных образований на чешуе под бинокулярным микроскопом (увеличение 20×) согласно опубликованным методикам для щуки [12, 13] и судака [13, 14]. Для определения абсолютной длины теломер в образцах мышечной ткани использовали методику, основанную на ПЦР в реальном времени [15, 16]. Геномную ДНК выделяли при помощи набора PureLink Genomic DNA Mini Kit («Thermo Scientific», США). Концентрацию выделенной ДНК определяли при помощи спектрофотометра Nanodrop 2000 («Thermo Scientific»). Амплификацию теломерных повторов проводили с помощью амплификатора с детекцией в режиме реального времени DTprime 5 («ДНК-технологии», Россия) в реакционной смеси qPCRmix-HS SYBR («Евроген», Россия). Реакцию проводили с ДНК в количестве 25 нг. Для детекции длины теломер использовали праймеры следующей нуклеотидной последовательности (0.1 мкМ каждого): прямой 5'-cggtttgtttgggtttgggtttgggtttgggtttgggtt-3'; обратный 5'-ggcttgccttacccttacccttacccttacccttaccct-3' [17]. Для каждого образца определяли пороговые значения цикла ПЦР в реальном времени (Ct, cycle threshold), т.е. количество циклов амплификации, необходимое для того, чтобы накопленная флуоресценция (получаемая в результате амплификации целевой ДНК) достигла порогового значения выше фонового. ДНК из клеток линии K562 (T-клеточная лимфома человека) использовали в качестве препарата сравнения (референсной ДНК). Данная линия клеток имеет известную длину теломер на уровне 6500 пар оснований [18]. Для построения калибровочной кривой определяли Ct для пяти количеств референсной ДНК: 100 нг, 50 нг, 25 нг, 12,5 нг и 6,25 нг. Был применён следующий режим амплификации: 95°С – 5 мин, далее 20 циклов: 95°С – 15 с (плавление), 58°С – 15 с (отжиг праймеров), 72°С – 30 с (элонгация). С помощью построенной калибровочной кривой графически определяли уточнённое значение Ct для референсной ДНК для количества 25 нг, эквивалентному количеству исследуемой ДНК. Измерение интенсивности флуоресценции производилось в конце цикла элонгации. Для вычисления длины теломер в исследуемых образцах использовали следующую формулу: длина теломер = Ct исследуемой ДНК / Ct референсной ДНК × 6500. Длину теломер в каждом образце измеряли трижды; для дальнейших расчётов брали усреднённое значение трёх технических повторов. Результаты представлены в виде линейной аппроксимации зависимостей длины теломер от возраста рыбы каждого вида, в том числе отдельно для самцов и самок. Статистическую достоверность зависимостей оценивали по шкале Чеддока путём вычисления модуля коэффициента корреляции R [19]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Разброс выборок особей рыб по возрастам составил 1–18 лет для щуки и 3–13 лет для судака. Это самые широкие возрастные диапазоны среди всех опубликованных зависимостей длин теломер клеток мышечной ткани от возраста у рыб. Наличие широкого диапазона возрастов необходимо для достоверности такой зависимости. График зависимости Ct от количества референсной ДНК имеет линейный вид; достоверность его линеаризации подтверждается близким к 1 значением коэффициента детерминации R2 = 0.9905, что даёт возможность говорить о релевантности использованного метода определения длины теломер. Выявленные зависимости длин теломер от возраста (независимо от пола) приведены на рисунке 1. Достоверность линейных зависимостей («теснота связи») по шкале Чеддока [19] получилась заметной, близкой к тесной у щуки и тесной у судака. Обе зависимости получились убывающими, при этом модуль углового коэффициента у судака в 4.6 раза выше, чем у щуки (рис. 1). Это означает, что теломеры у щуки укорачиваются медленнее, то есть теоретическая возможность регенерации мышечной ткани путём пролиферации клеток у щуки с возрастом падает ощутимо слабее, чем у судака. Возможность регенерации мышечной ткани путём пролиферации клеток выявлена, например, у взрослых рыб D. rerio [20]. Однако зависимость даже для щуки не выглядит горизонтальной, как, например, у эритроцитов долгоживущего большеротого буффало [6]. Таким образом, полученные нами данные не подтверждают пренебрежимость старения у щуки с точки зрения теломерной теории старения. Из других представителей группы «пренебрежимо стареющих» видов зависимость длины теломер от возраста ранее была получена для плавников сибирского осетра (Acipenser baerii) [21]. Данная зависимость значительно менее достоверна – скорее всего, из-за менее точного значения возраста (особи сгруппированы в группы с шагом в 2 года), неочевидного выбора образцов (плавники состоят из разных тканей) и меньшего возрастного диапазона, чем в нашем исследовании (самая старшая возрастная группа – 7–8 лет), – однако всё равно носит уверенно убывающий характер. Таким образом, можно утверждать, что выделение щуки и сибирского осетра (скорее всего, также и других осетровых) в группу «пренебрежимо стареющих» по гипотезе Finch недостаточно обоснованно с точки зрения известных молекулярных механизмов старения.
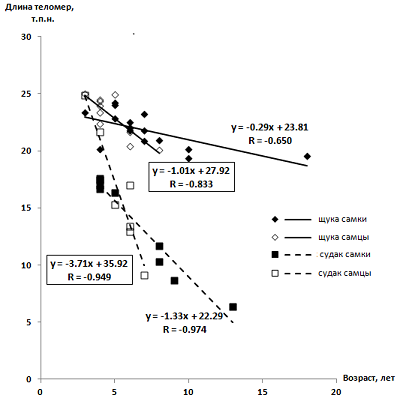
Наблюдаемую разницу модулей угловых коэффициентов зависимостей для щуки и судака нельзя объяснить фундаментальными различиями в механизмах старения, которых, скорее всего, не существует. Известно, что на длину теломер напрямую влияет активность теломеразы – специального фермента, достраивающего нуклеотидную последовательность теломер и тем самым их удлиняющего. Однако установлено, что теломераза имеет наибольшую активность в высокопролиферативных клетках. После дифференцировки в клетках человека и некоторых млекопитающих активность теломеразы сильно снижается [10], но у большинства видов рыб теломераза активна во всех тканях на протяжении всей жизни [22, 23]. У некоторых видов рыб наблюдается связь между возрастной динамикой длины теломер и активностью теломеразы (например, у данио-рерио); у ряда других такой связи не выявлено [22, 24]. Отсутствие какой-либо синхронности между возрастными зависимостями длины теломер и активности теломеразы (либо уровнями экспрессии гена TERT, кодирующего её белковую субъединицу) наблюдали также для различных тканей (включая мышцы) у атлантической трески (Gadus morhua) [25], а также во всём теле у японской оризии (Oryzias latipes) [26]; в последнем случае наблюдалась также высокая вариабельность значений активности теломеразы. Эти данные, а также ряд других указывают на то, что активность теломеразы и длина теломер регулируются независимо [27, 28] и их можно рассматривать как отдельные факторы при изучении механизмов старения. Таким образом, значимое влияние активности теломеразы на различную скорость укорачивания теломер у щуки и судака в течение всего многолетнего жизненного цикла рыбы маловероятно. Максимальная зафиксированная скорость плавания у щуки составляет 18.8 средней длины тела в секунду, что соответствует 25.6 км/ч, при этом эта скорость набиралась при ускорении 25 g. Максимальная зафиксированная скорость плавания у судака составляет 1.6 средней длины тела в секунду [29]. Такая разница в потенциале мышечной эффективности объясняется тем, что существуют физиолого-биохимические особенности функционирования мышечной ткани у щуки и судака. Например, химический состав мышечной ткани щуки способствует быстрому её восстановлению после стресса. При моделировании стресса на культуре клеток, если добавить в клеточную среду водный экстракт мышечной ткани щуки после окислительного воздействия, наблюдается значительно более быстрое восстановление культуры клеток, чем при добавлении экстракта мышц судака [30]. Кроме того, суммарная антиоксидантная активность высушенного водного экстракта мышц щуки, измеренная кулонометрическим способом, в 1.6 раз выше, чем у экстракта мышц судака [31]. Окислительный стресс может в существенной степени вызывать укорочение теломер за счёт окислительного повреждения ДНК, однако действие антиоксидантов предотвращает влияние стресса на длины теломер [32]. Такая разница в способности мышечной ткани щуки и судака восстанавливаться после стресса и предельных физических нагрузок вполне может быть фактором, влияющим на разницу в скорости укорачивания теломер, поскольку клетки мышечной ткани могут иметь более длинные клеточные циклы и реже подвергаться апоптозу, а также в них может предотвращаться окислительное повреждение ДНК за счёт выработки антиоксидантов. Соотношение угловых коэффициентов выявленных зависимостей согласуется с ранее выявленной корреляцией между максимальной продолжительностью жизни животного и угловым коэффициентом возрастной зависимости длин теломер при анализе данных для 22 видов животных (птицы, двустворчатые моллюски, млекопитающие, рептилии): у долгоживущих диких животных теломеры укорачиваются медленнее, чем у короткоживущих [33]. Максимальная продолжительность жизни щуки и судака, по данным из авторитетных источников, собранным в обновляемой базе данных AnAge (https://genomics.senescence.info/species/index.html), составляет 30 и 16 лет соответственно. Что касается непосредственно угловых коэффициентов, то даже в пределах одного класса животных (например, млекопитающие) имеет место вариабельность их значений: от -0.02 у мышей [34] до -138 у барсука [35]. У отдельных видов грызунов – таких, например, как считающийся медленно стареющим голый землекоп (Heterocephalus glaber), а также родственный ему обыкновенный пескорой (Cryptomys hottentotus mahali), возрастные зависимости длин теломер имеют горизонтальный характер при очень высокой вариабельности данных [34, 36]. Построены также аналогичные зависимости отдельно для самцов и самок каждого вида (рис. 2). Достоверность линейных зависимостей («теснота связи») по шкале Чеддока [19] получилась заметной, близкой к тесной у самок щуки и тесной либо сильной в остальных случаях. Обе зависимости получились убывающими, при этом модуль углового коэффициента у самцов щуки в 3.5 раза выше, чем у самок щуки, а у самцов судака в 2.8 раза выше, чем у самок судака (рис. 2). Подобное соотношение скоростей укорачивания теломер у самцов и самок является общей чертой в механизмах старения большинства позвоночных; например, показано, что у людей (выборка из 36 тыс. чел. в возрасте 40–80 лет) с доверительной вероятностью 95% теломеры у женщин длиннее, чем у мужчин [37]. Это также показывает наиболее вероятное отсутствие каких-либо специфических черт или механизмов старения у «пренебрежимо стареющих» рыб по гипотезе Finch, особенно у обыкновенной щуки.
ЗАКЛЮЧЕНИЕ
CОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Все экспериментальные процедуры с использованием животных проведены в соответствии с Директивой Европарламента и Европейского Совета № 2010/63/EU «О защите животных, используемых в научных целях». ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 годы) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|