|
ВЛИЯНИЕ АДЪЮВАНТОВ НА АНТИГЕННЫЕ СВОЙСТВА ПЕПТИДНЫХ КОНСТРУКЦИЙ ИЗ ФРАГМЕНТОВ ОБОЛОЧЕЧНОГО БЕЛКА Е2 ВИРУСА ГЕПАТИТА С 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, ул. Погодинская, 10; * e-mail: EKolesanova@yandex.ru. Ключевые слова: пептидные вакцины; вирус гепатита С; оболочечные белки; синтез пептидов; адъюванты; Иммуномакс DOI: 10.18097/BMCRM00227 ВВЕДЕНИЕ Низкая эффективность иммунных ответов на пептидные вакцины, которые пытались внедрять в клиническую практику (например, на терапевтическую вакцину против гепатита С [1, 2] и против SARS-CoV2 («ЭпиВакКорона» [3-5]), не охладила интерес к подобным вакцинам. Это вызвано ранее отмеченными в обзорах преимуществами пептидных вакцин по сравнению с вакцинами на основе цельных микроорганизмов (живых и убитых), субъединичными вакцинами и вакцинами на основе рекомбинантных белков-антигенов: а) безопасные технологии производства пептидов; б) высокая степень стандартизации пептидных антигенов и отсутствие чужеродного генетического материала; в) возможность формирования эффективного иммунного ответа на антигенные детерминанты, обладающие в составе целой молекулы слабой иммуногенностью; г) исключение компонентов и фрагментов молекул патогена, вызывающих высокую реактогенность, аллергические и аутоиммунные реакции; д) возможность компоновки искусственных конструкций из нескольких различных антигенных детерминант, происходящих из разных молекул антигенов [6-9]. Однако одним из основных недостатков пептидных вакцин является их неспособность стимулировать систему врожденного иммунитета и тем самым вызывать формирование достаточно длительного иммунного ответа и иммунологической памяти [6-10]. Пептиды в составе вакцины выполняют функцию иммуногенов – молекул, на которые будет направлен специфический иммунный ответ – образование антител, специфичных к возбудителю заболевания или его основному патогену, стимулирование цитотоксических и хелперных Т-клеток [1, 3, 6-9, 11]. Но для эффективного формирования иммунологической памяти необходимо стимулирование системы врожденного иммунитета и обеспечение достаточно длительного воздействия иммуногена на клетки иммунной системы в зародышевых центрах лимфоузлов [6, 8, 9]. Пептиды, как правило, не могут этого обеспечить из-за отсутствия соответствующей лигандной активности и неустойчивости к действию протеаз биологических жидкостей. Поэтому безусловной необходимостью для пептидных вакцин является подбор адъювантов и носителей, обеспечивающих как активацию системы врожденного иммунитета, так и повышение стабильности пептидных антигенов [8-10]. В настоящей работе было проведено сравнение эффективности иммунного ответа в виде образования специфичных антител на пептидные антигены, составленные из высококонсервативных фрагментов оболочечного белка Е2 вируса гепатита С (ВГС), в сочетании с адъювантами и носителями разного типа. МЕТОДИКА Синтез пептидов Пептиды синтезировали твердофазным методом на полистирол-дивинилбензольном полимере, модифицированном 4-(2′,4′-диметоксифенил-аминометил)-феноксиметильными группами (Rink amide), с емкостью 0.55 ммоля активных групп/г полимера («Applied Biosystems», США) исходя из начальной загрузки смолы в количестве, соответствовавшем 100 мкмолям активных групп, или 145.2 мг. Использовали 9-флуоренилметоксикарбонил(Fmoc)-защищённые по α-аминогруппе L-аминокислоты со следующими защитами боковых функциональных групп: Asp (D), Glu (E) – трет-бутокси; Gln (Q), Asn (N), His (H) и Cys (C) – тритильной; Arg (R) – 2,2,5,7,8-пентаметилхроман-6-сульфонильной; Lys (K) и Trp (W) – трет-бутилоксикарбонильной, Ser (S), Thr (T) и Tyr(Y) – трет-бутильной (все – «ChemPep», США). Синтез проводили на автоматическом синтезаторе 433А фирмы «Applied Biosystems» в среде N,N’-диметилформамида (ос.ч., «Спектр-хим», Россия). Fmoc-защиту с α-аминогруппы удаляли обработкой 22%-ным раствором 4-метилпиперидина («Acros Organics», Бельгия) [11, 12]. Fmoc-аминокислоты активировали гексафторфосфатом O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) и этиловым эфиром циан-гидроксииминоацетата (Oxyma Pure; «ChemPep») в присутствии 2,4,6-коллидина («Acros Organics») [13]. В реакциях присоединения использовали 10-кратный избыток Fmoc-аминокислот. Пептиды снимали со смолы вместе с удалением защит с боковых функциональных групп обработкой смесью трифторуксусная кислота (ТФУ):3,6-диокса-1,8-октандитиол:три-изопропилсилан:анизол:вода 183:5:2:5:5 (об./об.) в течение 2 ч [12, 13]. Пептиды осаждали смесью метил-трет-бутиловый эфир:гексан 1:1 (об./об) и высушивали над КОН. Очистку пептидов проводили ВЭЖХ на обращённой фазе (колонка ZORBAX SB-C8 21 x 250 мм, 7 мкм, хроматографическая станция Agilent 1100, «Agilent», США) в градиенте концентрации ацетонитрила: 0-15 мин – от 0 до 32 %, 15-45 мин – от 32 до 38 %, 45-50 мин – 38-100 % в воде в присутствии 0.1% ТФУ при скорости элюции 15 мл/мин и регистрации абсорбции элюата при 210 нм. Полученные очищенные препараты пептидов упаривали и лиофилизовали. Степень чистоты пептидов определяли аналитической ВЭЖХ (колонка ZORBAX SB-C8 4.6 x 150мм, 3.5 мкм, 100 Å, градиент концентрации ацетонитрила в 0.1% водном растворе ТФУ 0-100% за 50 мин, скорость элюции 1 мл/мин) и масс-спектрометрией с ионизацией электрораспылением на квадрупольном времяпролетном масс-спектрометре высокого разрешения MaХis 4G («Bruker Daltonics», Германия; регистрация положительно заряженных ионов в диапазоне 500-2000 Да). Липидные наночастицы, содержащие пептиды, получали смешиванием 400 мг сквалена («Acros Organics»), 20 мг Lipoid S100 (“Lipoid”, Германия), 400 мг Tween 80 («Ferak Berlin GmbH», Германия), 5 мг пептида в 10.0 мл дистиллированной воды с последующим доведением рН до 7.2-7.4 раствором 1M NaOH («Merck», Германия). Смесь обрабатывали на ультразвуковом дезинтеграторе Bаndelin Sonopuls HD 2200 («Bandelin», Германия) с использованием титанового стержня КЕ76 при мощности 70% во льду 6 циклов по 1 мин. Число циклов обработки устанавливали по достижению постоянной величины светопропускания при 660 нм не менее 60% на спектрофотометре Agilent 8453 («Agilent», Германия) с программным обеспечением HP UV Visible ChemStation version A10.01. Полученную эмульсию фильтровали через фильтр с порами 0.22 мкм («Merck Millipore», США). В полученном фильтрате определяли размер частиц методом динамического светорассеяния на анализаторе ZetaSizer Nano ZS («Malvern», Великобритания) с программным обеспечением Malvern ZETASIZER 6.20. После ультрафильтрации полученного препарата с использованием Vivaspin 6, 10 кДа («Sigma-Aldrich», США) в сконцентрированном в 10 раз ультрафильтрате определяли не связавшиеся с наночастицами пептиды аналитической ВЭЖХ, как указано выше. Аналогично получали липидные наночастицы без пептидов. Конъюгаты пептидов с Иммуномаксом (IM) получали с использованием препарата «Иммуномакс», предоставленного «Иммафарма» (Россия) и дополнительно очищенного диализом против воды и гель-фильтрацией на колонке с TSK-75 («Toyo Soda», Япония, 950х30 мм) с элюцией водой. Для получения конъюгатов использовали лиофильно высушенную высокомолекулярную фракцию, элюировавшуюся сразу за свободным объемом колонки. Конъюгацию проводили с использованием диэтилового эфира квадратной кислоты (3,4-диэтокси-3-циклобутен-1,2-дион; ДЭКК; «Acros organics») в две стадии [14]. На первой стадии активировали IM ДЭКК в 0.1 М Na-фосфатном буфере, рН 7.15 при массовом соотношении IM:ДЭКК 1:1.7, активированный IM отделяли от реагента гель-фильтрацией (см. выше) и лиофилизовали. Пептиды CR4-CR5 и CR5-CR3 (табл. 1) растворяли в смеси 8М водного раствора мочевины и диметилсульфоксида (1:4 по объему) до концентрации 1.0 мг/мл. 0.5 мл раствора пептида добавляли к 0.5 мл раствора IM, модифицированного ДЭКК (1.5 мг), в 0.1 М фосфатном буфере, рН 7.45, после чего в реакционную смесь добавляли 50 мкл 0.5М Na-боратного буфера, рН 8.5 и выдерживали 12 ч при 4°С. Конъюгаты диализовали последовательно против 8 М и 4 М растворов мочевины и 0.1 М фосфатного буфера. рН 7.45. Полученные растворы конъюгатов сильно опалесцировали и содержали небольшое количество осадка. Для введения мышам растворы конъюгатов разводили 0.9% раствором NaCl для инъекций до требуемой концентрации – 5 мкг, 20 мкг и 50 мкг конъюгата (в расчете на IM) в 100 мкл раствора. Иммуногенность пептидов и конъюгатов определяли по величинам титров специфичных антител в сыворотке крови мышей, иммунизированных соответствующими препаратами. Каждым препаратом иммунизировали группу из 6 мышей BALB/c, включающей 3 самца и 3 самки. Препараты (табл. 2) вводили подкожно в объеме 100 мкл в 6 точек на спине три раза с интервалом две недели. Для иммунизации пептиды растворяли в 0.85% растворе NaCl с 10 мМ Na-фосфатным буфером рН 7.2 (phosphate buffered saline; PBS) до концентрации пептида 1 мг/мл. Образцы с адъювантом Фрейнда (1-я иммунизация – с полным адъювантом, 2-я и 3-я – с неполным) получали смешиванием 1 объема раствора пептида с 1 объемом адъюванта. Образцы пептидов в виде механической смеси с IM получали смешиванием 1 объема раствора пептида и 1 объема раствора очищенного IM в концентрации 1.5 мг/мл. Мышей забивали декапитацией через неделю после последней инъекции, из собранной крови получали сыворотку, которую разделяли на аликвоты и хранили при -20°С до определения титров антител. Определение титров антител против пептидов и оболочечных белков Е2 и Е1Е2 ВГС методом иммуноферментного сорбционного анализа проводили, как описано ранее [15, 16], за исключением того, что пептиды CR4-CR5 и CR5-CR3 адсорбировали на поверхность лунок иммунологических планшетов высокой сорбционной емкости напрямую из 0.1 М Na-бикарбонатного буфера, рН 8.5. Белок Е2 (водорастворимая форма и гетеродимер Е1Е2) были любезно предоставлены д-ром Ж. Дюбюиссоном, Институт биологии, Лилль, Франция. In silico поиск Т-хелперных эпитопов в высококонсервативных фрагментах аминокислотной последовательности белков Е1 и Е2 проводили с помощью программных продуктов баз данных SYFPEITHI [17] и IEDB [18]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Ранее нами был предложен подход к конструированию пептидных иммуногенов для вакцины против гепатита С, заключающийся в соединении в одной искусственной пептидной конструкции высококонсервативных В- и Т-хелперного эпитопов из состава оболочечных белков Е1 и Е2, причем выбранный В-эпитоп должен был обладать функциональной активностью, существенной для ВГС [19]. Эффективность этого подхода была нами подтверждена с точки зрения образования антител, специфичных как к В-эпитопам, так и к целым оболочечным белкам вируса [19]. Иммуногенность таких конструкций с образованием как пептид-, так и белок-специфичных антител была зарегистрирована только при введении с адъювантом Фрейнда (АФ), что свидетельствует о недостаточно эффективном стимулировании иммунного ответа одними пептидами и их неправильной ориентации в составе образующихся в растворе агрегатов/мицелл [19]. Однако АФ не может быть использован в вакцинах для людей из-за своей высокой реактогенности [10]. Поэтому мы тестировали имуногенность пептидных конструкций из высококонсервативных фрагментов оболочечного белка Е2 ВГС в виде препаратов с фармацевтически приемлемыми адъювантами и носителями. В состав использованных в эксперименте пептидных конструкций (табл. 1) входят высококонсервативные участки CR3, CR4 и CR5 (обозначения согласно работе [20]) белка Е2.
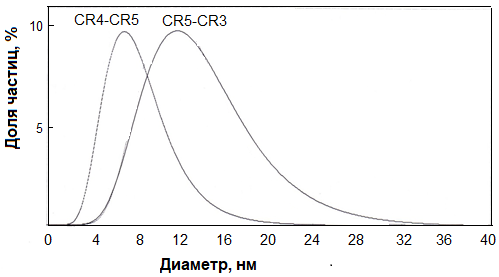
CR3 и CR4 связывали гепарансульфаты, ответственные за первичную фиксацию вируса на клетках [21], соответственно, антитела против этих В-эпитопов могли бы блокировать первичную фиксацию вируса на клетках [22, 23]. CR5 содержит Т-хелперные эпитопы, выявленные in silico с использованием программных продуктов SYFPEITHI [17] и IEDB [18] и подтвержденные в экспериментах по иммунизации животных [19] и по активации Т-лимфоцитов пациентов с гепатитом С [24]. Кроме того, у пациентов с гепатитом С выявлялись антитела, специфичные по крайней мере к двум линейным В-эпитопам участка CR5 [16]. Для выяснения влияния адъюванта и носителя на иммуногенность полученных пептидных конструкций последними иммунизировали мышей в виде следующих препаратов: 1) растворов пептидов в фосфатно-солевом буфере, 2) смеси этих растворов с АФ, 3) пептидов, включенных в состав фосфолипидно-скваленовых наночастиц (ФСН), 4) конъюгатов и 5) смесей IM с пептидами, 6) смеси конъюгатов пептид-IM с ФСН и 7) конъюгатов пептидов с декстраном. Использование для иммунизации пептидов без носителей обосновано тем, что в растворах с концентрацией 1 мг/мл указанные пептидные конструкции образовывали частицы диаметром 3-12 нм (медиана 5 нм; СR4-СR5) и 5-28 нм (медиана 12 нм; СR5-СR3) (рис. 1), что свидетельствовало об олигомеризации. В ряде случаев была отмечена иммуногенность таких мицелл с образованием антипептидных антител у иммунизированных ими животных [19].
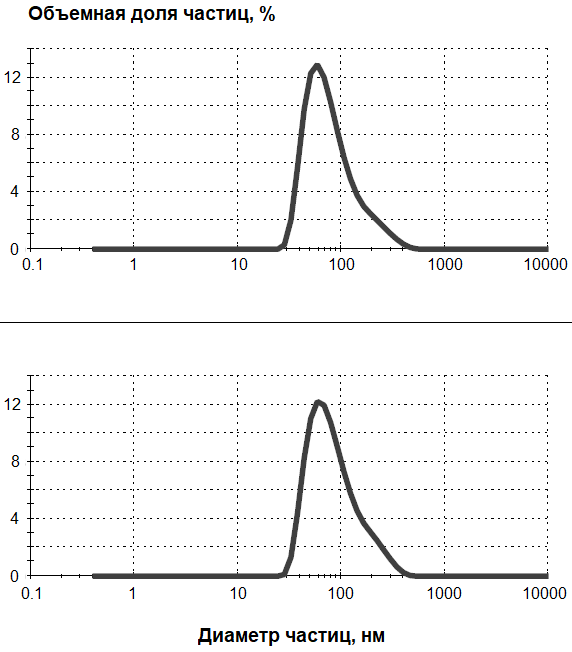
Сквален используется в качестве иммуностимулятора в составе эмульсионных адъювантов в современных вакцинах [1-3, 10, 25]. Показана также эффективность ФСН, стабилизированных фармацевтически приемлемым детергентом Tween 80, в качестве одновременно носителя и адъюванта для субъединичных вакцин [26], что обусловило нашу попытку применения ФСН для повышения иммуногенности пептидных конструкций. Пептиды включали в состав ФСН с Tween 80 в процессе получения обработкой ультразвуком. Полученные препараты ФСН с пептидами содержали наночастицы со средним диаметром 89-99 нм. (рис. 2).
После ультрафильтрации ФСН с пептидами в сконцентрированном фильтрате пептиды обнаруживались ВЭЖХ с масс-детектированием в следовых количествах, что свидетельствовало об их довольно прочной адсорбции на ФСН либо о включении в ФСН. Ещё одним тестированным нами носителем пептидных антигенов с адъювантной активностью был IM – высокомолекулярный липопротеогликан из проростков картофеля [27], способный активировать клетки иммунной системы, ответственные за врожденный иммунитет, через посредство толл-подобных рецепторов 4 типа и зарегистрированный в качестве лекарственного препарата с иммуномодуляторной активностью [27, 28]. Ранее IM был успешно использован в качестве носителя при получении моноклональных антител против неструктурных белков ВГС [29]. Поскольку IM содержит свободные аминогруппы, пептидные конструкции, также содержащие свободные аминогруппы, конъюгировали с этим протеогликаном с использованием ДЭКК, две карбокси-группы которого активируются при различных величинах рН и обеспечивают последовательную сшивку двух аминосодержащих соединений [14]. Так как IM почти не содержит компонентов, поглощающих при 280 нм, конъюгацию пептидов можно было бы оценить по увеличению оптической плотности раствора конъюгата при этой длине волны, однако сильная опалесценция раствора конъюгата не позволила провести точную оценку количества связавшегося пептида. Сложный состав и высокая молекулярная масса компонентов IM также не позволяли оценить количество конъюгированного с ним пептида с помощью аминокислотного анализа либо по изменению молекулярной массы. Согласно ранее опубликованным данным о количествах молей конъюгированных пептидов на единицу массы IM [29] нами было принято приблизительное содержание конъюгированных пептидов в препарате конъюгата 1% от массы IM. Помимо конъюгатов пептидов с IM нами было проведено тестирование на иммуногенность механической смеси пептидных конструкций с IM, в которых протеогликан выступал только как адъювант, а также конъюгата пептидов с декстраном, для исследования влияния высокомолекулярного, но не иммунореактивного носителя. Была проведена оценка эффективности и специфичности иммунного ответа на введение вышеуказанных препаратов пептидов группам мышей, состоящих из равного числа самцов и самок. Специфичность оценивалась по формированию антител как против отдельных фрагментов пептидных конструкций как В-эпитопов, так и против целого оболочечного белка Е2 и гетеродимера Е1Е2 ВГС. В таблице 2 приведены результаты определения титров антипептидных и антибелковых антител у животных, иммунизированных препаратами пептидов в композиции или в виде конъюгатов с различными адъювантами. Как видно из таблицы, пептиды CR4-CR5 и CR5-CR3 сильно различаются по иммуногенности: пептид CR5-CR3 вызывал образование специфичных антител у мышей даже при введении без адъювантов, тогда как для получения антител против пептида CR4-CR5 даже простого добавления адъюванта было недостаточно, требовалась конъюгация этого пептида с IM - носителем с адъювантными свойствами. В случае пептида CR4-CR5 важными были, по-видимому, и фиксация антигена на высокомолекулярном носителе, и стимулирование иммунной системы в направлении образования специфичных антител. Конъюгат данного пептида с IM вызвал образование антител, связывающихся с нативными оболочечными белками ВГС – Е2 и гетеродимером Е1Е2, что может свидетельствовать о формировании пептидом CR4-CR5 в составе конъюгата структуры, близкой к таковой в составе оболочечного белка. Возможно, однако, что эта структура не представляет собой линейный участок, поскольку антител против отдельных частей пептида (CR4 и CR5) в сыворотках крови иммунных животных не выявлено.
Иммуногенность пептида CR5-CR3 также была заметно повышена при конъюгации с IM: более высокого титра антител удалось добиться при 100-кратно более низкой дозе пептида. Интересно отметить, что при введении этого пептида с АФ не отмечено, в отличие от свободного пептида, образование белок-специфичных антител; вероятно, АФ предотвращал формирование пептидом структуры, близкой к таковой в белке. В сыворотках крови мышей, иммунизированных конъюгатом IM-CR5-CR3, были выявлены антитела против фрагмента CR3 в титрах 1:500-1:1000; антитела против фрагмента CR5 не были обнаружены. ФСН в качестве адъюванта оказались менее эффективными, чем IM. Однако добавление ФСН к конъюгату IM-CR5-CR3 немного повысило эффективность образования специфичных антител. ЗАКЛЮЧЕНИЕ IM как носитель с адъювантными свойствами оказался наилучшим из исследованных адъювантов для пептидных иммуногенных конструкций, составленных из высококонсервативных фрагментов оболочечного белка Е2 ВГС. Неясно, в чём состоит различие в механизме презентации антигенов, связанных с IM и с ФСН, поскольку тонкие механизмы стимулирования иммунного ответа скваленом пока не исследованы [25]. В отношении IM можно полагать, что активация им дендритных клеток через посредство TLR4 активирует механизмы врождённого иммунитета, задействуемые в дальнейшем в формировании адаптивного иммунитета, включая образование специфичных антител [27-30]. Кроме того, конъюгация пептидов с IM может способствовать их стабилизации, увеличивать проникновение в антигенпрезентирующие клетки и создавать пул медленно высвобождаемого иммуногена в месте введения. Вероятно, следует рассматривать IM как один из наиболее эффективных адъювантов для пептидных вакцин. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Проведение исследования на лабораторных животных было одобрено Этической комиссией при ИБМХ, протокол №2 от 12.02.2015 г. БЛАГОДАРНОСТИ Авторы выражают благодарность д-ру Ж. Дюбюиссону (Институт биологии, Лилль, Франция) за предоставленные препараты белка Е1 и гетеродимера Е1Е2, А.В. Талановой и Ю.Ю. Худоклиновой (ИБМХ) за помощь в работе с животными, а также ООО «Иммафарма» за предоставление препарата «Иммуномакс». Синтез и масс-спектрометрический анализ пептидов выполняли с использованием оборудования ЦКП «Протеом человека» ИБМХ. ФИНАНСИРОВАНИЕ Разработка структуры пептида CR5-CR3 была осуществлена в рамках Госконтракта №14N08.12.0025 от 08.08.2013 г. с Минобрнауки РФ. Пилотные эксперименты были выполнены в рамках Программы фундаментальных научных исследований государственных академий наук на 2013–2020 годы (тема № 0518-2014-0003), работа завершена в рамках Программы фундаментальных научных исследований государственных академий наук на 2021-2030 годы (тема № 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Р.И. Атауллаханов и Т.М. Мельникова являются авторами патента РФ 2 563 818 от 21.11.2013 г., описывающего способ получения IM и его иммуностимулирующую активность [27]. Е.А. Егорова и Е.Ф. Колесанова являются авторами патента РФ 2 675 108 от 15.06.2015 г. «Композиция на основе синтетических пептидов и липидов для вакцины против гепатита С», описывающего иммуногенную композицию, в состав которой входит пептид CR5-CR3; владельцем патента является ИБМХ. Остальные авторы заявляют об отсутствии конфликта интересов. Предварительные результаты работы по тестированию иммуногенности конъюгатов пептидов CR4-CR5, CR5-CR3 с IM в сравнении с композициями пептидов с фосфолипидными наночастицами размером 20 нм были представлены в виде стендовых сообщений на форуме «Дни иммунологии в Санкт-Петербурге» в 2015 г. и на 36 Европейском пептидном симпозиуме в Лейпциге (Германия) в 2016 г. ЛИТЕРАТУРА
|