|
Большие данные национальных реестров лекарственных средств
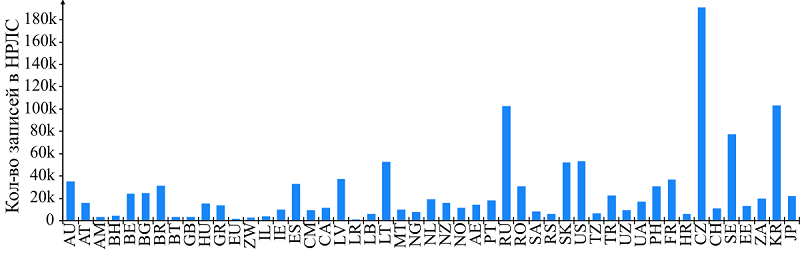
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: «большие данные»; лекарственные средства; национальные реестры лекарственных средств; медицинские агентства; веб-ресурсы; World Wide Approved Drugs DOI: 10.18097/BMCRM00230 ВВЕДЕНИЕ В настоящее время информация об одобренных лекарственных соединениях используется в разнообразных биомедицинских исследованиях как для изучения свойств уже известных, так и для разработки новых фармакологических препаратов. В связи с этим в сети Интернет представлено большое количество баз данных (БД), содержащих информацию о таких соединениях [1]. В компьютерном конструировании лекарств информация из подобных ресурсов используется для построения различных обучающих выборок, на основе которых выполняется прогностическая оценка физико-химических свойств или биологических эффектов исследуемых соединений. Количество и качество исходных данных играют решающее значение для эффективного применения методов in silico. Поэтому наиболее часто исследователи используют сведения об одобренных лекарственных соединениях, свойства и характеристики которых были детально изучены для получения разрешения на медицинское применение. Однако в настоящее время не существует единой свободно доступной БД, содержащей информацию обо всех лекарственных средствах, когда-либо одобренных к медицинскому применению [2]. Большая часть широко используемых веб-ресурсов содержит сведения об ограниченном количестве лекарств, в основном только о препаратах, одобренных в США и Европе. Достоверная информация о терапевтических средствах, разработанных и используемых локально, в одной-двух странах, в связи, например, с этнической принадлежностью, остаётся неизвестной [3]. Это приводит к снижению изучаемого и используемого исследователями фармакотерапевтического химического пространства. Информация о локально используемых лекарствах может быть получена из национальных реестров лекарственных средств (НРЛС). Медицинские агентства многих стран размещают свои НРЛС в сети Интернет для свободного доступа к ним исследователям и специалистам из области здравоохранения. Тем не менее, поиск таких реестров затруднён из-за большого количества регулирующих органов в мире [4], отличий представления информации, а также отсутствия единого ресурса, обеспечивающего доступ к этим данным [2]. Целью нашей работы был поиск свободно доступных НРЛС различных стран и анализ возможностей и ограничений использования представленной в них информации, а также сопоставление найденной информации со сведениями из широко используемых БД одобренных препаратов. 1. СВОБОДНО ДОСТУПНЫЕ НАЦИОНАЛЬНЫЕ РЕЕСТРЫ ЛЕКАРСТВ Поскольку в настоящее время отсутствует единый информационный ресурс, обеспечивающий доступ к НРЛС, мы провели поиск веб-сайтов медицинских ведомств различных стран в сети Интернет. На основе полученных данных были найдены веб-ресурсы, обеспечивающие свободный доступ к информации о лекарственных препаратах, разрешенных к медицинскому применению в каждой конкретной стране. На текущий момент нами были найдены веб-ресурсы для 71 страны и региона (см. Дополнительные материалы). 2. ОБЪЁМ ПРЕДСТАВЛЕННЫХ В НРЛС ДАННЫХ Для 49 из найденных 71 НРЛС мы подсчитали количество представленных в них записей. Для остальных реестров это сделать не удалось, по причине ограниченной функциональности соответствующих ресурсов в предоставлении всей имеющейся в них информации. Как видно из рисунка 1, количество представленных записей в проанализированных НРЛС сильно различается. В первую очередь это связано с тем, что в реестрах некоторых стран помимо фармацевтических препаратов представлены также косметические и гигиенические средства, ветеринарные препараты, средства традиционной медицины и гомеопатии. В связи с этим необходимо проводить предварительную фильтрацию данных для получения сведений только о веществах, относящихся к необходимой категории. Большое число записей связано со способом ведения НРЛС. Так, в реестрах России и Казахстана при каждом изменении как статуса регистрационного удостоверения (одобрение, продление, исключение и т.д.), так и текста официальной документации (новое показание к применению, выявленные в ходе пост-маркетинговых исследований побочные эффекты и т.д.) происходит появление новой записи. С одной стороны, это позволяет отслеживать в динамике результаты клинического использования препарата. С другой – приводит к необходимости обрабатывать большее количество записей с их последующей агрегацией.
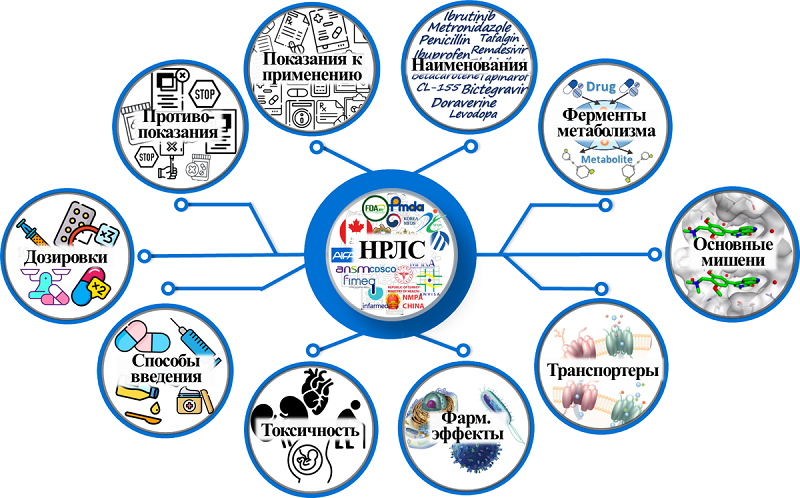
3. ИНФОРМАЦИЯ О ЛЕКАРСТВАХ, ДОСТУПНАЯ В НРЛС Найденные реестры можно условно разделить на две основные группы. Первая группа – краткие табличные реестры, содержащие торговое и непатентуемое наименования, дозировки и способы приёма препаратов. Используя их, можно получить полный перечень одобренных терапевтических средств. Однако, более детальные сведения, например, показания к применению лекарств, предоставлены во второй группе, к которой относятся веб-ресурсы. Используя их, можно получить доступ к следующим официальным документам: Общая характеристика препарата (Summary of Product Characteristics, SmPC), FDA Drug Label, Монография лекарства, Инструкция по применению и Обзорный отчёт регулирующего органа. Все публикуемые медицинскими ведомствами официальные документы содержат сведения о: (1) наименованиях (международных или национальных) лекарств, (2) вспомогательных веществах, (3) терапевтических назначениях, (4) способах применения, (5) дозировках, (6) побочных эффектах, (7) противопоказаниях и т.д. (рис. 2). Помимо этого, во всех типах документов представлена информация об известных механизмах действия лекарств (включая наименования молекулярных мишеней и типы взаимодействия с ними), токсичности, фармакокинетике (в том числе сведения о метаболизирующих ферментах и взаимодействии с транспортерами) и межлекарственных взаимодействиях. Однако для многих препаратов механизм действия либо достоверно не установлен (известны только виды фармакологических эффектов, которые возникают при приёме препарата), либо взаимосвязь молекулярной мишени с терапевтическим эффектом не известна. Информация о фармакокинетике лекарств, применяемых наружно, также представлена крайне редко.
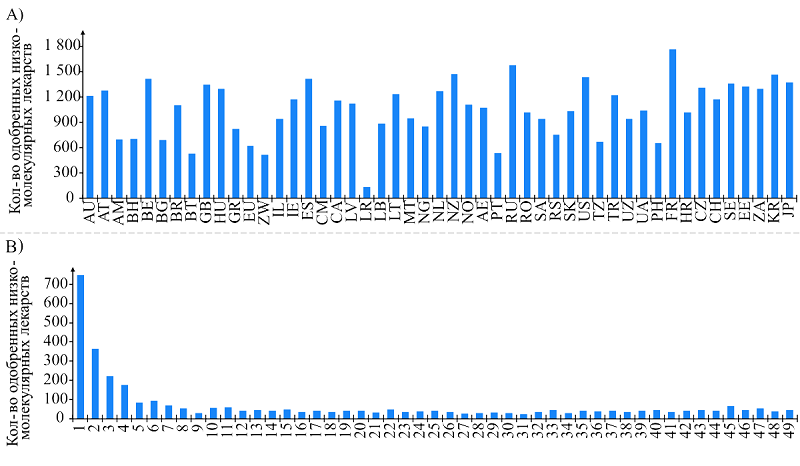
Обзорные отчёты регулирующих органов, FDA Drug Label и монографии лекарств содержат в том числе данные о структурных формулах лекарственных соединений и их физико-химических характеристиках. Также обзорные отчёты содержат подробную информацию о результатах исследований вторичной фармакодинамики и клинических испытаний препаратов. Дополнительным преимуществом является наличие в некоторых реестрах, например НРЛС России, сведений о производителях фармацевтической субстанции. Эта информация может быть использована, в частности, для поиска поставщиков образцов лекарственных соединений. 4. КОЛИЧЕСТВО ОДОБРЕННЫХ ЛЕКАРСТВ ПО ДАННЫМ НРЛС Для 49 из исследованных реестров мы подсчитали количество представленных в них уникальных низкомолекулярных активных фармацевтических субстанций (рис. 3А). Среднее количество таких соединений, представленных в НРЛС по данным на 2024 год, составляет 1057 веществ. В большинстве стран, веб-ресурсы медицинских ведомств которых были проанализированы, разрешены к применению «локальные» препараты, не встречающиеся в других реестрах. Как видно из рисунка 3Б, сведения о менее чем 50 низкомолекулярных активных фармацевтических субстанций содержатся во всех проанализированных реестрах. При этом, более 1100 лекарственных соединений присутствуют в НРЛС не более двух стран.
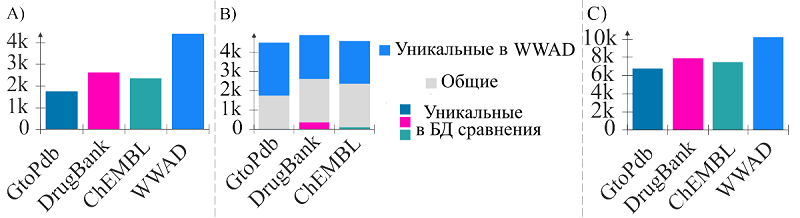
5. ОСОБЕННОСТИ ОБРАБОТКИ ДАННЫХ НРЛС Основную сложность в обработке данных НРЛС создают различия в: (1) методах доступа к данным, (2) способах представления реестра, (3) типах публикуемых документов и (4) представление данных на государственном языке. Важно также отметить, что в некоторых НРЛС, например, Американском, Российском, Белорусском, в качестве названия лекарственного соединения указывается наименование активного метаболита, а не той субстанции, которая изначально присутствует в препарате. Наименование субстанции можно получить только из официальной документации. Это влечёт за собой трудности в сопоставлении данных из различных реестров. Также дополнительную сложность создаёт представление текста документов в виде изображений, как, например, в реестрах России и США. На сегодняшний день доступные для использования алгоритмы интеллектуального анализа текстов и распознавания изображений (в том числе и структурных формул соединений) [5, 6] не позволяют с достаточно высокой точностью обработать доступную информацию. Их использование для обработки массива официальных документов пока невозможно. 6. БАЗА ДАННЫХ ФАРМАЦЕВТИЧЕСКИХ СУБСТАНЦИЙ WWAD Основываясь на полученной из медицинских реестров информации об одобренных к клиническому применению лекарственных средствах, нами была создана база данных World Wide Approved Drugs (WWAD) [7]. Текущая версия нашей БД содержит информацию о более чем 4400 уникальных низкомолекулярных фармацевтических субстанциях, в том числе сведения об их структурной формуле, взаимодействии с терапевтическими и вторичными мишенями, фармакологических эффектах, терапевтических назначениях и разрешении к медицинскому применению в различных странах. Нами было получено Свидетельство о государственной регистрации базы данных «World Wide Approved Drugs» № 2024621221 от 21 марта 2024 г. Мы оценили пересечение и структурное разнообразие лекарственных соединений, собранных из 71 НРЛС и представленных в WWAD и трёх широко используемых веб-ресурсах: DrugBank [8], ChEMBL [9] и IUPHAR/BPS Guide to PHARMACOLOGY (GtoPdb) [10]. Для сравнительного анализа из этих трёх веб-ресурсов были экспортированы файлы в формате SDF, содержащие структуры и наименования соединений, которые отмечены в каждом из них как «одобренные лекарства». Для оценки структурного разнообразия мы использовали разработанные нами ранее MNA дескрипторы [11]. Данный способ описания структурной формулы представляет собой список уникальных строк, отображающих её фрагменты. Подсчёт количества уникальных MNA дескрипторов для всех молекул в каждой БД предоставляет возможность оценить наличие в ней структурно различных соединений. По результатам сравнения было выявлено, что количество лекарственных соединений в WWAD значительно превосходит число молекул соответствующей категории в базах данных сравнения (рис. 4А). При этом число уникальных и структурно различных веществ в созданной нами БД также значительно выше (рис. 4B и 4С).
ЗАКЛЮЧЕНИЕ Отсутствие единого ресурса, предоставляющего доступ к НРЛС всех стран, создает определённые трудности при попытках анализа используемых в мире лекарственных субстанций с целью получения доступной информации об их биохимических, биофизических и фармакотерапевтических особенностях. Дополнительную сложность создаёт отсутствие доступа к некоторым НРЛС для международных исследователей, а также представление всей информации на различных языках. К настоящему моменту нам удалось найти свободно доступные реестры лекарств из 71 регионального и национального медицинского агентства. Анализ большого количества НРЛС позволил выявить терапевтические средства, разработанные и используемые вне США и Европы. Официальные документы, публикуемые медицинскими ведомствами после процесса одобрения препарата, содержат широкий спектр информации о лекарственном соединении, которая может быть использована в методах компьютерного конструирования лекарств. Эта информация позволила создать базу данных WWAD, по сравнению с которой другие свободно доступные ресурсы существенно отстают в отражении современного состояния фармацевтического представления и структурного разнообразия низкомолекулярных лекарственных соединений в мире. В процессе анализа собранных в БД WWAD массива гетерогенных биомедицинских и химических данных, выяснилось, что несмотря на сравнительное малое количество представленных на фармацевтических рынках мира лекарственных низкомолекулярных фармацевтических субстанций, объём и разнообразие информации о них является примером «больших данных» в биомедицинской области. Учитывая, что для сбора, последующей обработки и обогащения таких данных необходима разработка специальных алгоритмов их анализа, стандартизация и нормализация всеобъемлющих данных об известных лекарствах позволят использовать в исследовательских целях наиболее достоверную информацию о лекарственных препаратах и расширить исследуемое известное фармакотерапевтическое химическое пространство. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. БЛАГОДАРНОСТИ Авторы выражают искреннюю признательность компании ChemAxon за предоставление лицензии на программный комплекс Instant JChem. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы выражают искреннюю признательность компании ChemAxon за предоставление лицензии на программный комплекс Instant JChem. Авторы заявляют об отсутствии конфликта интересов.ЛИТЕРАТУРА
|