|
Цитохромы Р450 как инструменты электроферментативного синтеза
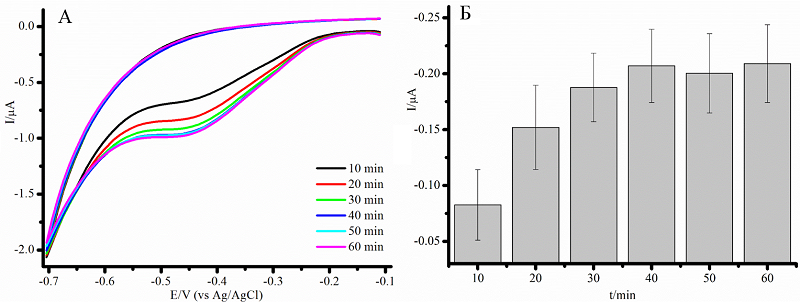
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: цитохромы P450; электрокатализ DOI: 10.18097/BMCRM00232 ВВЕДЕНИЕ Цитохромы P450 – суперсемейство ферментов, относящихся к классу оксидоредуктаз, выполняющих монооксигеназную функцию [1]. Основной функцией данных ферментов является биотрансформация эндогенных и экзогенных липофильных веществ. Цитохромы P450, обнаруженные во всех видах живых существ, катализируют огромное разнообразие регио- и стереоспецифических химических реакций, что делает эти ферменты перспективными для использования в качестве инструментов электроферментативного синтеза, а также для детоксификации ксенобиотиков [2, 3]. Цитохром Р450 2С9 (CYP2C9) – один из основных изоферментов цитохрома Р450 в организме человека, отвечающий за биотрансформацию лекарственных препаратов. К препаратам, метаболизируемым CYP2C9, относятся такие значимые лекарственные препараты, как диклофенак, S-варфарин, ибупрофен, напроксен и т.д. [4]. В клетке и в реконструированных системах для работы цитохрома Р450 необходимы белки редокс-партнёры, поэтому перспективным является исследование свойств цитохрома Р450 в электрохимических системах, где источником электронов является электрод. Поскольку каталитический цикл цитохрома P450 является сложным и многостадийным, на первой стадии которого осуществляется присоединение субстрата [5], более длительное взаимодействие фермента и субстрата на электроде способствует увеличению эффективности электрокаталитического процесса. С целью повышения эффективности электрокаталитических параметров цитохром Р450 2С9-систем в данной работе предложен подход, моделирующий микросомальный путь электрон-транспортного механизма переноса электронов и использующий в качестве низкомолекулярной модели редуктазы, как белка редокс-партнёра, флавиновых кофакторов (флавинмононуклеотида (FMN), флавинадениндинуклеотида (FAD)) [6]. МЕТОДИКА Электрохимические измерения проводили с использованием потенциостата PGSTAT 12 Autolab, («Metrohm Autolab Ins.», Нидерланды) с программным обеспечением GPES, (версия 4.9.7) и PGSTAT 312N Autolab с программным обеспечением NOVA (версия 2.0). В работе использовали трёхконтактные электроды, получаемые методом трафаретной печати (ПГЭ) («КолорЭлектроникс», Россия) с графитовыми рабочим и вспомогательным электродами и хлоридсеребряным электродом сравнения. Диаметр рабочего электрода составлял 0.2 см (площадь 0.0314 см2). Все потенциалы приведены относительно хлоридсеребряного электрода сравнения (отн. Ag/AgCl). В работе были использованы следующие реактивы: гидроксид калия, дигидрофосфат калия, хлорид натрия (“Спектр-Хим”, Россия); дидодецилдиметиламмония бромид (ДДАБ), диклофенак натрия, хлороформ (“Sigma-Aldrich”, США); флавинаденинмононуклеотид (FMN) (“Фармстандарт”, Россия); флавинадениндинуклеотид (FAD) (“Fluka”, Швейцария); водную дисперсию 0.2% одностеночных углеродных нанотрубок (диаметр 1.6±0.4 нм, длина ≥5 мкм, площадь поверхности 1000 м2/г), стабилизированных карбоксиметилцеллюлозой TUBALL™ BATT H2O (“OCSIAL”, Россия). Рекомбинантный CYP2С9 (210 мкМ) в 550 мМ калий-фосфатном буфере (рН 7.2), содержащем 0.2% CHAPS, 1 мМ дитиотреитол и 20% глицерин (по объёму), получен и выделен по методике [7]. Концентрацию фермента определяли спектрофотометрически по образованию комплекса восстановленной формы гемопротеина с монооксидом углерода; коэффициент поглощения ε450-490 = 91 мМ-1см-1 [8]. Для модификации ПГЭ на рабочую поверхность электрода наносили 1 мкл 0.1 М ДДАБ в хлороформе, после испарения хлороформа на электрод наносили 1 мкл 210 мкМ CYP2С9. Для иммобилизации нековалентного комплекса CYP2С9 c FMN или FAD растворы флавиновых нуклеотидов и CYP2С9 смешивали в эквимолярных концентрациях, инкубировали 5 мин и наносили на поверхность ПГЭ, модифицированную ДДАБ (ПГЭ/ДДАБ). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Увеличение каталитических параметров взаимодействия цитохрома P450 2C9 и субстрата путём образования эффективного фермент-субстратного комплекса Первым шагом к увеличению эффективности электрокатализа цитохромов P450 является взаимодействие фермента с субстратом и образование фермент-субстратного комплекса между иммобилизованным ферментом и субстратом. Ранее нами было установлено, что предварительная инкубация ферментного электрода в буфере, содержащем субстрат, увеличивает эффективность электрокаталитической реакции в 1.46 раза, а также показана зависимость каталитического тока взаимодействия фермента с субстратом от времени образования фермент-субстратного комплекса на электроде [6]. На рисунке 1А представлены циклические вольтамперограммы ПГЭ/ДДАБ/CYP2C9/FMN в присутствии 100 мкМ диклофенака после прединкубации. Сравнительная диаграмма величин каталитического тока от времени прединкубации представлена на рисунке 1Б. Этап предварительного образования фермент-субстратного комплекса способствует увеличению каталитического тока цитохрома CYP2C9 в присутствии диклофенака, оптимальное время прединкубации – 30 мин.
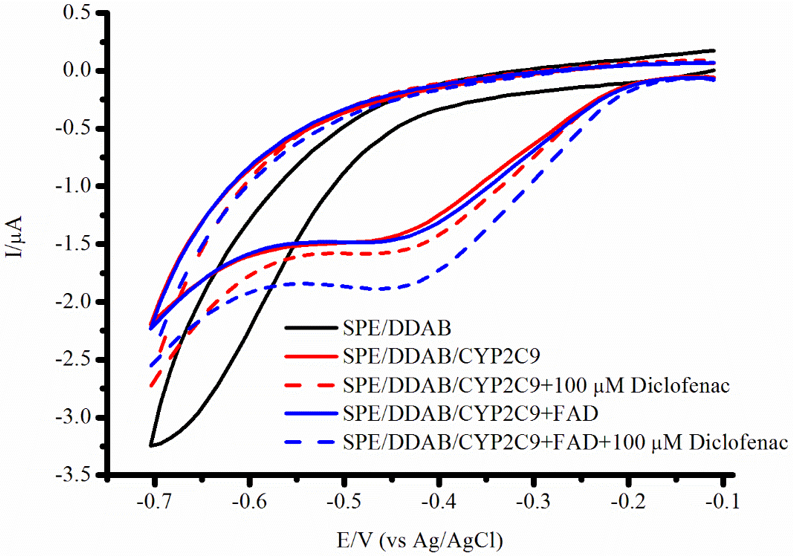
Повышение эффективности каталитического процесса путём использования цитохрома P450 2C9 в комплексе с FAD и FMN как низкомолекулярными моделями NADPH-зависимой цитохром P450 редуктазы Как было отмечено ранее [6], иммобилизация на электроде нековалентного комплекса цитохрома P450 и флавиновых нуклеотидов способствует увеличению электрохимических параметров взаимодействия. В данной работе был исследован нековалентный комплекс цитохрома P450 2С9 с FAD и FMN. На рисунке 2 представлены циклические вольтамперограммы ПГЭ/ДДАБ/CYP2C9 и ПГЭ/ДДАБ/CYP2C9/FAD.
Согласно вольтамперограммам были рассчитаны электрохимические параметры для систем ПГЭ/ДДАБ/CYP2C9, ПГЭ/ДДАБ/CYP2C9/FAD. Потенциал восстановления в этих системах существенно не отличается и равен Ered = -0.425±0.005 В и Ered = -0.420±0.008 В соответственно. При добавлении диклофенака в систему потенциал катализа смещался в положительную область потенциалов и соответствовал значениям Ecat = -0.402±0.017 В для ПГЭ/ДДАБ/CYP2C9 и Ecat = -0.407±0.007 для ПГЭ/ДДАБ/CYP2C9/FAD. Также было рассчитано соотношение каталитического тока в присутствии диклофенака к току восстановления в присутствии кислорода. Оно составило 1.35 для системы ПГЭ/ДДАБ/CYP2C9/FAD и 1.14 для ПГЭ/ДДАБ/CYP2C9, что также говорит о большей эффективности системы с флавиновым кофактором. В данной работе для исследования электрокаталитических свойств цитохрома CYP2C9 и комплексов цитохром CYP2C9/FAD и цитохром CYP2C9/FMN была использована двухэлектродная система, состоящая из ферментативного электрода-катализатора, модифицированного мембраноподобным соединением дидодецилдиметиламмоний бромидом (ПГЭ/ДДАБ), и измерительного электрода, модифицированного углеродными нанотрубками (ПГЭ/УНТ). Для исследования эффективности электроферментативных реакций, катализируемых цитохромом CYP2C9, в качестве субстрата был использован нестероидный противовоспалительный лекарственный препарат диклофенак. CYP2C9 катализирует реакцию стереоспецифического гидроксилирования с образованием 4’-гидроксидиклофенака. Метаболит 4’-гидроксидиклофенак регистрировали с помощью квадратно-волновой вольтамперометрии при потенциале Е = 0.12 (отн. Ag/AgCl) [9]. Использование FAD и FMN, как низкомолекулярного медиатора, позволило увеличить эффективность электрокатализа системы ПГЭ/ДДАБ/CYP2С9/FAD до 148±10% и ПГЭ/ДДАБ/CYP2С9/FMN до 113±6% по сравнению с ПГЭ/ДДАБ/CYP2С9 (100±5%), а также увеличить скорость ферментативной реакции в 1.5 и 1.13 раза соответственно. ЗАКЛЮЧЕНИЕ В данной работе были разработаны электрохимические системы на основе нековалентных комплексов CYP2C9 с флавиновыми кофакторами. Показано, что использование FAD и FMN в качестве низкомолекулярных моделей NADPH-зависимой цитохром P450 редуктазы способствует увеличению эффективности электрокатализа. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№ 122030100168-2). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|