|
Модифицированные кноттины как потенциальные ингибиторы протеазы NS3 вируса гепатита С
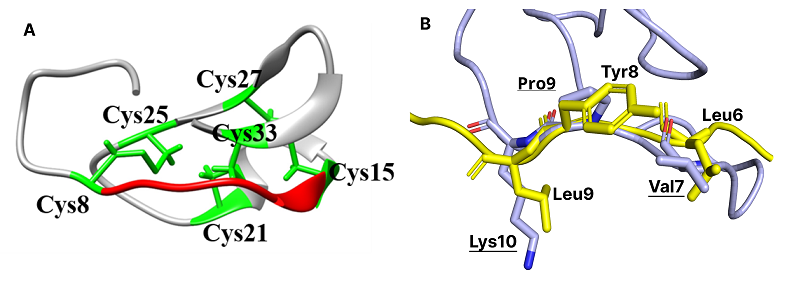
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: DOI: 10.18097/BMCRM00235 ВВЕДЕНИЕ Вирус гепатита С (HCV) является гепатотропным вирусом и основной причиной хронического гепатита и заболеваний печени во всем мире. Хотя в последние годы на рынке появилось несколько эффективных препаратов против HCV, лечение гепатита С по-прежнему вызывает сложности. Медикаментозное лечение сопровождается серьезными побочными эффектами, развитием лекарственной резистентности вируса, отсутствием отклика некоторых пациентов на терапию. По этим причинам продолжается поиск новых лекарственных средств и мишеней для борьбы с вирусом. Одной из основных мишеней для разработки лекарств является неструктурный белок 3 (NS3) HCV. Он представляет собой трёхфункциональный белок, N-концевой домен которого является сериновой протеазой, имеющей классическую каталитическую триаду сериновых протеаз (His-57, Asp-81 и Ser-139). Активный центр протеазы плоский и неглубокий, в нём отсутствуют специфические функциональные группы, поэтому минимальный специфичный для NS3-протеазы субстрат должен быть довольно длинным. Известные ингибиторы протеазы NS3 – это пептидомиметики с длинными цепочками чередующихся связей или пептиды, образующие макроциклы [1]. Альтернативой пептидомиметикам могут стать минибелки с жёсткой пространственной структурой. Такими свойствами обладают пептиды из семейства кноттинов. Это небольшие белки (около 30 аминокислотных остатков) с жёсткой структурой, стабилизированной с помощью трёх дисульфидных мостиков, один из которых проникает через макроцикл, образованный двумя другими дисульфидными связями. Структуры кноттинов включают в себя три антипараллельных β-тяжа и соединительные петли, которые определяют биологическую активность и специфичность кноттина. Благодаря наличию такого узла, кноттины проявляют исключительную химическую и термическую стабильность, а также устойчивость к протеолизу [2]. Модификации гибких петель кноттинов позволяют изменять их селективность методом прививки петли [3]. Одной из наиболее популярных и изученных структур, применимых для петлевой прививки, является ингибитор трипсина из Momordica cochinchinensis (MCoTI-II). Вышеупомянутые свойства кноттинов делают их перспективными шаблонами для разработки лекарств. Несколько препаратов на основе кноттинов уже одобрены к применению: зиконотид (Приалт) используют для лечения тяжёлой хронической боли [4], а линаклотид – для лечения болей в животе и синдрома раздражённого кишечника [5]. Для изменения селективности кнотиннов используют не только замены остатков протеиногенных аминокислот, но и остатки неприродных или D-аминокислот [6]. В данной работе мы представляем дизайн ингибиторов протеазы NS3 HCV, основанный на структуре кноттина Momordica cochinchinensis (MCOTI-II) путём прививки петли и эпимеризации аминокислот. МЕТОДИКА Структура протеазы NS3 HCV с кофактором NS4A в комплексе с пептидными ингибиторами (4A1V, 4A1X), а также структура ингибитора трипсина из семян Momordica cochinchinensis (1HA9) были получены из PDB [7]. Файлы параметризации и топологии были подготовлены в AmberTools22 с помощью модуля tleap. Моделирование молекулярной динамики (МД) проводили с использованием пакета Gromacs 2021.1 [8] с силовым полем amber99sb.ff [9] и моделью воды, заданной в явном виде, TIP3P. Значения свободной энергии связывания для комплексов NS3-ингибитор рассчитывали при помощи метода MM-GBSA с использованием программы gmx_MM-PBSA [10]. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Активный центр протеазы NS3 HCV достаточно широкий и плоский, что усложняет разработку низкомолекулярных ингибиторов. Поэтому среди ингибиторов NS3 доминируют пептидомиметики; некоторые из них содержат макроциклы, образованные за счёт связей между боковыми цепями аминокислотных остатков. Поэтому минипротеины семейства кноттинов представляются подходящими кандидатами для создания ингибиторов NS3 ВГС. Благодаря наличию цистеинового узла структура кноттинов остается жёсткой и допускает замены в петлях без существенного влияния на структуру белка (рис. 1А). Сравнение конформации основной цепи ингибирующей петли кноттинового ингибитора трипсина MCOTI-II и известного пептидного ингибитора из комплекса с протеазой HCV (PDB id 4A1V) показало их хорошее сходство (рис. 1B). Поэтому этот кноттин был выбран в качестве шаблона для разработки ингибиторов NS3. Предварительный комплекс протеазы HCV с MCOTI-II был создан путём наложения структур ингибирующей петли MCOTI-II и ингибитора протеазы HCV с последующей вставкой кноттина в активный центр протеазы HCV. Механизм ингибирующей активности ингибитора 4A1V заключается в том, что длинные боковые цепи Leu9 и Leu10 смещают структуру в более удалённое положение от каталитического Ser139, тем самым предотвращая нуклеофильную атаку на пептид-амидную связь [11]. В данной работе мы попытались создать ингибитор с таким же механизмом действия.
Сначала остатки P3-P1’ в MCOTI-II были заменены в соответствии с последовательностью пептидного ингибитора 4A1V [11]. Val7 заменили на Leu, Pro9 на Tyr и Lys10 на Leu (здесь и ниже остатки кноттина подчёркнуты). Анализ полученного комплекса протеазы NS3 HCV и модифицированного кноттина показал отсутствие серьёзных стерических конфликтов, но некоторые области взаимодействия могут быть дополнительно оптимизированы для более тесного контакта. Lys136 протеазы NS3 располагался в широкой полости MCOTI-II, образованной гидрофобными боковыми цепями Ile11 и Pro22. Таким образом, замена этих остатков кноттина на отрицательно заряженные остатки может улучшить взаимодействие с протеазой. Замена обоих остатков на Glu привела к более плотному контакту с ε-аминогруппой Lys136. Следующей заменой была Ala24Ile с целью увеличения гидрофобных контактов ингибитора с петлёй Val159-Arg162 протеазы. Поскольку N-конец MCOTI-II не контактировал с протеазой, первые три N-концевых остатка были удалены (далее будет использована исходная нумерация остатков). В результате этих модификаций был получен первый потенциальный вариант ингибитора протеазы NS3 (KIT-1). Замена Gly6Val была выполнена для увеличения контактов ингибитора с мишенью и для снижения возможности эпимеризации Asp4, которая могла произойти из-за близкого соседства двух остатков глицина [12]. В результате был получен второй вариант ингибитора – KIT-2. Сравнение известных пространственных комплексов протеазы NS3 ВГС с различными пептидомиметиками показало, что участок протеазы, образованный Lys136, Val158 и Cys161, взаимодействует с гидрофильными или заряженными группами ингибиторов. Поэтому были предложены две замены – Leu7/Lys (KIT-3) и Leu7/Thr (KIT-4). Кроме того, чтобы проверить вклад Asp4 (N-концевой остаток в комплексах KIT), на основе KIT-1 был создан вариант KIT-5, в котором отсутствует этот остаток. В таблице 1 суммированы все предложенные модификации MCOTI-II.
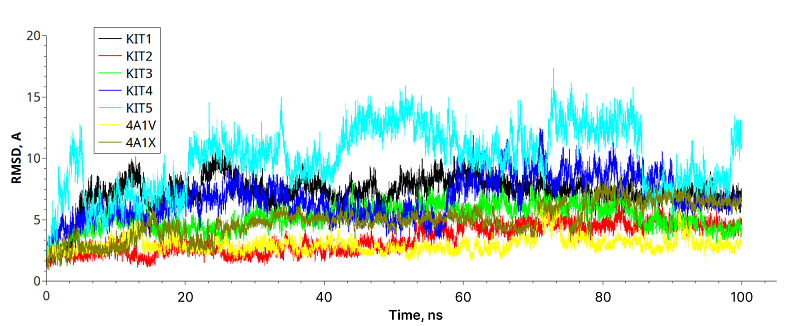
Было проведено моделирование молекулярной динамики для оптимизации структуры, оценки стабильности комплексов протеазы NS3 с разработанными KIT, а также с известными ингибиторами NS3 (PDB 4A1V и 4A1X) в качестве контроля.
Анализ поведения комплексов при молекулярной динамике позволил предложить для KIT-2 произвести 3 замены L-аминокислот на их D-изомеры: Leu12, Lys13, Lys14. Помимо увеличения аффинности, L-D замена может повысить устойчивость кноттина к протеолизу. МД моделирование разработанного варианта кноттина (KIT-2_D-Lys14) показало, что боковая цепь Tyr32 образовала новые контакты между кноттином и протеазой, но другие контакты были дестабилизированы: подвижность N-концевых остатков кноттина увеличивалась, а кноттин сместился по сравнению с положением KIT-2. Замена D-Lys13 также привела к локальному улучшению – формированию стабильного VdW-контакта с Thr41. Замена L->D-Leu12 привела к возникновению VdW-контакта между D-Leu12 и Thr43. Оценку аффинности разработанных кноттинов с протеазой NS3 проводили методом MM-GBSA. Расчёты проводили для комплексов в интервале от 40 нс до 100 нс. Рассчитанные энергии связывания разработанных кноттинов приведены в таблице 2 в сравнении с расчётными значениями для пептидных ингибиторов 4A1X (Ki 57,3 нМ) и 4A1V (Ki 10,5 нМ) [11]. Видно, что энергия связывания KIT-1 и KIT-2 близка к значениям для ингибиторов 4A1V и 4A1X, поэтому можно ожидать, что значения Ki для этих кноттинов будут также близки. Для комплексов с D-изомерами можно отметить, что такие замены приводят к локальным улучшениям связывания и возникновению новых контактов, но могут привести к дестабилизации комплекса в целом. С учётом рассчитанной энергии связывания лучшими вариантами являются KIT-1 и KIT-2, которые имеют расчётные значения, наиболее близкие к экспериментально проверенным ингибиторам и, следовательно, могут быть предложены для дальнейшего тестирования.
ЗАКЛЮЧЕНИЕ Было проведено преобразование ингибитора трипсина из семян тыквенных MCOTI-II в ингибиторы протеазы NS3 ВГС с помощью методов рационального компьютерного моделирования. Дизайн включал замену остатков внутри ингибирующей петли для изменения селективности шаблонного кноттина, дополнительные N-концевые делеции для оптимизации взаимодействия кноттина с новой мишенью и замену L-остатков на их D-стереоизомеры. Было разработано восемь вариантов кноттинов. На основе анализа траекторий молекулярной динамики, и оценки энергии связывания для дальнейшей экспериментальной проверки были предложены два варианта ингибитора. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|