|
Моделирование гематоэнцефалического барьера с использованием культур клеток мозга крысы
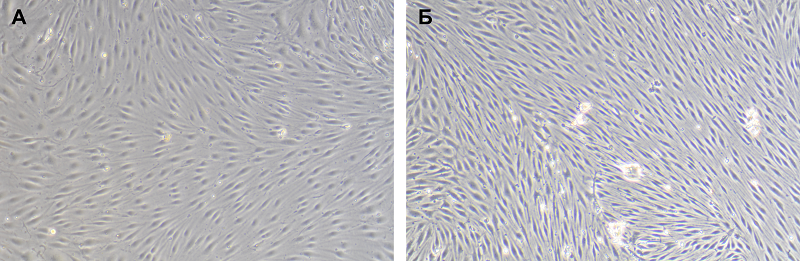
Институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: гематоэнцефалический барьер; эндотелиоциты; астроциты; перициты; сокультивирование клеток DOI: 10.18097/BMCRM00238 ВВЕДЕНИЕ Современные методы терапии заболеваний центральной нервной системы демонстрируют ограниченную эффективность, что обусловлено сложностью патофизиологии, ограниченной способностью к регенерации, а также барьерной функцией гематоэнцефалического барьера (ГЭБ) [1]. ГЭБ отделяет паренхиму мозга от кровотока и одновременно поддерживает двустороннюю связь между ними. Это уникальная структура, состоящая из эндотелиальных клеток, базальной мембраны, перицитов и астроцитов [2]. Для большинства веществ, в том числе лекарственных препаратов для лечения заболеваний головного мозга, ГЭБ является непроницаемым, а механизмы высокой селективности и регуляции проницаемости ГЭБ в норме и при патологии до сих пор не до конца ясны и остаются предметом дискуссий [3]. Более 20 лет назад в области нейронауки получила развитие концепция нейроваскулярной единицы (НВЕ) [4]. НВЕ формируется за счет нейронов, интернейронов, астроцитов, базальной мембраны, выстланной гладкомышечными клетками и перицитами, эндотелиоцитов и внеклеточного матрикса, т.е. включает в себя основные компоненты ГЭБ. Каждый из компонентов НВЕ тесно взаимосвязаны с другими компонентами, создавая анатомически и функционально цельную структуру, что приводит к высокоэффективной системе регуляции церебрального кровотока [5]. Недавно Schaeffer и Iadecola предложили концепцию нейроваскулярного комплекса и доказали, что предшествующая концепция нейроваскулярной единицы не отражает в полной мере механизмы регуляции и поддержания гомеостаза головного мозга [6]. Авторы отмечают, что введение понятия НВЕ привело к прогрессу в понимании сигнальных механизмов, связывающих нейроны и глию с локальной микроциркуляторной системой. Однако эта концепция не учитывает скоординированное взаимодействие внутримозговых микрососудистых событий с более крупными артериями выше по течению и с вазоактивными сигналами, возникающими с периферии, которые имеют решающее значение для динамической регуляции цереброваскулярной функции. Кроме того, клеточное, молекулярное и функциональное разнообразие цереброваскулярного дерева, в целом, не может быть адекватно представлено канонической НВЕ. Концепция нейроваскулярного комплекса предполагает наличие отдельных функциональных модулей, охватывающих все цереброваскулярное дерево и регулируемых факторами, внутренними и внешними по отношению к мозгу [6]. Несмотря на появление подобных концепций, касающихся регуляции цереброваскулярной функции, гематоэнцефалический барьер как структурная и функциональная единица до сих пор является объектом пристального внимания научного сообщества. В частности, моделирование ГЭБ in vitro представляет собой актуальную медико-биологическую проблему, которая обладает высокой практической значимостью. Такие модели широко востребованы при проведении исследований, направленных на изучение проникновения в мозг различных терапевтических агентов для борьбы с церебральными патологиями [7]. Исходно модели ГЭБ были отработаны на монокультурах эндотелиоцитов капилляров головного мозга крыс [8]. Такие модели чаще всего используют для изучения транспортных систем, отвечающих за проникновение веществ в клетки и их выведение. Модели ГЭБ, состоящие из монокультур эндотелиоцитов, могут быть использованы для решения разнообразных задач, включая изучение отдельных сигнальных путей, кинетики переноса, аффинности связывания или рутинных скринингов [9]. Однако подобные модели не могут применяться для изучения проницаемости ГЭБ, поскольку содержат только один тип клеток и не позволяют имитировать микросреду мозга, в частности межклеточные взаимодействия между различными типами клеток ЦНС. Поэтому для изучения целостности ГЭБ требуются более сложные модели, состоящие из нескольких клеточных типов. В литературе описаны системы, состоящие из нескольких типов клеток, включая эндотелиоциты и астроциты [10] или эндотелиоциты, астроциты и перициты [11]. Что касается использования человеческих клеток для моделирования ГЭБ, очевидно, что вследствие малой доступности донорского материала реализация подобной задачи затруднительна [12]. Поэтому вместо первичных культур клеток чаще используют соответствующие линии иммортализованных клеток, которые не в полной мере сохраняют свойства исходных клеток [13], либо индуцированные плюрипотентные клетки, дифференцированные в клетки соответствующих типов [14, 15]. Технология моделирования ГЭБ в лабораторных условиях состоит из следующих этапов: 1) выбор соответствующих типов клеток (первичные культуры, клеточные линии, стволовые/прогениторные клетки); 2) реконструкция микроокружения за счет подбора состава культуральной среды (наличие ростовых факторов, цитокинов и иных сигнальных молекул) и за счет выбора микроархитектуры (например, 2D-модель с подбором матриксных покрытий, 3D модель с подбором скэффолдов, модель сфероида, или контактные и бесконтактные модели в transwell); 3) определение необходимости культивирования в статических или микрофлюидных условиях [16, 17] Таким образом, моделирование физиологических и функциональных свойств ГЭБ in vitro является непростой мультидисциплинарной задачей, которая к настоящему моменту решена лишь частично и является крайне актуальной как для фундаментальных, так и для доклинических скрининговых исследований. В данной работе мы предлагаем эффективные и воспроизводимые способы получения трех типов чистых культур клеток, входящих в состав ГЭБ, эндотелиоцитов, астроцитов и перицитов, из головного мозга крысы и вариант их сокультивирования для получения модели ГЭБ, имитирующей клеточный состав и его архитектуру in vivo. МЕТОДИКА Перициты, астроциты и эндотелиальные клетки выделяли из головного мозга крыс линии Wistar. Животных содержали в стандартных условиях вивария со свободным доступом к еде и воде. Перед проведением процедуры декапитации и извлечения головного мозга животных усыпляли под ингаляционным наркозом смесью 2.5–3% изофлурана (Aerrane, «Baxter HealthCare Corporation», США) и 97–98.5% атмосферного воздуха с использованием системы анестезии животных. Выделение астроцитов из головного мозга крысы Для выделения астроцитов использовали кору больших полушарий головного мозга крыс возрастом 6-8 сут. После декапитации черепную коробку вскрывали по линии сагиттального шва, раскрывали череп, отделяли передний мозги переносили его в чашку Петри, дважды промывали в растворе Хэнкса («ПанЭко, Россия), дополненном 1% HEPES («Gibco», США). Под контролем стереомикроскопа удаляли мозговые оболочки и очищали мозг от миелинового одеяла.Ферментативную обработку измельченной ткани мозга проводили в 0.05% растворе трипсина, содержащем 0.02% ЭДТА («ПанЭко»), предварительно нагретом до 37ºC, в течение 15 мин. Полученную суспензию дважды отмывали в растворе Хэнкса центрифугированием при 350 g в течение 5 мин. Полученный осадок ресуспендировали в ростовой среде для нейральных клеток на основе Neurobasal Medium («Gibco»), содержащую добавку В27 («Gibco») и 20 мМ KCl («Sigma-Aldrich», США). Клетки культивировали в 12-луночных планшетах, предварительно покрытых поли-DL-лизином (10 мкг/мл) («ПанЭко»). Смену среды осуществляли каждые три дня. Под контролем стереомикроскопа удаляли мозговые оболочки и очищали мозг от миелинового одеяла. Полученные культуры астроцитов характеризовали по экспрессии глиального фибриллярного кислого белка (GFAP – glial fibrillary acidic protein) и белка S100В с применением флуоресцентной микроскопии. Астроциты рассаживали на покровные стекла, покрытые поли-DL-лизином. GFAP и S100В являются внутриклеточными белками, потому окрашивание и анализ проводили, как описано выше. Для окрашивания использовали антитела, специфичные к GFAP (1:100, «Abcam», Бельгия), S100В и βIII-тубулину (1:100, «ThermoFisher», США) и вторичные анти-видовые антитела, меченные Alexa Fluor 488 (1:1000, «Sigma», США). Ядра клеток докрашивали DAPI. Анализ окрашивания проводили на флуоресцентном инвертированном микроскопе THUNDER Imager («Leica Microsystems», Германия). Для оценки морфологии полученных культур перицитов, эндотелиоцитов и астроцитов использовали фазово-контрастный микроскоп Axiovert 40CFL («Zeiss», Германия) и цифровую камеру D500 («Nikon», Япония). Выделение перицитов из головного мозга крыс Перициты получали из головного мозга 2-3-недельных крыс. Очищенные полушария головного мозга измельчали в растворе Хэнкса, дополненного 1% HEPES, после чего центрифугировали в течение 5 мин при 350 g. Надосадочную жидкость удаляли, к осадку добавляли раствор, содержащий смесь ферментов (60 мкг/мл коллагеназы, 0.3 Ед/мл диспазы, 35 мкг/мл ДНКазы типа I) и 50 мкг/мл гентамицина (все – «Gibco»), тщательно ресуспендировали и инкубировали 30 мин при 37°C, периодически перемешивая. К получившемуся гидролизату ткани добавляли раствор Хэнкса, содержащего 25% бычьего сывороточного альбумина (BSA, «Sigma»). Разделение фракций в зависимости от плотности проводили за счет центрифугирования при 3600 g в течение 15 мин, в результате чего на поверхности формировался диск, содержащий миелиновую оболочку и паренхиму мозга, на дне пробирки – осадок из микрососудов. Супернатант вместе с диском аккуратно переносили в центрифужную пробирку и повторно центрифугировали при тех же условиях. Полученный после двух центрифугирований осадок, содержащий микрососуды головного мозга, ресуспендировали в холодном растворе Хэнкса и центрифугировали 5 мин при 350 g. Надосадочную жидкость удаляли, к осадку добавляли 1 мл ферментативного раствора, используемого на предыдущем этапе, и инкубировали 1 ч при 37°C, периодически перемешивая. К полученной после ферментативной обработки суспензии добавляли раствор Хэнкса и центрифугировали 5 минут при 350 g. Осадок ресуспендировали в полной ростовой среде на основе DMEM/F12 с добавлением 15% фетальной телячьей сыворотки (FBS) и пенициллина/стрептомицина (все – «Gibco»). Суспензию переносили в непокрытые культуральные флаконы (75 см2) и культивировали в стандартных условиях в СО2-инкубаторе. Через 48 ч производили полную замену среды для избавления от клеточного и тканевого дебриса. Затем каждые два дня производили замену 50% объема ростовой среды эквивалентным объемом свежей среды. По достижении перицитами 90–95% конфлюентности клетки трипсинизировали с использованием 0.25% трипсина/ЭДТА («ПанЭко»). Открепившиеся клетки собирали, центрифугировали 10 мин при 300 g. Осадок ресуспендировали в свежей ростовой среде и оставляли в колбе для осаждения на 1 ч. Прилипшие клетки удаляли и в культуре оставляли только суспензионные клетки. Этот процесс повторяли после каждой трипсинизации. В качестве характерного маркера перицитов анализировали экспрессию гладкомышечного альфа-актина (αSMA) с помощью флуоресцентной микроскопии. Перициты на 2-ом пассаже рассаживали на покровные стекла, покрытые 0.01% поли-L-орнитином («Sigma-Aldrich») и помещенные в лунки 12-луночного планшета. Сначала суспензию клеток в 1 мл FBS помещали на покровные стекла и инкубировали 30 минут при 37°С, затем FBS заменяли на полную ростовую среду. Через 24 часа ростовую среду удаляли, клетки промывали фосфатно-солевым буфером (PBS) и фиксировали 4% раствором параформальдегида в течение 10 мин. Для пермеабилизации плазматической мембраны и блокирования неспецифического связывания фиксированные клетки после удаления параформальдегида и 2-х отмывок в PBS инкубировали в PBS, дополненном 0.25% Triton X-100 («Sigma-Aldrich») и 1% BSA («AppliChem»), в течение 30 мин. Далее перициты инкубировали с первичными мышиными антителами против крысиного αSMA (1:150, «ThermoFisher») в том же буфере 12 часов при +4ºС. По окончании инкубации клетки промывали в PBS и инкубировали с вторичными анти-видовыми антителами, меченными Alexa Fluor 555 (1:1000, «Sigma»), в темноте 60 мин. Ядра клеток докрашивали DAPI (4,6-диамино-2-фенилиндол дигидрохлорид) 1 мкг/мл («Sigma-Aldrich») в течение 10 мин. Анализ изображений проводили на флуоресцентном инвертированном микроскопе THUNDER Imager («Leica Microsystems»). Выделение эндотелиоцитов из головного мозга крыс Эндотелиоциты выделяли из коры больших полушарий крыс в возрасте 2-3 недели. До ферментативной обработки ткань готовили так же, как описано выше для получения астроцитов и перицитов. Измельченную ткань коры головного мозга крыс инкубировали в чашках Петри в 0.1% растворе коллагеназы IV типа («Gibco») в течение 90 мин при 37°С. По окончании инкубации к гидролизату ткани добавляли охлаждённую среду DMEM/F12 («Gibco») и переносили содержимое в центрифужные пробирки, осаждали центрифугированием при 350 g в течение 5 мин. Супернатант удаляли, осадок ресуспендировали в 25% растворе BSA («Sigma»), снова осаждали при 3600 g в течение 15 мин. Полученный клеточно-тканевой осадок повторно инкубировали в 0.1%-ом растворе коллагеназы IV типа («Gibco») в течение 1 ч при 37°С. Полученную после ферментативной обработки суспензию фильтровали через нейлоновый фильтр с размером пор 10 мкм. Фрагменты кровеносных капилляров собирали с внешней стороны фильтра путем его промывки в обратном направлении полной ростовой средой для эндотелиоцитов на основе EBM-2 («Gibco») с добавлением 10% FBS («Gibco»), пенициллина/стрептомицина («Gibco»). Суспензию переносили в культуральные флаконы (75 см2), покрытые коллагеном («Corning», США), и культивировали в CO2-инкубаторе в стандартных условиях (37ºС, 5% СО2). В течение первых трех дней после выделения в полную ростовую среду добавляли пуромицин («Sigma») в концентрации 3 мкг/мл, что необходимо для предотвращения контаминации первичной культуры эндотелиоцитов другими типами клеток. При достижении монослоя культуры рассаживали в соотношении 1:2 трипсинизацией, как описано выше. Полученные культуры эндотелиоцитов микрососудов головного мозга крысы характеризовали по экспрессии специфических маркеров с использованием флуоресцентной микроскопии. Эндотелиоциты рассаживали на покрытые коллагеном покровные стекла, помещенные в лунки 12-луночного планшета. Через 24 ч после полной адгезии клеток ростовую среду удаляли, промывали в PBS, дополненном 1% BSA. Для внутриклеточного окрашивания клетки фиксировали в 4% параформальдегиде в течение 10 мин и проводили пермеабилизацию плазматической мембраны, как описано выше. В качестве внутриклеточного маркера дифференцированных эндотелиоцитов анализировали экспрессию фактора фон Виллебранда (von Willebrand factor, VWF) и ZO-1 (zonula occludens). Для окрашивания поверхностных маркеров после отмывки в PBS, дополненном 1% BSA, к клеткам сразу добавляли специфические антитела к маркерам эндотелиоцитов головного мозга, участвующих в формировании ГЭБ, включая CD31, окклюдин (occludin), клаудины (claudins 1,3,4,5,12). Инкубацию клеток с первичными антителами к выше перечисленным маркерам (1:100, все – «ThermoFisher») проводили в течение 1 ч при комнатной температуре. После 2 отмывок в PBS, дополненном 1% BSA, клетки инкубировали с анти-видовыми антителами, меченными Alexa Fluor 488 (1:1000, «Sigma»), в темноте в течение 60 мин. После чего клетки фиксировали в 4%-ном параформальдегиде. Ядра клеток докрашивали DAPI. Анализ изображений проводили на флуоресцентном инвертированном микроскопе THUNDER Imager. Для оценки морфологии полученных культур перицитов, эндотелиоцитов и астроцитов использовали фазово-контрастный микроскоп Zeiss Axiovert 40CFL и цифровую камеру Nikon D500. Моделирование ГЭБ Для моделирования ГЭБ in vitro были использованы три типа клеток, играющих ключевую роль в формировании барьера in vivo: эндотелиоциты, перициты и астроциты. Эти клетки, изолированные из головного мозга крысы, обладают наиболее полным профилем экспрессии белков-транспортеров, белков, формирующих специфические для ГЭБ плотные контакты, а также системы межклеточной коммуникации, характерные для условий in vivo [18]. В качестве базальной мембраны использовали мембранные вставки transwell (размер пор 0.4 мкм), покрытые коллагеном IV типа (0.5 мкг/см2), которые помещали в лунки 12-луночного планшета. На дно лунок, предварительно покрытых поли-L-лизином, рассаживали астроциты (3×104 клеток на лунку). Вставку transwell переворачивали и на непокрытую коллагеном поверхность рассаживали перициты (1×104 клеток на мембрану) в FBS для их лучшей адгезии к мембране. Через 40-60 мин сыворотку удаляли и вставку погружали в лунку со средой и астроцитами на дне. После чего на дно вставки, покрытое коллагеном IV типа, рассаживали эндотелиоциты (6×104 клеток на мембрану). Через 24 ч производили смену культуральной среды в обеих камерах для удаления не прикрепившихся клеток. Для одновременного культивирования трех типов клеток использовали среду на основе DMEM/F12 с добавлением 20% FBS, пенициллина-стрептомицина, фактора роста фибробластов (bFGF, 2 нг/мл), гепарина (100 мкг/мл), гидрокортизона (500 нМ). Анализ барьерных свойств модели ГЭБ проводили через 5-6 дней совместного культивирования трех типов клеток. Для этого оценивали трансэндотелиальное электрическое сопротивление (TEER) с использованием автоматизированной системы измерения TEER – CellZScope, помещенной в СО2-инкубатор. Мембраны transwell, заселенные клетками, переносили в колодца прибора, в базальную и апикальную камеры добавляли соответствующий объем культуральной среды. Измерения TEER проводили каждый час в течение 24 ч. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Как описано в предыдущем разделе, динамику роста и морфологию полученных культур клеток оценивали с использованием фазово-контрастной микроскопии. Наиболее быстро из ткани мозга (микроваскулярной фракции) выходили перициты, которые уже через 24 ч после выделения формировали колонии. Через 7 дней культивирования перициты образовывали неупорядоченный конфлюентный монослой с характерной для этих клеток удлиненной фибробласто-подобной морфологией (рис. 1 А).
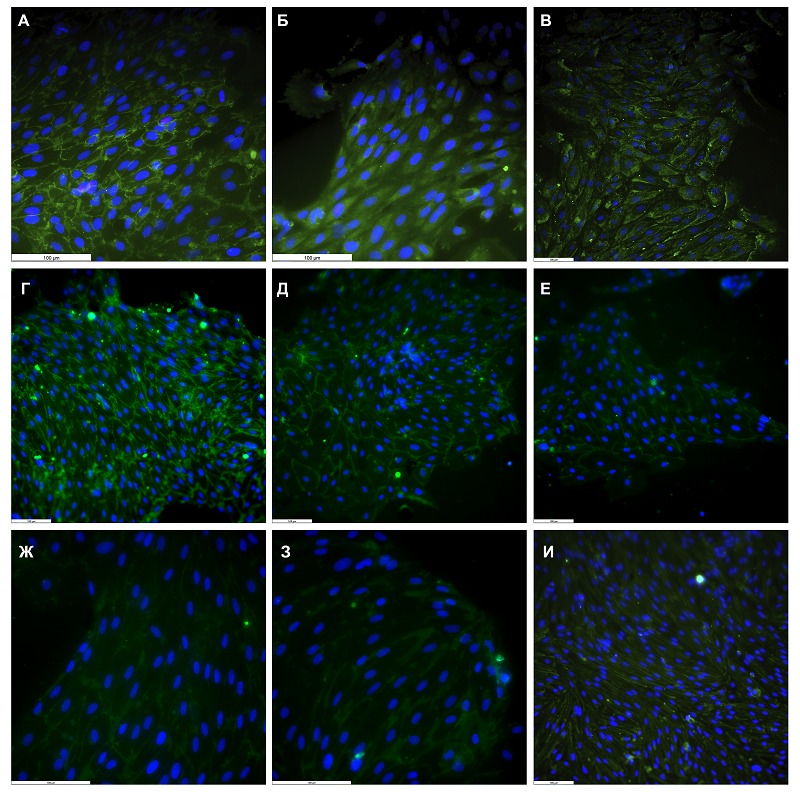
Эндотелиоциты, выделенные из микрососудов головного мозга крыс, достигали монослоя несколько медленнее по сравнению с перицитами, примерно на 10-ый день культивирования (рис. 1 Б). Полученные клетки имели характерную кубоидальную (“cobblestone”) морфологию и формировали плотные контакты с соседними клетками, что можно наблюдать на фазово-контрастных изображениях в виде отсутствия видимых границ плазматической мембраны клеток (рис. 1 Б). В течение первых трех дней после выделения в культуру эндотелиоцитов мозга добавляли пуроми. Длябольшинства клеток пуромицин является высоко токсичным. Тогда как клетки, экспрессирующие P-гликопротеин, включая эндотелиоциты, устойчивы к его токсическому действию. Таким образом, добавление пуромицина в первичную культуру эндотелиоцитов позволяет предотвратить контаминацию другими типами клеток за счет подавления их жизнеспособности. Основываясь на фазово-контрастных изображениях полученной культуры эндотелиоцитов, можно видеть, что морфологически клетки являются однородными. Использованный в работе способ выделения астроцитов из головного мозга крыс, позволил получить относительно чистую культуру клеток с характерной звездчатой морфологией и с удлиненными отростками (рис. 1В). В отличие от перицитов и эндотелиоцитов астроциты не формировали конфлюентного монослоя. Все полученные культуры клеток при соблюдении специфических условий культивирования способны претерпевать несколько пассажей (до 5) и легко переносят этапы заморозки и разморозки, сохраняя при этом свои морфологические и фенотипические особенности (данные не представлены). Необходимо отметить, что при выделении описанных типов клеток из мозга на начальных этапах крайне важно проводить тщательное удаление мозговых оболочек, а также соблюдать последовательный подход к пассированию этих клеток, чтобы избежать контаминации культур другими типами клеток. Помимо морфологических особенностей все полученные культуры клеток были охарактеризованы по экспрессии специфических для каждого типа клеток маркеров с использованием флуоресцентной микроскопии. Одним из основных маркеров перицитов считается гладкомышечный альфа-актин (αSMA). Мы показали, что практически все клетки в полученной культуре позитивно окрашивались антителами к данному маркеру (рис. 2).
Анализ экспрессии αSMA показал, что используемый в работе метод выделения перицитов из микрососудов головного мозга крысы позволяет получить практически чистую популяцию клеток с характерной морфологией и с минимальной контаминацией другими типами клеток. Одним из основных поверхностных маркеров эндотелиоцитов является гликопротеин суперсемейства иммуноглобулинов CD31 (или PECAM-1, platelet endothelial adhesion molecule). CD31 экспрессируется на ранних и зрелых сосудистых эндотелиальных клетках. Благодаря расположению CD31 на границе двух соседних эндотелиальных клеток эта молекула адгезии является частью эндотелиального межклеточного соединения, что усиливает барьерные свойства эндотелия. CD31 имеет решающее значение для трансмиграции лейкоцитов через эндотелий во время воспаления, иммунных реакций, а также ангиогенеза, активно участвуя в миграции эндотелиальных клеток, развитии клеточных соединений, формировании капилляров и созревании взаимодействий клетка-внеклеточный матрикс [19]. Иммуноцитохимический анализ показал, что CD31 экспрессируется практически на всех клетках в полученной культуре эндотелиоцитов (рис. 3А).
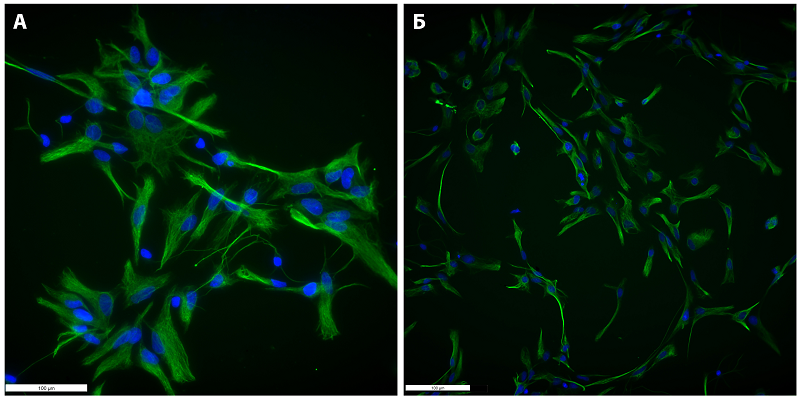
В эндотелиальном барьере молекулы CD31 формируют адгезивные контакты, тогда как, особенностью ГЭБ, отличающей его от обычного сосудистого эндотелия, является наличие плотных контактов, которые формируются за счет специфических белков, таких как клаудины, окклюдины и др. Клаудин-5 специфически локализуется в слое эндотелиальных клеток в мозге, легких [20], печени [21], почках [22] и коже [23]. Клаудин-5 осуществляет парацеллюлярную функцию уплотнения, которая обусловлена его взаимодействием с молекулами клаудина на соседних эндотелиальных клетках. Плотные контакты обеспечивают один из механизмов межклеточной адгезии, сокращая межклеточное расстояние почти до нуля. По сути, плотные контакты образуют механическую связь между отдельными эндотелиальными клетками для поддержания структурной целостности сосудистой сети и предотвращения диффузии растворенных веществ и ионов через межклеточное пространство. Результатом такой плотной адгезии является высокое электрическое сопротивление ~ 1500–2000 Ω·см2 [24, 25]. На полученной из микроваскулярной фракции мозга культуре эндотелиоцитов окклюдин продемонстрировал диффузный паттерн экспрессии (рис. 3Б) на всей поверхности плазматической мембраны клеток. Вероятно, такое нелокализованное распределение связано с условиями культивирования in vitro, когда клеткам нет необходимости формировать плотные контакты. Было показано, что монокультура эндотелиоцитов, выделенных из микрососудов мозга, на более низком уровне и в более диффузной манере экспрессирует окклюдин, чем при совместном культивировании с астроцитами [26]. Тем не менее, наши результаты демонстрируют, что в полученной культуре почти 100% клеток экспрессируют заметные уровни окклюдина. Также на высоком уровне эндотелиоциты мозга экспрессировали другие белки, участвующие в формировании плотных контактов, включая интегральные мембранные линкерные белки клаудины 5 и 1 (рис. 3 Г и Д) и цитоплазматический адаптерный белок ZO-1 (zonula occludens) (рис. 3И). Тогда как уровень экспрессии клаудинов 3, 4 и 12 был достаточно низким (рис. 3 Е, Ж, З). Молекулярная архитектура плотных контактов представляет собой сложную систему, в которой цитоплазматические адаптерные белки, такие как ZO-1, обеспечивают связывание цитоскелета с трансмембранными линкерными белками, включая окклюдины и клаудины, вследствие чего формируется плотное межклеточное взаимодействие [27]. Таким образом, мы показали, что полученные из микрососудов головного мозга крысы эндотелиальные клетки экспрессируют набор белков, необходимых для формирования плотных и адгезивных контактов. Мы продемонстрировали, что эндотелиоциты мозга экспрессируют на высоком уровне фактор фон Виллебранда (рис. 3В). Фактор фон Виллебранда представляет собой мультимерный адгезионный гликопротеин, синтезируемый и секретируемый эндотелиальными клетками [28], который участвует во многих сосудистых процессах и играет центральную роль в гемостазе и тромбозе [29]. Фактор фон Виллебранда хранится в тельцах Вайбеля-Паладе, откуда он высвобождается в плазму и базальную мембрану при активации эндотелиоцитов. Фактор фон Виллебранда, высвобождаемый вследствие стресса (гипоксия, травма и т.д.) эндотелиоцитами, формирующими ГЭБ, способствует регуляции проницаемости барьера [30]. Для оценки чистоты и подтверждения принадлежности полученных культур астроцитов к глиальным клеткам был проведен иммуноцитохимический анализ экспрессии глиального фибриллярного кислого белка (GFAP) и S100B белка, который высоко экспрессирован в астроцитах и играет роль в их пролиферации, миграции и дифференцировке [31]. Все клетки в полученных культурах экспрессировали высокий уровень обоих глиальных белков (рис. 4), тогда как не экспрессировали маркер нейральных клеток βIII-тубулин (данные не представлены), что свидетельствует об отсутствии контаминации культур астроцитов нейрональными клетками.
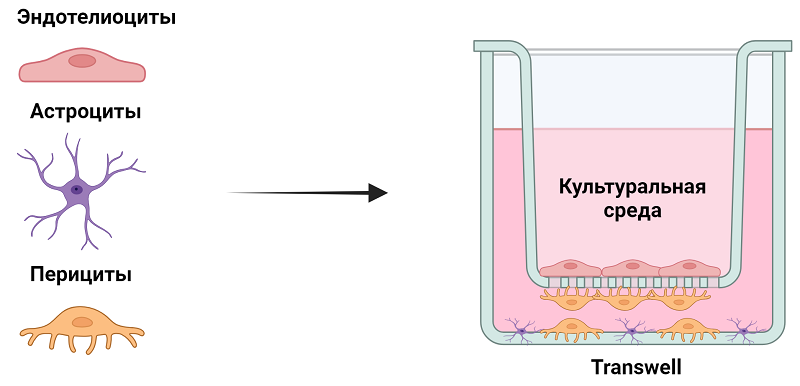
Высокий уровень экспрессии GFAP и S100В свидетельствует о наличии большого числа глиальных клеток в полученных первичных культурах. Большинство работ, использующих in vitro модели ГЭБ для различных исследований, как правило, применяют упрощенную модель в виде монослоя эндотелиальных клеток микрососудов мозга [32]. Безусловно, эндотелиальные клетки микрососудов головного мозга являются основным клеточным компонентом ГЭБ, регулирующим его проницаемость. Однако не менее важными структурными и функциональными компонентами ГЭБ являются перициты и гладкомышечные клетки, которые также определяют его целостность и проницаемость [33]. Перициты выстилают капилляры, тогда как более крупные сосуды, такие как артерии, артериолы, венулы и вены, выстланы сосудистыми гладкомышечными клетками. Оба этих типа клеток составляют муральные клетки, которые поддерживают кровеносные сосуды [34]. Функционально активным компонентом ГЭБ также являются глиальные клетки (а точнее, отростки астроцитов), которые обеспечивают наружную границу периваскулярного пространства со стороны мозговой паренхимы и выполняют функции очищения и обмена отходов центральной нервной системы, образуя так называемую «глимфатическую» систему [35]. Таким образом, наиболее приближенной к реальной структуре ГЭБ могла бы быть in vitro модель, состоящая из трех клеточных компонентов: эндотелиоцитов, перицитов и астроцитов. В представленной работе мы создали такую модель и оценили жизнеспособность клеточных компонентов и электрическое сопротивление в качестве основного показателя проницаемости клеточных слоев. Схема расположения клеточных слоев в полученной модели ГЭБ представлена на рисунке 5.
Как описано в разделе Материалы и методы, для создания модели ГЭБ использовали мембранную вставку transwell, на дно (наружная поверхность) которой высевали эндотелиоциты микрососудов мозга, внутреннюю поверхность вставки заселяли перицитами, тогда как на дно лунки помещали культуру астроцитов. При этом сама мембрана transwell служила в качестве базальной мембраны. Фактически, вследствие открепления и осаждения перицитов с внутренней поверхности вставки transwell, нижний клеточный слой на дне лунки был представлен смешанной культурой астроцитов и перицитов. Эффективность формирования клеточных монослоев на мембране transwell оценивали, используя фазово-контрастную и флуоресцентную микроскопию, а также измерение электрического сопротивления. Поскольку основную барьерную функцию в ГЭБ выполняют эндотелиоциты, важным представлялось достичь максимально плотного монослоя этих клеток на мембране. В стандартных условиях культивирования, описанных выше, эндотелиоциты эффективно адгезировались к поверхности вставки transwell (рис. 6А). Однако сформированный монослой содержал «прорехи», что приводило к низким значениям TEER менее 250 Ω cm2. Для увеличения плотности монослоя эндотелиоцитов и повышения экспрессии αSMA в перицитах в культуральную среду добавляли 500 нМ гидрокортизона. В присутствии гидрокортизона эндотелиоциты формировали более плотный монослой без прорех, имеющий направленную структуру (рис. 6Б). Показатель TEER при этом был больше 500 Ω cm2.
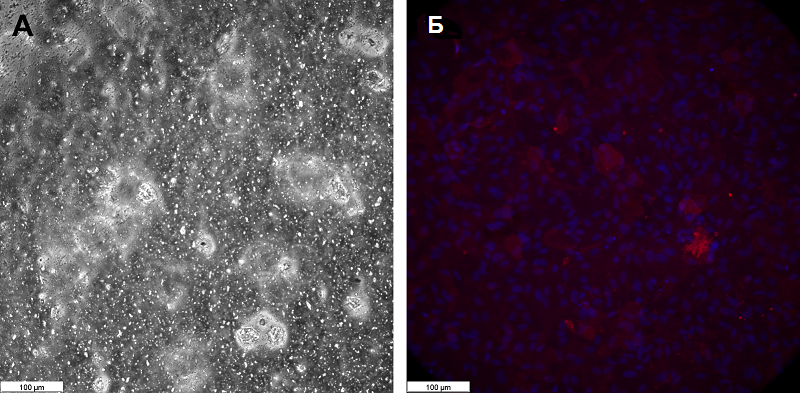
С помощью фазово-контрастной микроскопии не удалось визуализировать перициты на внутренней поверхности мембраны transwell (рис. 7А). Поэтому для оценки эффективности адгезии культуры перицитов к мембране использовали флуоресцентную микроскопию, а клетки окрашивали антителами к αSMA и DAPI (рис. 7Б).
Контрастирование клеточных ядер с помощью DAPI позволило отчетливо визуализировать наличие клеток на внутренней поверхности мембраны transwell, а позитивное окрашивание αSMA подтверждает тот факт, что клетки при таком способе культивирования сохраняют жизнеспособность. Значения TEER для такой мембраны, заселенной с двух сторон разными типами клеток, эндотелиоцитами и перицитами, не изменялись существенно по сравнению с мембраной, заселенной только эндотелиоцитами, и составили около 500 Ω cm2. Этот факт свидетельствует о том, что все-таки эндотелиоциты являются основными барьер-формирующими клетками, тогда как перициты в данном случае выполняют поддерживающую функцию. ЗАКЛЮЧЕНИЕ Полученная в работе модель ГЭБ, состоящая из трех типов клеток (эндотелиоцитов, перицитов и астроцитов), имитирует in vivo слои ГЭБ, хотя, безусловно, не лишена недостатков. В частности, астроциты, высаженные на дно лунки, не достают своими отростками до слоя перицитов, как это происходит в ситуации in vivo. Их роль в такой модели ГЭБ может заключаться только в секреции растворимых факторов и метаболическом ответе на факторы, секретируемые эндотелиоцитами и/или перицитами. С другой стороны, экспрессия целого набора белков, формирующих плотные контакты, и высокие значения TEER монослоя эндотелиоцитов, а также эффективный рост культуры перицитов на внутренней мембране transwell позволяют использовать эту модель для решения обширных задач по изучению проницаемости ГЭБ для различных субстанций, включая лекарственные препараты, наночастицы, различные типы клеток (иммунные клетки, стволовые клетки и т.д.). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Эксперименты на животных проводились в соответствии с принципами Хельсинкской декларации о гуманном отношении к животным, директиве Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, используемых для научных целей, и были одобрены Комиссией по уходу и использованию животных Российского национального исследовательского медицинского университета имени Н.И. Пирогова (код протокола № 24/2021 от 10 декабря 2021 г.). БЛАГОДАРНОСТИ Авторы выражают благодарность команде BioRender за предоставление онлайн-сервиса для создания иллюстраций (https://www.biorender.com/). ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№122022800499-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|