|
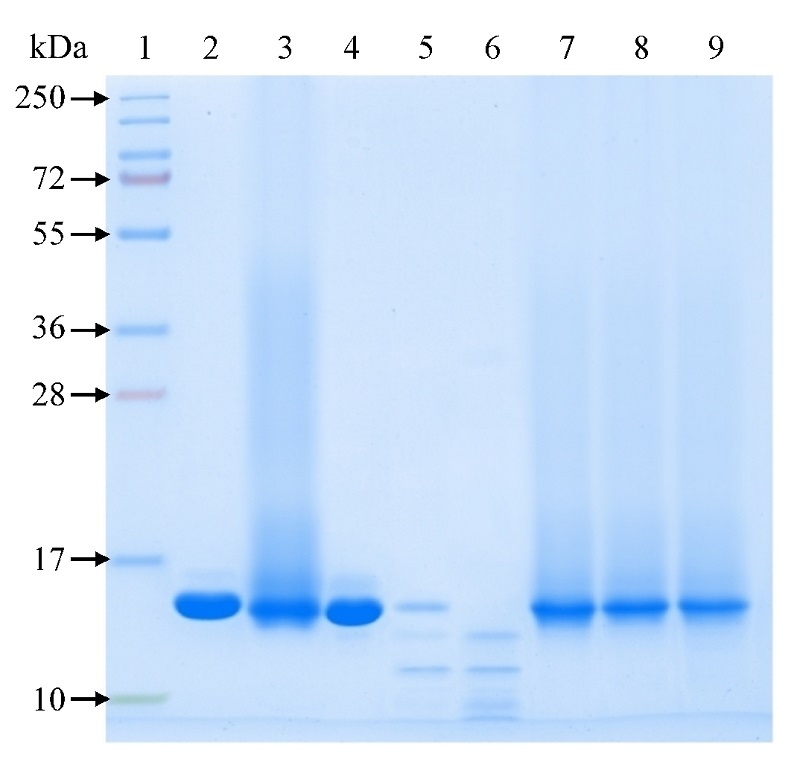
Получение и исследование свойств рекомбинантного гранулоцитарно-макрофагального колониестимулирующего фактора человека в средстве доставки Институт медицинской биотехнологии Государственного научного центра вирусологии и биотехнологии «Вектор», 633010, Новосибирская область, Бердск, ул. Химзаводская, 9; *e-mail: esina_ti@vector.nsc.ru Ключевые слова: рекомбинантный гранулоцитарно-макрофагальный колониестимулирующий фактор человека; средство доставки; полиглюкин; гемостимулирующая активность DOI: 10.18097/BMCRM00240 ВВЕДЕНИЕ Гранулоцитарно-макрофагальный колониестимулирующий фактор ГМ-КСФ) – белок-цитокин, член семейства колониестимулирующих факторов, который стимулирует рост и дифференцировку клеток-предшественников гранулоцитов и моноцитов/макрофагов, обеспечивает активацию зрелых нейтрофилов, моноцитов и эозинофилов [1]. Препараты рекомбинантного аналога ГМ-КСФ человека применяются при заболеваниях, сопровождающихся миелосупрессией: последствиях химио- и радиотерапии онкологических заболеваний, СПИД, тяжелой хронической нейтропении, а также при трансплантации костного мозгаи мобилизации клеток периферической крови для трансплантации [2-4]. Известно, что введение колониестимулирующих факторов позволяет не только восстановить в крови количество лейкоцитов и их морфологических форм, но и усилить противоинфекционные свойства клеток крови. Применение этих факторов целесообразно при вакцинации лиц с иммунологической недостаточностью, возникшей вследствие старения, хронических инфекций, перенесенных стрессов или обусловленной наследственными причинами [5]. Адъювантные свойства колониестимулирующих факторов зарегистрированы при вакцинации против вирусов гепатита В, гриппа, герпеса, ВИЧ и ряда других вирусов [5-7]. Эти данные позволяют говорить о том, что лекарственные препараты КСФ, в частности, ГМ-КСФ, могут быть использованы не только для гемостимулирующей, но и иммуномодулирующей терапии. Однако существует ряд проблем, которые ограничивают возможность широкого применения препаратов ГМ-КСФ в клинической практике. Помимо технологических проблем, связанных с низкой продуктивностью и стабильностью штаммов-продуцентов, можно выделить общую для белковых препаратов проблему недостаточной стабильности белков в биологических средах, короткий период полувыведения из биологических жидкостей. Для решения данной проблемы используются различные методические подходы, в частности, включение белков в средства доставки на основе полимерных носителей. Как было показано авторами работ [8, 9], результатом конъюгирования цитокинов, таких как гранулоцитарный колониестимулирующий фактор, эритропоэтин или интерферон альфа-2b, с дендримером полиэтиленгликоля является повышение их стабильности in vitro и in vivo. Конъюгирование рекомбинантного интерферона гамма с полимером олигосахаридной природы D3000-7 (Sa-Sp)-(Sp-M), где D3000 – диальдегид декстран, (Sa-Sp) – Neu5Ac-Lactose-N(CH)-CH(2)-CH(2)-NH(2), (Sp-M) – Малеимид-СН(2)-NH(2), приводит к стабилизации молекулы при сохранении высокого уровня противовирусной активности [10]. Интересным вариантом с точки зрения выбора полимера как средства доставки является полисахарид декстран (полиглюкин). Помимо технических преимуществ, таких как наличие функциональных групп, пригодных для получения конъюгатов, возможность выбора в зависимости от поставленной задачи длины полисахаридной цепи, полиглюкин является биологически активным соединением. В частности, описана его способность активировать клетки иммунной системы, прежде всего, макрофаги [11]. Есть данные о влиянии полисахаридов разной природы (олигосахариды, выделенные из бурых водорослей Chordaria flagelliformis [12], бета-глюканы из дрожжей Saccharomyces cerevisiae [13] и др.) на уровень экспансии клеток-предшественников и интенсивность гранулоцитопоэза. Эти данные позволяют говорить не только о возможности стабилизации структуры белка-цитокина в составе конъюгата с полиглюкином, но и о вероятности развития синергидного эффекта его компонентов. Немаловажным является также наличие в организме естественных систем метаболизма полисахаридов – факт, позволяющий предполагать, что конъюгирование не приведет к появлению у препарата токсических свойств. В Государственном научном центре вирусологии и биотехнологии «Вектор» (ГНЦ ВБ «Вектор») разработан штамм-продуцент E. сoli SG 20050/p280_2GМ, отработана опытно-промышленная технология получения рекомбинантного ГМ-КСФ человека (рчГМ-КСФ). В ходе экспериментальных исследований в культуре ГМ-КСФ-зависимых клеток линии TF-1 и на мышах с цитостатической миелосупрессией продемонстрирована гемостимулирующая активность рчГМ-КСФ и его лекарственных форм разного состава [14, 15]. Целью данной работы было получение препарата рекомбинантного ГМ-КСФ человека в средстве доставки на основе полимера полиглюкина, исследование его стабильности и биологических свойств. МЕТОДИКА Реактивы В работе были использованы: рекомбинантный ГМ-КСФ человека, субстанция, полученная в Институте медицинской биотехнологии ГНЦ ВБ «Вектор», с концентрацией 11.18 мг/мл; декстран (полиглюкин) с молекулярной массой 40 000 Да («MP Biomedicals», Франция); сефадекс G-25 («Cytiva», Швеция); маркер молекулярной массы белков PageRuler™ Plus 10-250 кДа, («Thermo Fisher Scientific», США); фенилметил-сульфонидфторид, («Gerbu», Германия); мембраны для стерилизующей фильтрации, размер пор 0.22 мкм («Corning», Бельгия). Акриламид, N, N'- метилен-бис-акриламид, 2-меркаптоэтанол, боргидрид натрия, глицин, додецилсульфат натрия, Кумасси R-250, натриевая соль этилендиаминтетрауксусной кислоты, персульфат аммония, полиэтиленгликоль 6000, D-маннит приобретены у компании «Aррlichem» (Германия); N,N,N',N'-тетраметилен-1,2-диамин, периодат натрия, трис-(оксиметил)-аминометан, циклофосфан моногидрат закуплены в компании «Sigma», США. Все остальные реактивы (альбумин человека, раствор для инфузий 20%, ЛС-002333 (НПО «Микроген»), вода для инъекций, стерильная ЛП-002529 ( «Гротеск»), пероксид водорода, кислоты, соли) были российского производства квалификацией не ниже хч. Метод получения конъюгата рчГМ-КСФ с полиглюкином Активацию декстрана (полиглюкина) с молекулярной массой 40000 Да осуществляли в водном растворе добавлением периодата натрия в соотношении 1:40 (моль декстрана /моль периодата). Реакцию проводили в течение 1 ч с последующей гель-фильтрацией для отделения непрореагировавших компонентов на сефадексе G-25 (хроматограф Akta Pure 150, «Cytiva», колонка объемом 15 мл, уравновешенная в фосфатно-солевом буфере, рН 7.4 «Gibco», Великобритания). В процессе окисления декстрана происходит формирование свободных альдегидных групп, которые вступают в реакцию с аминогруппами рчГМ-КСФ при добавлении его к активированному декстрану в соотношении 1:1 (моль декстрана /моль рчГМ-КСФ). Смесь инкубировали в течение 2 ч, оставшиеся свободными альдегидные группы восстанавливали избытком боргидрида натрия в соотношении 1:80 (моль декстрана /моль боргидрида), после чего инкубировали полученную смесь 2 ч и удаляли непрореагировавшие компоненты гель-фильтрацией на сефадексе G-25 при температуре (2-8)°С [16]. Метод получения образцов лекарственной формы Препарат лекарственной формы получали путем смешения конъюгата рчГМ-КСФ с полиглюкином и вспомогательных компонентов в ламинарном боксе с соблюдением правил асептики. В качестве препарата сравнения аналогичным образом готовили образец лекарственной формы, содержащий субстанцию рчГМ-КСФ. В стеклянный стакан объемом 50 мл с помощью автоматической пипетки вносили растворы вспомогательных веществ (30 мл), затем добавляли конъюгат рчГМ-КСФ с полиглюкином (либо рчГМ-КСФ) в количестве 400 мкл. Смесь перемешивали на магнитной мешалке в течение 5 минут при скорости вращения 250 об/мин, после чего стерильно фильтровали и разливали по 1 мл в стеклянные флаконы. Полученные образцы хранили при температуре 2-8°С. Определение концентрации белка рчГМ-КСФ в конъюгате осуществляли методом Лоури по ГФ ХIV, ОФС.1.2.3.0012.15 «Определение белка». Оценку сохранности структуры и молекулярной массы белка проводили методом электрофореза в 15% полиакриламидном геле при силе тока 25 мА в присутствии додецилсульфата натрия (ДСН-ПААГ) в восстанавливающих условиях с использованием денатурирующего раствора с 2-меркаптоэтанолом при нагрузке на лунку 10 мкг белка рчГМ-КСФ, с окрашиванием Кумасси R-250 по ГФ ХIV, том 1, ОФС.1.2.1.0023.15 «Электрофорез в полиакриламидном геле»). Метод оценки протеолитической устойчивости конъюгата рчГМ-КСФ-ПГ Для оценки устойчивости препаратов рчГМ-КСФ к действию трипсина в раствор исследуемого препарата (субстанции нативного белка или белка в составе конъюгата), содержащего белок в количестве 10 мкг, 20 мкг или 50 мкг, вносили свежеприготовленный раствор трипсина ( «Самсон Мед», Россия) в количестве 0.5 мкг, из расчета трипсин: белок – 1:20, 1:40, 1:100. Смесь инкубировали в термостате (ТС-1/80 СПУ, Смоленское СКТБ СПУ, Россия) при 37°С в течение 10 мин, реакцию останавливали раствором, содержащим додецилсульфат натрия, 2-меркаптоэтанол и бромфеноловый синий в 20%-ом растворе глицерина. После прогревания (5 мин при 90°С) продукты реакции анализировали электрофорезом в 15% ПААГ. Метод определения гемостимулирующей активности препаратов рчГМ-КСФ Гемостимулирующую активность препаратов оценивали на модели метастатической миелосупрессии мышей, вызванной введением циклофосфана. В экспериментах использовали самцов мышей линии СВА возрастом 2.5-3 месяца, с массой тела 19-24 г, полученных из питомника ГНЦ ВБ «Вектор» (р.п. Кольцово, Новосибирской области). До эксперимента и в ходе исследования животных содержали в стандартных условиях вивария при естественном освещении на сбалансированном пищевом рационе. Мышам всех экспериментальных групп однократно внутрибрюшинно вводили циклофосфан (ЦФ) в максимально переносимой дозе (250 мг/кг) в объеме 0.25 мл на 20 г массы тела. Через сутки после введения ЦФ животным опытных групп начинали курс подкожных инъекций препаратов лекарственной формы (ЛФ) конъюгата рчГМ-КСФ либо рчГМ-КСФ, которые вводили в дозе 90 мкг белка/кг массы тела 1 раз в день в течение 4 суток. Доза и схема введения были определены как эффективные в предварительных экспериментах. Мыши контрольной группы получали подкожно физиологический раствор по той же схеме, что и опытные; интактные мыши – без введения препаратов. Через сутки после окончания курса инъекций препаратов (5 сутки после первого введения ЦФ) у животных всех групп забирали на анализ образцы крови из кончика хвоста, а после эвтаназии мгновенной дислокацией шейных позвонков – образцы костного мозга. В образцах крови методом световой микроскопии (микроскоп МИКМЕД-6, «ЛОМО», Россия) определяли общее количество лейкоцитов (кровь разводили в 20 раз 3% раствором (масса/объем) уксусной кислоты, считали в камере Горяева), относительное и абсолютное содержание нейтрофилов и других морфологических форм лейкоцитов. В образцах костного мозга подсчитывали общее количество кариоцитов (ОКК), рассчитывали количество клеток на бедро. Для получения костного мозга выделяли бедренную кость мыши, очищали ее от мягких тканей бедра и тщательно промывали костномозговой канал 3%-ным раствором уксусной кислоты в объеме 1 мл. Подсчет ОКК осуществляли с помощью камеры Горяева. Данные эксперимента обрабатывали методами вариационной статистики с помощью пакета программ Statgraphics V5.0 («Statistical Graphics Corp.», США). Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую и стандартную ошибку. Для оценки значимости межгрупповых различий применяли непараметрические критерии – H-критерий множественных сравнений Краскела-Уоллиса и двухвыборочный U-критерий Манна-Уитни с критическим уровнем статистической значимости р=0.0170. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ На рисунке 1 представлена электрофореграмма препарата рчГМ-КСФ и его конъюгата с полиглюкином после гидролиза трипсином. В эксперименте использовали разные соотношения фермента и препаратов рчГМ-КСФ (1:20, 1:40 и 1:100). Как показал анализ, образцы нативного белка подвергались практически полному гидролизу после инкубации в течение 10 мин с трипсином при соотношениях белок:трипсин 40:1 и 20:1. Препарат конъюгата рчГМ-КСФ с полиглюкином в этих условиях был устойчив к ферментативному воздействию.
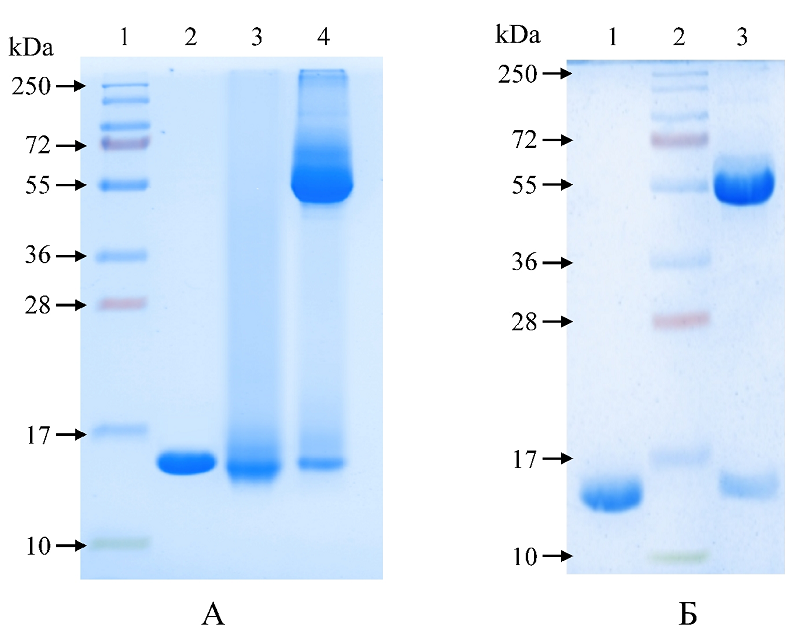
Таким образом, конъюгирование рчГМ-КСФ с полиглюкином позволило снизить чувствительность белка к трипсинолизу в сравнении с показателями исходного белка. Полученные данные подтверждают тот факт, что конъюгирование рчГМ-КСФ с молекулой полимера способно приводить к получению более стабильных вариантов, отличающихся повышенной устойчивостью к ферментативному разрушению. Можно предположить, что это связано с нарушением пространственной доступности для фермента сайтов протеолиза белковой молекулы. Очевидно, что при этом существует опасность экранирования полимером, помимо протеолитических, активных центров молекулы белка, ответственных за связывание с рецептором, и, как следствие, снижение его биологической активности. Для выяснения данного вопроса было проведено изучение гемостимулирующей активности рчГМ-КСФ в составе конъюгата в сравнении с исходным белком. Учитывая относительно низкую активность субстанции рчГМ-КСФ в экспериментах in vivo, исследования были проведены на его лекарственной форме, содержащей, помимо активного компонента, вспомогательные вещества. Как было показано нами ранее при сравнении лекарственных форм рчГМ-КСФ с разными вспомогательными веществами [15], наибольшей активностью на модели цитостатической миелосупрессии мышей отличались лекарственные препараты двух составов, один из которых был выбран для данного исследования. Лекарственная форма в качестве вспомогательных веществ содержала Д-маннит, человеческий альбумин и полиэтиленгликоль 6000. Сывороточный альбумин человека в лекарственных формах используется в качестве транспортной молекулы, полиэтиленгликоль – для обеспечения преодоления биологических барьеров и усиления адгезии белка к слизистым, Д-маннит – в качестве наполнителя и стабилизатора. Были получены образцы двух типов лекарственных форм описанного состава, содержащие рчГМ-КСФ в составе конъюгата либо в виде свободного белка. Электрофоретический анализ образцов подтвердил, что рчГМ-КСФ как в конъюгированном, так и свободном виде сохранял свои структурные характеристики в лекарственной форме. На электрофореграмме видно, что в обоих исследованных образцах содержался рчГМ-КСФ (молекулярная масса в этих условиях (15350±500) Да), а также альбумин с молекулярной массой (55000±500) кДа, который был использован в качестве вспомогательного вещества (рис.2).
Результаты оценки влияния препаратов рчГМ-КСФ разного состава на показатели периферической крови представлены в таблице 1.
Как видно из представленных данных, субстанция рчГМ-КСФ приводила к повышению на 5 сутки эксперимента количества сегментоядерных нейтрофилов в периферической крови мышей по сравнению с контролем (ЦФ+физиологический раствор), при этом значения показателя в разных экспериментах варьировали в пределах от 125% до 250%. Число сегментоядерных нейтрофилов крови мышей в группе, которой вводили лекарственную форму рчГМ-КСФ, превышало показатели группы с введением субстанции рчГМ-КСФ на 40% (0.28±0.09 109/л и 0.20±0.04 109/л соответственно, табл.1). Введение лекарственной формы конъюгата рчГМ-КСФ приводило к увеличению показателя до 0.36±0.06 109/л, что в 3 раза превышало показатель контроля и в 2.4 раза – его значения в группе мышей после введения субстанции рчГМ-КСФ (табл.1). Похожие тенденции были обнаружены в ходе оценки влияния препаратов рчГМ-КСФ на клеточность костного мозга мышей, подвергнутых воздействию цитостатика. Если в группах, подвергнутых воздействию рчГМ-КСФ или его лекарственной формы, общее количество кариоцитов в данный временной период повышалось умеренно (на 19-43% по сравнению с контрольным уровнем), то введение лекарственной формы конъюгата рчГМ-КСФ вызывало выраженное увеличение клеточности костного мозга. Общее число кариоцитов в этой группе возрастало в 1.4 раза по сравнению с контролем (различия статистически значимы, р≤0.05) (табл.2).
Иными словами, лекарственная форма, содержащая конъюгат рчГМ-КСФ с полиглюкином, не только не утрачивала гемостимулирующей активности, но и демонстрировала более выраженный эффект в отношении процессов активации миелопоэза костного мозга. Вопрос о механизмах усиления биологического эффекта колониестимулирующего фактора под действием полисахарида требует отдельного изучения. На наш взгляд, возможно несколько причин эффекта стимуляции. Прежде всего, это может быть связано с повышенной стабильностью белка в кровяном русле и, как результат, более длительным воздействием на костномозговые клетки-предшественники. Кроме того, возможен аддитивный либо синергичный эффект полисахарида и ГМ-КСФ. В настоящее время накоплены многочисленные данные о том, что полисахариды разной природы способны усиливать гемопоэтические процессы в костном мозге и периферической крови на фоне цитостатической миелосупрессии за счет повышения мобилизации клеток-предшественников, их пролиферации и дифференцировки [12, 17], а также усиления продукции цитокинов, участвующих в регуляции гемопоэза, в частности, гранулоцитарно-макрофагального колониестимулирующего фактора [13, 18]. Повышенная активация гемопоэтических процессов отмечена в случае совместного применения препаратов полисахаридов, таких как бета-глюканы, Г-КСФ [17], а также конъюгатов Г-КСФ с производными природных полисахаридов, такими как гепарин [19]. И наконец, одной из причин может являться влияние на углеводный обмен, что было описано, например, для бета-глюканов [13], то есть, энергетическая «подпитка» процессов пролиферации и дифференцировки клеток-предшественников, прежде всего, гранулоцитарного ряда. ЗАКЛЮЧЕНИЕ Таким образом, получены образцы конъюгата рекомбинантного гранулоцитарно-макрофагального колониестимулирующего фактора человека с полисахаридом полиглюкином. Показано, что конъюгат рчГМ-КСФ в составе лекарственной формы отличался повышенной стабильностью к воздействию трипсина и более выраженной способностью усиливать гемопоэз, что проявлялось в ускоренном восстановлении клеточности костного мозга и числа нейтрофилов периферической крови мышей в условиях цитостатической миелосупрессии. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Содержание мышей и эксперименты на них осуществляли в соответствии с российскими и международными требованиями по гуманному содержанию и использованию животных в экспериментальных исследованиях (Директива 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях). БЛАГОДАРНОСТИ Авторы благодарят инженера отдела качества Н.Г. Мотовилову за оказанную помощь в проведении анализов рекомбинантного ГМ-КСФ и его конъюгата. ФИНАНСИРОВАНИЕ Исследование проведено в рамках выполнения государственного задания ГНЦ ВБ «Вектор» Роспотребнадзора, тема ГЗ-39/21. ЛИТЕРАТУРА
|