|
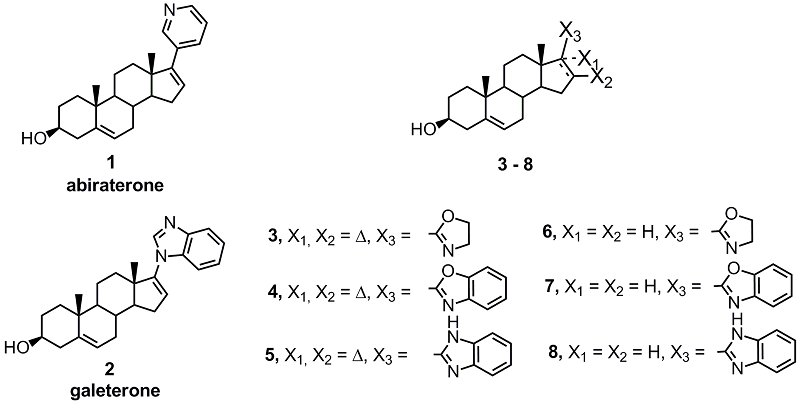
Новые азотсодержащие производные андростана, подавляющие пролиферацию клеток карциномы простаты 1Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: азотсодержащие стероидные производные; клетки карциномы простаты; ингибиторы СYP17А1; синтез производных стероидов; антипролиферативная активность; молекулярный докинг DOI: 10.18097/BMCRM00241 ВВЕДЕНИЕ Многие синтетические стероидные производные привлекают внимание исследователей в качестве потенциальных препаратов для терапии гормон-зависимых онкологических заболеваний, в первую очередь рака предстательной железы (РПЖ). Производные андростана, содержащие в положении 17 азотсодержащий гетероцикл (3-пиридил-, 2-пиридил, 4-пиридил-, 1-пиразолил-, 1-имидазолил-, 1,2,3-триазол-1-ил-, 1,2,3-триазол-2-ил-, 1,2,4-триазол-1-ил-, 1Н-бензимидазол-1-ил-) способны подавлять активность ключевого фермента биосинтеза андрогенов – 17α-гидроксилазы-17/20-лиазы (CYP17A1) и андрогенового рецептора, а также пролиферацию клеток карциномы простаты [1-6]. Два соединения этого ряда – андроста-5,16-диен-17-(3-пиридил)-3b-ол (абиратерон) 1 и андроста-5,16-диен-гидрокси-17-(1Н-бензимидазол-1-ил)-3b-ол (галетерон, известный также как VN/124-1 и TOK-001) 2 – обладают высоким фармакологическим потенциалом [7-9]. Абиратерон (1) рекомендован в качестве препарата для лечения поздних стадий РПЖ; галетерон (2) охарактеризован как комплексный противораковый препарат, обладающий тремя активностями – ингибитора CYP17A1, антагониста рецептора андрогенов и агента, ускоряющего его протеосомную деградацию. В настоящее время разработаны схемы синтеза различных гибридных молекул, объединяющих в своей структуре стероидный фрагмент и азотсодержащий гетероцикл; получено множество биологически активных азотсодержащих стероидных производных [6, 10-20]. Работы в этой области являются современным научным трендом и активно ведутся во многих научных коллективах, в том числе и в нашей группе. В данной работе мы синтезировали небольшую серию новых азотсодержащих производных андростана 3–8 (рис. 1), построили молекулярные модели связывания этих соединений в активном центре CYP17A1 и провели первичный скрининг их антипролиферативной активности в клетках карциномы простаты.
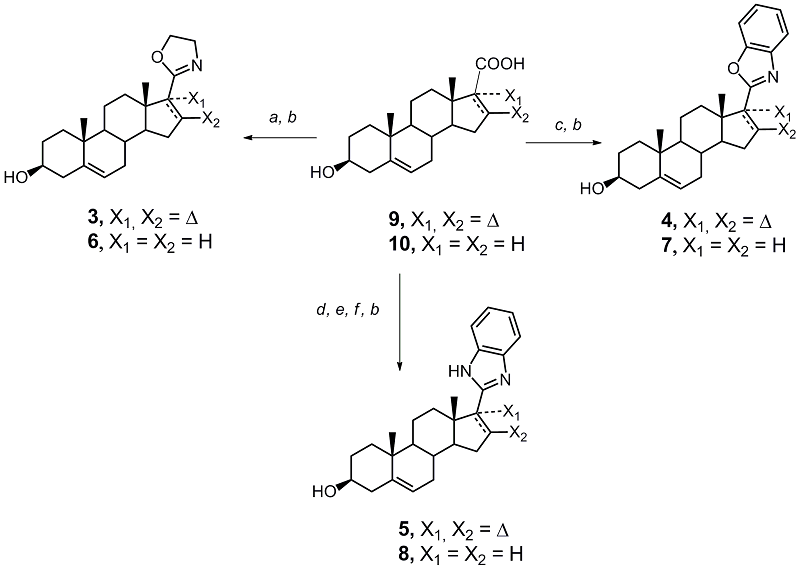
Стероидный фрагмент соединений 3–5 (3β-гидроксиандроста-5,16-диен-17-ил) идентичен таковому в структуре абиратерона и галетерона, стероидный фрагмент соединений 6–8 представляет собой его 16-насыщенный аналог. В качестве азотсодержащих гетероциклов были выбраны: оксазолин-2-ил (в соединениях 3 и 6), бензоксазол-2-ил (в соединениях 4 и 7) и бензимидазол-2-ил (в соединениях 5 и 8). Ранее мы разработали удобный синтез этих гетероциклов исходя из соответствующих карбоновых кислот, а также показали, что производные 17(20)-21-норпрегнена, модифицированные этими гетероциклами, обладают высокой антипролиферативной активностью [21-24]. Полученные в данной работе результаты свидетельствуют, что соединения 3 и 5 способны взаимодействовать с CYP17A1, подавляют пролиферацию андроген-зависимых и андроген-независимых клеток карциномы простаты значительно более эффективно, нежели абиратерон и галетерон, что позволяет рассматривать их в качестве перспективных кандидатов для разработки новых противораковых препаратов. МАТЕРИАЛЫ И МЕТОДЫ Абиратерон (1) был получен от компании «ChemLeader Ltd» (Китай) галетерон (2) – от компании «Selleck» (США), 3β-ацетоксиандроста-5,16-диен-17-карбоновая кислота 9 была синтезирована по методу [4], 3β-ацетоксиандрост-5-ен-17β-карбоновая кислота 10 – по методу [25]; химические реактивы были получены от «Merck», «Aldrich» (США), «Acros» и «МедХимЛаб» (Россия); растворители были очищены стандартными методами. Синтез оксазолинов 3 и 6 Суспензию пиридиниевой соли 3β-ацетоксиандроста-5,16-диен-17-карбоновой или 3β-ацетоксиандрост-5-ен-17β-карбоновой кислоты (1.0 ммоль) и трифенилфосфина (996 мг, 3.8 ммоль) в 10 мл абсолютного ацетонитрила охлаждали до 2oC при постоянном перемешивании. Далее в течение 10 мин по каплям прибавляли смесь CCl4 (0.97 мл, 10 ммоль) и абсолютного ацетонитрила (5 мл) и смесь продолжали перемешивать при 2oC до полного растворения осадка (≈90 мин). К полученному раствору при 2oC в течение 10 мин по каплям прибавляли смесь этаноламина (80 мкл, 1.3 ммоль), триэтиламина (557 мкл, 4.0 ммоль) и абсолютного ацетонитрила (5 мл), смесь перемешивали при 2oC в течение 10 мин. Охлаждение снимали и смесь продолжали перемешивать при амбиентной температуре ещё 2 ч. Раствор концентрировали до объёма 5 мл и разбавляли бензолом (30 мл). Полученный раствор промывали насыщенным раствором K2CO3 (10 мл), насыщенным раствором NaCl (20 мл), сушили над Na2SO4 и упаривали. Остаток растворяли в кипящей смеси 9 мл толуола и 12 мл гексана. Далее раствор выдерживали 2 ч при комнатной температуре, отделяли выпавший кристаллический осадок трифенилфосфиноксида, фильтрат упаривали, остаток очищали при помощи флэш-хроматографии на силикагеле в системе гексан-ацетон (2 : 1). Фракцию, содержащую ацетилированный оксазолин, упаривали досуха, остаток растворяли в метаноле (5 мл), к раствору добавляли воду (3 мл) и K2CO3 (1.0 г), смесь кипятили при перемешивании в течение 40 мин. После охлаждения к остатку добавляли хлороформ (20 мл) и воду (5 мл). Водный слой экстрагировали хлороформом (15 мл). Объединённый хлороформный экстракт промывали насыщенным раствором NaCl (20 мл), сушили над Na2SO4, упаривали, очищали при помощи флэш-хроматографии на силикагеле в системе гексан-ацетон (3 : 2) и кристаллизовали из метанола. 2’-(3β-гидроксиандроста-5,16-диен-17-ил)-4’,5’-дигидро-1’,3’-оксазол 3 (185 мг, 0.54 ммоль, 54%); белые иглы с т. пл. 165oC; МСВР, рассчитано для [C22H32NO2]+: 342.2428, найдено: 342.2419; 1H ЯМР (CD3OD): 0.99 (3H, с, H-18); 1.09 (3H, с, H-19); 3.42 (1H, м, H-3); 3.89 и 4.25 (каждый 2H, м, CH2-оксазолин); 5.38 (1H, м, H-6); 6.54 (1H, дд, J = 2.0 Гц, J = 3.2 Гц H-16); 13C ЯМР (CD3OD): 14.9 (C-18); 18.4 (C-19); 20.5 (C-11); 30.4 (C-8); 30.9 (C-2); 31.2 (C-7); 31.4 (C-15); 34.8 (C-12); 36.5 (C-10); 37.1 (C-1); 41.7 (C-4); 46.1 (C-13); 50.8 (C-9); 53.9 (C-5’); 57.0 (C-14); 66.0 (C-4’); 71.0 (C-3); 120.6 (C-6); 138.8 (C-16); 141.4 (C-5); 143.0 (C-17); 162.8 (C-2’). 2’-(3β-гидроксиандрост-5-ен-17β-ил)-4’,5’-дигидро-1’,3’-оксазол 6 (151 мг, 0.44 ммоль, 44%); белые иглы с т. пл. 181oC; МСВР, рассчитано для [C22H34NO2]+: 344.2584, найдено: 344.2569; 1H ЯМР (CD3OD): 0.72 (3H, с, H-18); 1.05 (3H, с, H-19); 3.42 (1H, м, H-3); 3.78 и 4.28 (каждый 2H, м, CH2-оксазолин); 5.36 (1H, м, H-6); 13C ЯМР (CD3OD): 12.1 (C-18); 18.4 (C-19); 20.7 (C-11); 24.1 (×2) (C-15, C-16); 30.9 (C-2); 31.5 (C-7); 32.1 (C-8); 36.4 (C-10); 37.2 (C-1); 38.0 (C-1); 41.7 (C-4); 43.7 (C-13); 49.5 (C-17); 50.4 (C-9); 52.9 (C-5’); 56.0 (C-14); 66.9 (C-4’); 71.0 (C-3); 120.7 (C-6); 141.1 (C-5); 170.7 (C-2’). Синтез бензоксазолов 4 и 7 Смесь 3β-ацетоксиандроста-5,16-диен-17-карбоновой или 3β-ацетоксиандрост-5-ен-17β-карбоновой кислоты (1.0 ммоль), трифенилфосфина (996 мг, 3.8 ммоль), абсолютного пиридина (6 мл) и абсолютного ацетонитрила (6 мл) при постоянном перемешивании охлаждали до 2oC. Далее в течение 10 мин по каплям прибавляли смесь CCl4 (0.97 мл, 10 ммоль) и абсолютного ацетонитрила (2 мл) и продолжали перемешивать при 2oC в течение 90 мин. К полученному раствору при 2oC в течение 10 мин по каплям прибавляли смесь о-аминофенола (142 мг, 1.3 ммоль), абсолютного пиридина (0.4 мл, 5 ммоль) и абсолютного ацетонитрила (5 мл). Смесь перемешивали при 2oC в течение 10 мин, затем прибавляли трифенилфосфин (512 мг, 2.0 ммоль) и перемешивали при 50оС в течение 3 ч. Затем смесь концентрировали до объёма 5 мл и разбавляли бензолом (50 мл). Полученный раствор промывали насыщенным раствором K2CO3 (10 мл), насыщенным раствором NaCl (20 мл), сушили над Na2SO4 и упаривали. Остаток растворяли в кипящей смеси 9 мл толуола и 12 мл гексана. Раствор выдерживали 2 ч при комнатной температуре, отделяли выпавший кристаллический осадок трифенилфосфиноксида, фильтрат упаривали, остаток очищали при помощи флэш-хроматографии на силикагеле в системе гексан-ацетон (2 : 1). Фракцию, содержащую ацетилированный бензоксазол, упаривали досуха, остаток растворяли в метаноле (5 мл), к раствору добавляли воду (3 мл) и K2CO3 (1.0 г). Смесь кипятили при перемешивании в течение 40 мин, после охлажения к остатку добавляли хлороформ (20 мл) и воду (5 мл), водный слой экстрагировали смесью хлороформ-метанол (2 : 1, 15 мл); объединённый хлороформный экстракт промывали насыщенным раствором NaCl (20 мл), сушили над Na2SO4, упаривали, очищали при помощи флэш-хроматографии на силикагеле в системе гексан-ацетон (3 : 2) и кристаллизовали из метанола. 2’-(3β-гидроксиандроста-5,16-диен-17-ил)-бензоксазол 4 (156 мг, 0.4 ммоль, 40%); светло-бежевые иглы с т. пл. 173oC; МСВР, рассчитано для [C26H32NO2]+: 390.2428, найдено: 390.2422; 1H ЯМР (CD3OD): 1.12 и 1.13 (каждый 3H, с, H-18, H-19); 3.43 (1H, м, H-3); 5.39 (1H, м, H-6); 6.91 (1H, дд, J = 2.0 Гц, J = 3.3 Гц); 7.34 (2H, м, арил); 7.50-7.75 (2H, м, арил); 13C ЯМР (CD3OD): 15.1 (C-19); 18.4 (C-18); 20.6 (C-11); 30.4 (C-8); 31.0 (C-2); 31.2 (C-7); 31.9 (C-15); 34.9 (C-12); 36.4 (C-10); 37.1 (C-1); 41.7 (C-4); 46.6 (C-13); 50.8 (C-9); 57.0 (C-14); 71.0 (C-3); 109.9 (C-5’); 119.2 (C-8’); 120.5 (C-6); 124.5 (C-6’); 124.9 (C-7’); 138.8 (C-16); 141.5 (×2) (C-5, C-4’); 142.4 (C-17); 149.9 (C-9’); 168.0 (C-2’). 2’-(3β-гидроксиандрост-5-ен-17β-ил)-бензоксазол 7 (166 мг, 0.42 ммоль, 42%); молочно белые иглы с т. пл. 215oC; МСВР, рассчитано для [C26H34NO2]+: 392.2584, найдено: 392.2577; 1H ЯМР (CD3OD): 0.66 (3H, с, H-18); 1.05 (3H, с, H-19); 3.03 (1H, м, H-17); 3.44 (1H, м, H-3); 5.39 (1H, м, H-6); 7.35 (2H, м, арил); 7.50-7.75 (2H, м, арил); 13C ЯМР (CD3OD): 12.4 (C-18); 18.4 (C-19); 20.7 (C-11); 24.2 (C-15); 24.5 (C-16); 31.0 (C-2); 31.5 (C-7), 32.2 (C-8); 36.4 (C-10); 37.2 (C-1); 37.9 (C-12); 41.7 (C-4); 45.2 (C-13); 50.2 (C-17); 50.4 (C-9); 56.1 (C-14); 71.0 (C-3); 109.9 (C-5’); 118.6 (C-8’); 120.7 (C-6); 124.0 (C-6’); 124.5 (C-7’); 140.5 (C-4’); 141.1 (C-5); 150.7 (C-9’); 168.6 (C-2’). Синтез бензимидазолов 5 и 8 3β-Ацетоксиандроста-5,16-диен-17-карбоновую или 3β-ацетоксиандрост-5-ен-17β-карбоновую кислоту (1 ммоль) высушивали упариванием с абсолютным толуолом, к остатку добавляли абсолютный толуол (5 мл). Смесь охлаждали до 2oC, и при перемешивании по каплям прибавляли раствор оксалилхлорида (0.5 мл, 6.0 ммоль) в абсолютном толуоле (5 мл). Смесь перемешивали 10 мин при 2oC, полученный раствор выдерживали 2 ч при комнатной температуре, упаривали досуха, остаток трижды переупаривали с абсолютным толуолом, и растворяли в 5 мл абсолютного толуола. Полученный раствор по каплям добавляли к перемешиваемому раствору o-фенилендиамина (152 мг, 1.4 ммоль) и триэтиламина (0.16 мл, 2.0 ммоль) в 3 мл абсолютного дихлорметана при 2oC. Смесь перемешивали 1 ч при комнатной температуре, упаривали; к остатку добавляли хлороформ (20 мл) и насыщенный раствор NaHCO3 (10 мл). Хлороформный экстракт последовательно промывали водой (10 мл), 1% HCl (2× 10 мл), насыщенным раствором NaCl (2× 5 мл), сушили над Na2SO4 и упаривали. Полученный в виде сухой жёлтой пены 3β-ацетокси-17-(2-аминофенилкарбамоил)-андроста-5,16-диен растворяли в 8 мл абсолютного толуола, раствор переносили в круглодонную колбу объёмом 50 мл и добавляли 100 мг кислой Al2O3. Смесь упаривали досуха. Колбу, содержащую остаток в виде твёрдой плёнки, помещали в микроволновую печь и проводили облучение при 700 W в течение 8 мин. К остатку добавляли хлороформ (5 мл), триэтиламин (0.1 мл) и силикагель (1.5 г); смесь упаривали досуха, и остаток наслаивали на сухой силикагель, помещённый в короткую хроматографическую колонку. Фракцию, содержащую ацетилированный бензимидазол, элюировали смесью гексан-ацетон (2 : 1) упаривали досуха, остаток растворяли в метаноле (5 мл). К раствору добавляли воду (3 мл) и K2CO3 (1.0 г). Смесь кипятили при перемешивании в течение 40 мин. После охлажения к остатку добавляли хлороформ (20 мл) и воду (5 мл). Водный слой экстрагировали смесью хлороформ-метанол (2 : 1, 15 мл). Объединённый хлороформный экстракт промывали насыщенным раствором NaCl (20 мл), сушили над Na2SO4, упаривали, очищали при помощи флэш-хроматографии на силикагеле в системе гексан-ацетон (3 : 2) и кристаллизовали из метанола. 2’-(3β-гидроксиандроста-5,16-диен-17-ил)-(1H)-бензимидазол 5 (260 мг, 0.67 ммоль, 67%); светло-бежевые пластинки с т. пл. 190оC; МСВР, рассчитано для [C26H33N2O]+: 389.2587, найдено: 389.2577; 1H ЯМР (CD3OD): 1.13 (3H, с, H-18); 1.18 (3H, с, H-19); 3.45 (1H, м, H-3); 5.40 (1H, м, H-6); 6.59 (1H, дд, J = 1.9 Гц, J = 3.3 Гц, H-16); 7.21 и 7.35 (каждый 2H, м, арил); 13C ЯМР (CD3OD): 15.2 (C-18); 18.4 (C-19); 20.6 (C-11); 30.4 (C-8); 31.0 (C-2); 31.3 (C-7); 31.6 (C-15); 34.9 (C-12); 36.6 (C-10); 37.1 (C-1); 41.7 (C-4); 46.7 (C-13); 50.9 (C-9); 57.4 (C-14); 71.1 (C-3); 114.3 (×2) (C-5’, C-8’); 120.6 (C-6); 122.0 (×2) (C-6’, C-7’); 133.6 (C-16); 141.4 (C-5); 145.3 (C-17), 149.3 (×2) (C-4’, C-9’); 159.2 (C-2’). 2’-(3β-гидроксиандрост-5-ен-17β-ил)-(1H)-бензимидазол 8 (250 мг, 0.64 ммоль, 64%); молочно-белые пластинки с т. пл. 210оC. МСВР, рассчитано для [C26H35N2O]+: 391.2744, найдено: 391.2741; 1H ЯМР (CD3OD): 0.65 (3H, с, H-18); 1.04 (3H, с, H-19); 2.98 (1H, т, J = 9.9 Гц, H-17) 3.44 (1H, м, H-3); 5.38 (1H, м, H-6); 7.19 и 7.52 (каждый 2H, м, арил); 13C ЯМР (CD3OD): 12.4 (C-18); 18.4 (C-19); 20.7 (C-11); 24.2 (C-15); 25.0 (C-16); 30.9 (C-2); 31.6 (C-7); 32.3 (C-8); 36.4 (C-10); 37.2 (C-1); 37.7 (C-12); 41.7 (C-4); 44.9 (C-13); 50.5 (C-9); 50.8 (C-17); 56.2 (C-14); 71.1 (C-3); 113.9 (×2) (C-5’, C-8’); 120.8 (C-6); 121.7 (×2) (C-6’, C-7’); 137.9 (×2) (C-4’, C-9’); 141.1 (C-5); 155.4 (C-2’). 1H-ЯМР и 13C-ЯМР спектры регистрировали на приборе Avance III (300 МГц, «Bruker», Германия) в CDCl3 или CD3OD; значения d CHCl3 в спектрах 1Н-ЯМР и 13С-ЯМР: 7.25 и 77.16 соответственно. Масс-спектры высокого разрешения (МСВР) регистрировали на приборе Apex Ultra FT ICR MS («Bruker») в режиме ионизации электроспреем. Температуру плавления кристаллических соединений определяли в стеклянном капилляре. Флэш-хроматографию проводили на силикагеле G (0.060–0.200 мм, «Acros», Бельгия) и силикагеле G (0.015–0.040 мм, «Merck», Германия) в стеклянных колонках при атмосферном давлении; аналитическую ТСХ проводили на пластинках UV254-HPTLC silica gel plates («Merck»). Визуализацию веществ на хроматограммах проводили в УФ свете (254 нм) и/или опрыскиванием 2.5% раствором (NH4)2Mo2O7 в 5% водном растворе серной кислоты с последующим нагреванием. Докинг соединений 3–8 в активный центр CYP17A1 Для построения моделей взаимодействия соединений 3–8 с цитохромом СYP17A1 была использована структура комплекса человеческого CYP17A1 с абиратероном, полученная из PDB (id – 3RUK). Структуры соединений 3–8 строили в программе SYBYL 8.1 («Tripos Inc.», США). Структуры низкомолекулярных соединений и белка оптимизировали методом минимизации энергии по методу Пауэлла с использованием силового поля Tripos в вакууме. Парциальные атомные заряды белка и исследуемых лигандов рассчитывали методом Гастайгера-Хюккеля. Докинг проводили с использованием программы Autodock Vina [26]. Межмолекулярные взаимодействия между белком и лигандами определяли с помощью PLIP сервера [27]. Влияние соединений 3–8 на пролиферацию клеток LNCaP и PC-3 Клетки LNCaP и PC-3 («АТСС», США) культивировали в среде RPMI 1640, содержащей 10% сыворотку теленка (FCS; «Gibco», США), и 1% смесь пенициллина и стрептомицина («Gibco») в атмосфере 5% CO2 при 37°C в течение 24 ч. Для эксперимента клетки пересаживали в 96-ячеечные планшеты с плотностью 2×104 клеток на ячейку, культивировали 48 ч и затем инкубировали с исследуемыми соединениями в течение 96 ч. После инкубации к клеткам прибавляли раствор 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (MTT, 5 мг/мл), инкубировали 4 ч, после чего определяли поглощение при 570 нм на приборе SpectraMax 190 Microplate Reader («Molecular Bioproducts», США) [28]. Жизнеспособность клеток, выражали в процентах от контроля. Каждый эксперимент проводили в трёх повторах и независимо повторяли не менее четырёх раз. Значения GI50 (growth inhibition 50%) для исследуемых соединений рассчитывали по уравнению Хилла с использованием программы SPSS 21 в диапазоне концентраций от 10 до 40 мкМ. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Схема синтеза соединений 3–8 представлена на рисунке 2. 3β-Aцетоксиандроста-5,16-диен-17-карбоновая кислота 9 и 3β-ацетоксиандрост-5-ен-17β-карбоновая кислота 10 были превращены в оксазолины 3 и 6, а также в бензоксазолы 4 и 7 методами, разработанным нами ранее [21, 24]. Для получения бензимидазолов 5 и 8 кислоты 9 и 10 сначала превращали в соответствующие хлорангидриды реакцией с оксалилхлоридом, затем добавляли о-фенилендиамин; полученные амиды без выделения подвергали микроволновому облучению в присутствии Al2O3, что приводило к циклизации; удаление ацетатной защитной группы приводило к целевым продуктам.
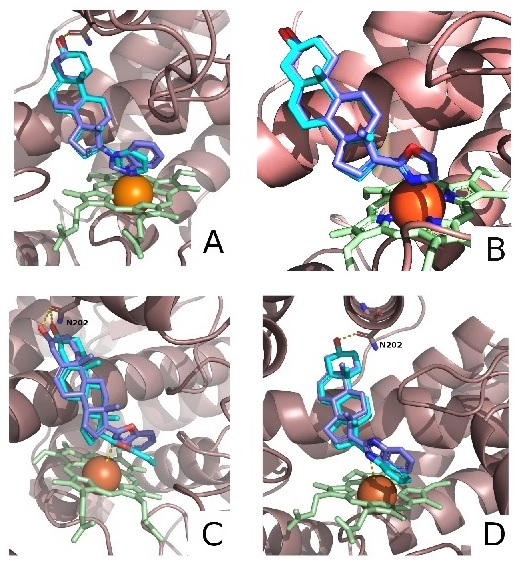
Соединения 3–8 были выделены в индивидуальном состоянии, их структура была охарактеризована спектрами 1H ЯМР и 13C ЯМР и МСВР. Модели взаимодействия соединений 3–8 с CYP17A1 были построены с использованием молекулярного докинга (рис. 3).
На рисунке 3А представлены результаты контрольного докинга абиратерона (1) и галетерона (2) в активный центр CYP17A1 человека, воспроизводящие структуры белок-лигандных комплексов (PDB id – 3RUK и 3SWZ) со значением RSMD 0.51 Å. На рисунке 3B представлены результаты докинга оксазолинов 3 и 6 в активный центр CYP17A1, показывающие, что атом железа гема образует координационную связь с атомом азота оксазолинового цикла; стероидный цикл оксазолинов 3, 6 и абиратерона (1) располагается практически одинаково; 3β-гидроксильная группа всех соединений расположена близко к остатку Asn-202, что делает возможным образование соответствующих водородных связей. Докинг бензоксазолов 4 и 7 (рис. 3C) и бензимидазолов 5 и 8 (рис. 3D) в активный центр CYP17A1 показывает, что производные андроста-5,16-диена 4 и 5 способны образовать стабильный комплекс с ферментом, аналогичный комплексу CYP17A1-галетерон, в котором атом азота гетероцикла координируется с железом гема. Напротив, производные андрост-5-ена 7 и 8 могут связываться в активном центре CYP17A1 только если гетероцикл располагается параллельно плоскости гема. Таким образом, результаты докинга показали возможность связывания соединений 3–8 с CYP17A1, а также, что положение соединения в активном центре определяется структурой гетероцикла и присутствием двойной связи в положении 16. Известно, что абиратерон и галетерон слабо влияют на пролиферацию клеток LNCaP и PC-3 при кратковременной (24 ч) инкубации, однако значительно подавляют её при продолжительной (96 ч и 120 ч) инкубации [29, 30]. Оценивая пролиферацию клеток по МТТ-тесту [28], мы нашли, что соединения 3–8 оказывают на клетки аналогичный эффект. В таблице 1 приведены данные для соединений 1–8 при 96 ч инкубации. Данные таблицы 1 свидетельствуют, что способность подавлять пролиферацию клеток LNCaP и PC-3 зависит от структуры гетероцикла (оксазолин > бензимидазол > бензоксазол) и наличия двойной связи в положении 16 (ненасыщенные > насыщенные). Среди новых соединений выявлены два: 2’-(3β-гидроксиандроста-5,16-диен-17-ил)-4’,5’-дигидро-1’,3’-оксазол 3 и 2’-(3β-гидроксиандроста-5,16-диен-17-ил)-(1H)-бензимидазол 5, антипролиферативная активность которых значительно превышала активность абиратерона и галетерона. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Данная работа не включает исследования, в которых в качестве объекта выступали люди или животные. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 годы) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|