|
Фосфолипидная система с адресным пептидом Ангиопеп-2 для доставки хлорина е6 в исследовании in vitro
Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: Ангиопеп-2; фосфолипидные наночастицы; хлорин е6 DOI: 10.18097/BMCRM00244 ВВЕДЕНИЕ Одним из наиболее агрессивных типов опухолей головного мозга является глиобластома (ГБМ), характеризующаяся инфильтративностью с микроскопическим распространением на нормальную паренхиму головного мозга [1]. При терапии ГБМ после хирургического вмешательства в большинстве случаев от края видимой области опухолевой массы обнаруживаются микроскопические инфильтрующие клетки, поэтому дополнительно проводят химио- и лучевую терапию, в том числе возможно применение фотодинамической терапии (ФДТ). Принцип ФДТ основан на введении специфического агента – фотосенсибилизатора (ФС), селективно накапливающегося в опухоли и под воздействием лазерного облучения приводящего к гибели раковых клеток. Использование ФТД возможно непосредственно во время удаления опухоли для подсвечивания ее границ при флуоресцентном контроле или сразу после резекции опухоли. Данные манипуляции позволяют максимально убрать скрытые и резидуальные клетки, тем самым снизив риск рецидивов ГБМ [2-4]. Наиболее часто используемыми ФС для лечения злокачественных новообразований головного мозга являются 5-аминолавулиновая кислота (5-АЛК) и фотофрин (PHOTOFRIN®) [5, 6]. Проведен ряд исследований по использованию хлорина е6 (Се6) в терапии злокачественных новообразований головного мозга, который обладает повышенной фотоактивацией при более длинных волнах (660-670 нм) и сниженной «темновой» токсичностью по сравнению с производными гематопорфирина [7-10]. В клинических исследованиях была показана эффективность использования Се6 в ФДТ при терапии различных типов опухолей [11-13]. Использование ФДТ хотя и является перспективным методом лечения ГБМ, однако ФС, используемые при данном методе, в большинстве случаев не обладают достаточной специфичностью к ГБМ вследствие ограниченного проникновения через защитный гематоэнцефалический барьер (ГЭБ). При введении лекарственных препаратов ГЭБ ограничивает их поступление к опухоли головного мозга (ГБМ) (более 98% низкомолекулярных и почти 100% высокомолекулярных соединений) [14]. Для преодоления данного ограничения исследуются различные подходы, например, кавитация (образование разрывов) ГЭБ при использовании фокусированного ультразвукового воздействия под контролем магнитного резонанса, недостатком которого является затруднение совмещения, в том числе ни в одном проведенном исследовании не оценивалось потенциальное повреждение окружающих тканей [15]. Другим перспективным подходом повышения накопления лекарств в опухоли ГБМ является снабжение лекарственных соединений системами доставки [16, 17]. Для терапии глиом разрабатываются различные системы; среди них для защиты и доставки широкого спектра лекарств и вакцин в клетки особый интерес представляют липидные наночастицы. Однако из-за низкой биодоступности, токсичности и стимуляции врожденных иммунных реакций они являются несовершенной системой доставки [18]. Для повышения эффективности накопления лекарственных соединений в клетках опухоли ГБМ были разработаны разнообразные наночастицы для воздействия на поверхностные маркеры опухоли, рецепторы, аберрантные гены и сигнальные пути [19]. Среди рецепторов на поверхности клеток, участвующих в трансцитозе многих белков и пептидов через ГЭБ, особое значение представляет эндацитарный липопротеиновый рецептор LPR-1 массой 600 кДа, сверхэкспрессия которого наблюдается в клетках ГБМ головного мозга и в эндотелиальных клетках сосудов некоторых тканей ГЭБ [20, 21]. В исследованиях для нацеливания на LPR-1 широко используется олигопептид Ангиопеп-2 (TFFYGGSRGKRNNFKTEEY, молекулярная масса 2.4 кДа), идентифицированный как часть семейства пептидов, полученных из домена Кунитца, обеспечивающий проникновение через ГЭБ посредством рецептор-опосредованного транспорта [22]. Ангиопеп-2 продемонстрировал большую способность к трансцитозу и накоплению в паренхиме, чем ингибитор протеазы апротинин. Данная способность Ангиопеп-2 делает его перспективным агентом для доставки лекарств через ГБМ, который участвовал в клинических испытаниях [23; 24]. В связи с этим ранее показавшую многообещающие результаты в экспериментах in vitro [25, 26] фосфолипидную систему хлорина е6 модифицировали дополнительно адресным компонентом – олигопептидом Ангиопеп-2, обладающим высокой способностью к трансцитозу через ГЭБ. Физические свойства полученной модифицированной композиции, уровень накопления хлорина е6 в опухолевых клетках U-87 MG и фотодинамической активности были исследованы в экспериментах in vitro. МЕТОДИКА
Синтез конъюгата DSPE-Peg2000-ANG Использовали пептид Ангиопеп-2 (TFFYGGSRGKRNNFKTEEY, ANG), синтезированный в лаборатории пептидной инженерии Института биомедицинской химии (ИБМХ), и коммерческий линкер DSPE-PEG2000-Maleimid («Nanosoft Polymers», США). Синтез конъюгата проводили согласно методике [27] с некоторой модификацией. Соотношение DSPE-Peg2000-Maleimid:ANG составляло 1:1 (молярное соотношение). Исходные реагенты растворяли в смеси фосфатно-солевого буфера (PBS, 0.1М) («ПанЭко», Россия) и триэтиламина (1.45 мМ, ТЭА) («Fluka», США) (pH 7.4). Инкубационную смесь барботировали аргоном в течение 24 ч при комнатной температуре при постоянном перемешивании. После инкубации проводили диализ (3.5 кДа) против воды в течение 48 ч для удаления непрореагировавших веществ. Затем лиофильно высушивали и хранили готовый продукт при -20°С. Получение композиции встроенных в фосфолипидные наночастицы хлорина е6 и Ангиопеп-2 Для получения композиций был использован соевый фосфатидилхолин Lipoid S100 («Lipoid GmbH», Германия), субстанция ди-N-метил-D-глюкаминовой соли Се6, с 50% содержанием Се6, полученная в Ивановском химико-технологическом университете (Россия). Получение композиции с адресным фрагментом (NPh-Ce6-ANG) проводили аналогично методике [28] пленочным методом. Кратко, навески Lipoid S100 и конъюгата DSPE-Peg2000-ANG растворяли в небольшом количестве этилового спирта (2-3 мл) («Медхимпром», Россия). Полученные спиртовые растворы смешивали, после чего спирт упаривали на роторном испарителе Heidolph Laborota 4003 («Heidolph», Германия) в течение 8-10 мин при 60 mbar, температуре воды в бане 30°C и скорости вращения ротора 1190 rpm. Полученную липидную пленку регидратировали дистилированной водой с добавлением Се6. Грубую эмульсию обрабатывали на ультразвуковом дезинтеграторе Bandelin Sonopuls («Bandelin», Германия) с использованием титанового стержня MS72 в течение 6 мин при мощности 50%. Образец сравнения – композицию Се6 без адресного фрагмента (NPh-Ce6) – готовили аналогично, исключая этап внесения конъюгата. Размер и ζ-потенциал наночастиц (НЧ) полученной композиции определяли на анализаторе Zetasizer Nano ZS («Malvern», Великобритания) с программным обеспечением Malvern ZETASIZER 6.20. Процент включения Се6 в НЧ оценивали методом ультрафильтрации с использованием микрофильтров VivaSpin 500, 5кДа («Sartorius AG», Германия). Концентрацию Се6 определяли методом ВЭЖХ с использованием хроматографической системы Agilent 1100 Series («Agilent Technologies», США) [29]. Высвобождение хлорина е6 из наночастиц in vitro Оценку высвобождения Ce6 из НЧ проводили методом диализа. Из каждой композиции NPh-Се6-ANG и NPh-Се6 (концентрация по Cе6 250 мкг/мл) аликвоту 1 мл переносили в диализные мешки (3.5 кДа), которые помещали в 10 мл раствора фосфатно-солевого буфера (PBS) (pH 7.4) при 37°С и инкубировали при перемешивании на магнитной мешалке. Через 0.25 ч, 0.5 ч, 1 ч, 1.5 ч, 2 ч, 3 ч и 24 ч проводили отбор аликвоты супернатанта (1 мл) и добавляли равное количество PBS. Высвобождение определяли с помощью спектрофотометра Agilent 8453 («Agilent Technologies») при 405 нм. Степень высвобождения лекарственного средства рассчитывали как отношение концентрации лекарственного средства (высвобожденного лекарственного средства из фосфолипидной НЧ) в данный момент времени на начальную концентрацию лекарственного средства в фосфолипидной НЧ. Оценка клеточного связывания и проникающей способности Клеточную линию глиобластомы человека U-87 MG, предоставленную лабораторией клеточной биологии Института биомедицинской химии, культивировали согласно приведенным в сертификате клеточных культур рекомендациям при 37°С в атмосфере с относительной влажностью 95 % с содержанием 5% СО2 (СО2-инкубатор «Binder», Германия). Использовали необходимые среды с добавлением 10% эмбриональной телячьей сыворотки крови («ПанЭко») [17]. В данной работе применяли клеточные линии от 3 до 10 пассажей. Клетки U-87 MG (106 клеток на лунку) высевали в 6-луночные культуральные планшеты («Biologyx», Китай) и инкубировали в течение 24 ч при 37°С. Далее в концентрации 20 мкг/мл в пересчёте на Се6 вносили образцы исследуемых композиций NPh-Се6-ANG и NPh-Се6, в качестве контроля использовали свободную субстанцию Се6, инкубировали в течение 2 ч при двух температурных режимах: 37°C в СО2-инкубаторе («Sanyo», Япония) и 4°C в холодильном оборудовании («АТЛАНТ», Беларусь). После инкубации среду с композициями сливали, клетки дважды промывали PBS. Се6 экстрагировали раствором метанола («Fisher Scientific», Великобритания) с добавлением 0.1% муравьиной кислоты («Sigma», США) из расчета 1 мл на лунку. Собранные экстракты разделяли центрифугированием при 10000 об/мин в течение 10 мин на настольной центрифуге Eppendorf 5810R («Eppendorf», Германия). Концентрацию Се6 в полученных образцах измеряли с помощью ВЭЖХ системы Agilent 1200 Series с колонкой Eclipse XDB-C18 («Agilent Technologies») и масс-спектрометрическим детектором 6130 Quadrupole LC/MS («Agilent Technologies») [25]. Содержание Се6 в клеточных культурах нормировали на содержание белка (мг), которое определяли методом Лоури. Интернализацию вычисляли по разности содержания Се6 при 37°С (общее накопление в клетках) и при 4°С (присоединение к клеточной поверхности) [30]. Цитотоксическое действие и фотоиндуцированная активность in vitro Клетки U-87 MG высевали в стерильные 96-луночные культуральные планшеты («Biologyx», Китай) в концентрации 104 клеток на лунку и инкубировали при 37°C в атмосфере 5% CO2 (СО2-инкубатор Sanyo) в течение 24-26 ч. Далее в планшеты вносили исследуемые образцы (NPh-Ce6-ANG, NPh-Ce6, Ce6) в концентрациях 0.125 мкг/мл, 0.25 мкг/мл, 0.5 мкг/мл, 2.5 мкг/мл, 5 мкг/мл, 10 мкг/мл и 25 мкг/мл по Се6 и системы без активного вещества (NPh, NPh-ANG) в концентрациях 1.25 мкг/мл, 2.5 мкг/мл, 5 мкг/мл, 25 мкг/мл, 50 мкг/мл, 100 мкг/мл и 250 мкг/мл по фосфатидилхолину; разведения образцов готовили с использованием культуральной среды. Клетки инкубировали с образцами при 37°C в атмосфере 5% CO2. Оценку жизнеспособности клеток проводили с использованием МТТ теста («Sisco Research Laboratories», Индия) через 24 ч, 48 ч и 72 ч инкубирования с образцами. В лунку добавляли по 60 мкл МТТ (1 мг/мл) и инкубировали при 37°С в течение 3 ч. Затем среду удаляли и добавляли 100 мкл DMSO («ПанЭко»). Накрывали фольгой и взбалтывали клетки на орбитальном шейкере в течение 15 мин. Регистрировали поглощение при 570 нм (Multiscan FC, «ThermoSpectronic», США) и нормировали на необработанный контроль (без Се6). Жизнеспособность клеток рассчитывали по уравнению (1):
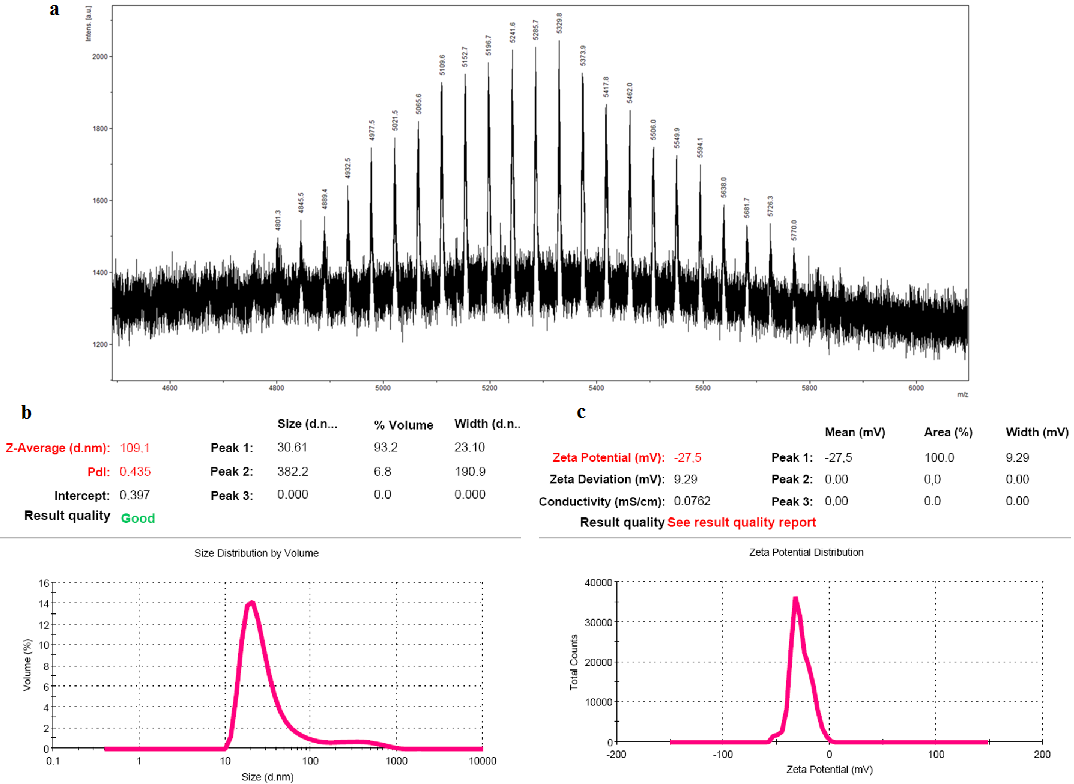
Для оценки фотоиндуцированной активности клетки U-87 MG инкубировали с композициями Се6 (NPh-Ce6, NPh-Ce6-ANG, Ce6) в указанных выше концентрациях в течение 2 ч. После инкубации клетки подвергали облучению лазером с длиной волны 638 нм (экспериментальная лазерная установка, Институт фотонных технологий ФНЦК РАН, Москва, Россия) в течение 30 мин (доза 1.5 Дж/см2). Далее клетки инкубировали при 37°С в атмосфере 5% CO2 (СО2-инкубатор Sanyo) в течение 24 ч и проводили оценку жизнеспособности с помощью МТТ теста. Критерием оценки фотоиндуцированной активности являлась величина IC50, которую рассчитывали онлайн с помощь сайта AAT Bioquest [31]. Статистическая обработка Для оценки достоверности различий измеряемых параметров по трём повторностям использовали критерий Стьюдента. Различия считали статистически значимыми при p≤0.05. На рисунках данные представлены как среднее ± стандартная ошибка среднего. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Терапия злокачественных новообразований головного мозга включает в себя текущие стандарты лечения – максимальную и безопасную хирургическую резекцию с последующей одновременной химиотерапией и фракционированной лучевой терапией. Однако инфильтрирующий рост опухоли и степень резекции трудно оценить интраоперационно, часто остаются инфильтративные клетки, которые в последствии приводят к рецидивам. Применение ФДТ становится наиболее популярным, так как дает возможность для резекции опухолей под флуоресцентным контролем, а также использование ее после хирургического вмешательства. Проведение хирургического вмешательства под флуоресцентным контролем и ФДТ позволяет не только визуализировать опухолевые клетки, но избирательно разрушать их [32]. Однако вследствие неспецифичности к ГБМ используемые при ФДТ препараты ограничены в проникновении через защитный ГЭБ. Использование нанотехнологий может позволить повысить доставку ФС к конкретным опухолевым клеткам и улучшить фармакокинетику лекарств. Поэтому разработанная ранее фосфолипидная наносистема Се6 была модифицирована адресным вектором Ангиопеп-2, специфичным к экспрессирующему на поверхности клеток ГБМ и участвующему в переносе через ГЭБ посредством рецептор-опосредованного транспорта рецептору липопротеинов низкой плотности LPR-1 [20]. Для «закрепления» ANG в липидных НЧ необходимо было получить имеющий сродство к фосфолипидам конъюгат. Поэтому проводили реакцию связывания между тиоловой группой ANG и малеимидной DSPE-Peg2000-Mal с получением конъюгата DSPE-Peg2000-ANG, синтез которого подтверждали методом MALDI-TOF. Спектр синтезируемого продукта представлен на рисунке 1a, где наблюдалось присутствие сигнала целевого соединения. Полученный конъюгат использовали для встраивания в фосфолипидные Се6-содержащие НЧ (композиция NPh-Ce6-ANG). Исследования физических параметров полученной композиции NPh-Ce6-ANG показали, что размер частиц составлял 31.98±1.98 нм (PdI 0.453±0.03), доля частиц заданного размера составляла около 93% (рисунок 1b). Значение ζ-потенциала для NPh-Ce6-ANG составляло -27.43±1.14 мВт (рисунок 1c).
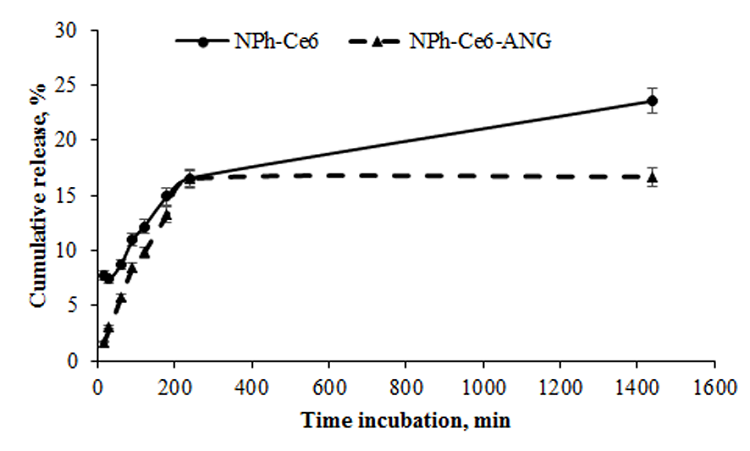
В более ранних исследованиях [26] физические свойства были изучены для фосфолипидной композиции NPh-Ce6. Размер частиц соответствовал 18 нм (доля частиц указанного размера 96%), значение ζ-потенциала составляло -23 мВ [26]. Т.е. внесение олигопептида приводило к увеличению размера НЧ, при этом значение ζ-потенциала исследуемой композиции NPh-Ce6-ANG изменялось незначительно, приводя к снижению стабильности. Согласно классификации по уровню ζ-потенциала наноэмульсий, где ± 20–30 мВ и ˃ ± 30 мВ характеризуются как умеренно стабильные и высокостабильные соответственно [33], композиция NPh-Ce6-ANG соответствовала значениям умеренно стабильной эмульсии. Важным характеризующим фосфолипидную композицию параметром является процент включения лекарственной субстанции в НЧ, который составил 98.6±0.43% Се6, что свидетельствовало о практически полном ее встраивании. Моделирование различных условий позволит понять и предположить действие композиции и её активных компонентов в условиях in vivo. Естественный градиент рН в эндосомах или лизосомах опухолевых клеток составляет 5.0-6.5, в микроокружении опухоли – 6.5-7.2 [34], рН крови при нормальных условиях – 7.35-7.45 [35]. Поэтому в эксперименте in vitro была исследована степень извлечения лекарства из наночастиц при нейтральном значении pH-среды. Результаты показали, что в начальной точке инкубации (через 15 мин) уровень высвобождения Се6 из наночастиц в системе без адресного компонента в значительной степени превосходил значения композиции с ANG в 4.5 раза. Через 4 ч инкубации значения для исследуемых образцов выравнивались и составляли около 16,5% (рис. 2).
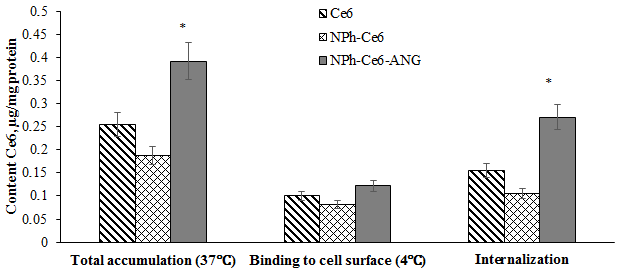
Следует отметить, что через 24 ч инкубации фосфолипидной композиции без адресного пептида (NPh-Ce6) в окружающем растворе продолжал обнаруживаться Се6, т.е. наблюдался выход субстанции из НЧ, который составил около 24%, а для композиции с адресным пептидом (NPh-Ce6-ANG), начиная с 4 ч инкубации, значение высвобожденного лекарства не изменялось. Таким образом, максимальное высвобождение лекарства в обоих исследуемых вариантах композиций наступало через 4 ч инкубации. При этом через 3 ч инкубации фосфолипидной композиции Се6 с ANG высвобождалось около 13.3% лекарства, а в композиции NPh-Се6 – 14.9%. При этом адресный компонент влиял именно в начальный период времени, не давая частице «раскрыться» сразу, т.е. можно предположить, что при попадании композиции Се6 с ANG в кровяное русло выход лекарства будет минимальным. Согласно литературным данным, на поверхности клеток ГБМ человека U-87 MG наблюдается экспрессия рецептора LPR-1 [36]. Результаты оценки клеточного накопления Се6 на указанной клеточной линии после инкубации с композициями, содержащими адресный компонент и без него, представлены на рисунке 3.
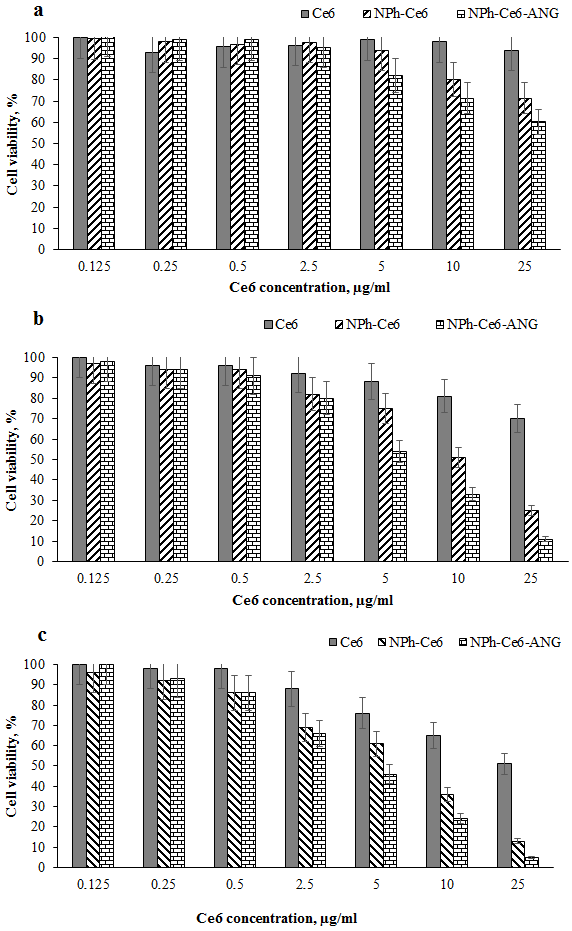
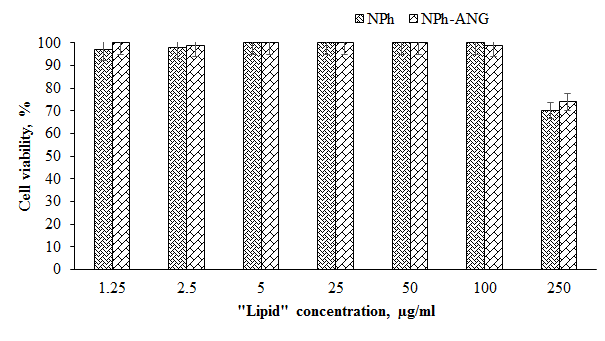
Использование адресного пептида ANG показало повышение значений как общего накопления, так и проникновения внутрь клетки (интернализации) ФС. По сравнению с использованием свободной субстанции общее накопление Се6 повышалось на 33%, а интернализация – на 40%. Однако при использовании композиции без адресного компонента (NPh-Ce6) эффекта в повышении как общего накопления, так и интернализации Се6 на данной культуре клеток отмечено не было. Результаты исследования цитотоксического действия разработанной композиции через 24 ч, 48 ч и 72 ч инкубации представлены в сравнении с действием фосфолипидной композиции Се6 и свободной субстанции на рисунке 4. Через 24 ч инкубации клеток с образцами в минимальных концентрациях от 0.125 до 2.5 мкг/мл различий между вариантами не наблюдалось, процент живых клеток составлял 100% (рисунок 4a). Увеличение концентрации Се6 приводило к снижению процента живых клеток и в варианте с максимально используемой концентрацией 25 мкг/мл составлял 60% для NPh-Ce6-ANG.. Аналогичное действие было отмечено при инкубации с веществами в течение 48 ч (рис. 4b) и 72 ч (рис. 4c); наблюдалась более высокая степень ингибирования клеток, процент живых клеток составлял для композиции NPh-Ce6-ANG 11% и 5% соответственно. На жизнеспособность клеток может оказывать влияние не только используемая лекарственная субстанция, но и другие компоненты системы. Поэтому было исследовано влияние фосфолипидных НЧ (NPh) и фосфолипидных НЧ с Ангиопеп-2 (NPh-ANG) без Се6 на жизнеспособность клеток U-87 MG. Процент живых клеток снижался только в варианте с максимальной концентрацией липида (по фосфатидилхолину 250 мкг/мл) на 30% по сравнению с другими концентрациями (рис. 5). Поэтому можно предположить, что через 72 ч инкубации (рис. 4c), усиление эффекта было обусловлено взаимным влиянием всех компонентов композиции NPh-Ce6-ANG на опухолевые клетки.
Следует отметить, что для свободной субстанции подавление жизнедеятельности опухолевых клеток происходило только на 50% (рис. 4c). Степень ингибирования жизнедеятельности опухолевых клеток при инкубировании с фосфолипидной композицией Се6 была практически одинаковой наряду с содержащей адресный пептид композицией (NPh-Ce6-ANG). Достоверное различие между этими вариантами было отмечено в максимальной концентрации по Се6 через 48 ч и 72 ч инкубирования (рис. 4b и рис.4c соответственно).
В качестве критерия оценки фотоиндуцированной активности использовали величину IC50 (концентрация ФС в среде, после воздействия которой наблюдается гибель 50% клеток). Клетки повергали воздействию лазера в дозе 1.5 Дж/см2. Исследование фотоиндуцированной активности показало, что использование адресного пептида (ANG) привело к снижению величины IC50 для композиции NPh-Ce6-ANG в 1.33 раза по сравнению со свободной субстанцией. Так, для свободной субстанции IC50 составляло 3.81±0.11 мкг/мл, а для композиции NPh-Ce6-ANG – 2.85±0.1 мкг/мл. Значение IC50 для фосфолипидной композиции Се6 (NPh-Ce6) было аналогично значению для композиции с пептидом и составило 2.91 мкг/мл. Таким образом, внесение адресного компонента не повлияло на изменение фотоиндуцированной активности ФС, большую степень влияния оказало встраивание Се6 в фосфолипидные НЧ. ЗАКЛЮЧЕНИЕ Полученные результаты в экспериментах in vitro показали эффективность разработанной композиции встроенного в фосфолипидные НЧ Се6 с адресным пептидом Ангиопеп-2. Композиция NPh-Ce6-ANG может быть полезной и перспективной в клиническом применении для лечения глиобластомы. Также система фосфолипидных наночастиц с адресным пептидом Ангиопеп-2 может быть использована для встраивания других ФС для их направленной доставки. Полученные результаты интернализации Се6 свидетельствуют о возможном «связывании» векторной молекулы Ангиопеп-2 с рецептором на поверхности опухолевых клеток, однако с какими именно, исследование в данной работе не проводилось. Особенно интересным представляется эксперимент in vivo, с помощью которого можно будет оценить возможный механизм и степень переноса лекарства в составе данной композиции через ГЭБ. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ В работе отсутствуют исследования, в которых в качестве объекта выступают люди или животные. БЛАГОДАРНОСТИ Авторы выражают благодарность сотрудникам лаборатории клеточной биологии ИБМХ Я.С. Киму и к.б.н. А.М. Гисиной за предоставление клеточного материала для экспериментов in vitro, а также ЦКП «Протеом человека» ИБМХ за помощь в постановке и проведении эксперимента методом MALDI-TOF, генеральному директору «Солитон Фотоникс» (Москва) к.ф.-м.н. К.В.Зотову за предоставление лазерной установки для проведения экспериментов по исследованию фотоиндуцированной активности in vitro. Также авторы выражают благодарность за предоставление пептида сотрудникам лаборатории пептидной инженерии ИБМХ д.б.н., профессору, зав. лаборатории Е.Ф. Колесановой и к.б.н. м.н.с. О.В. Чибисковой. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|