|
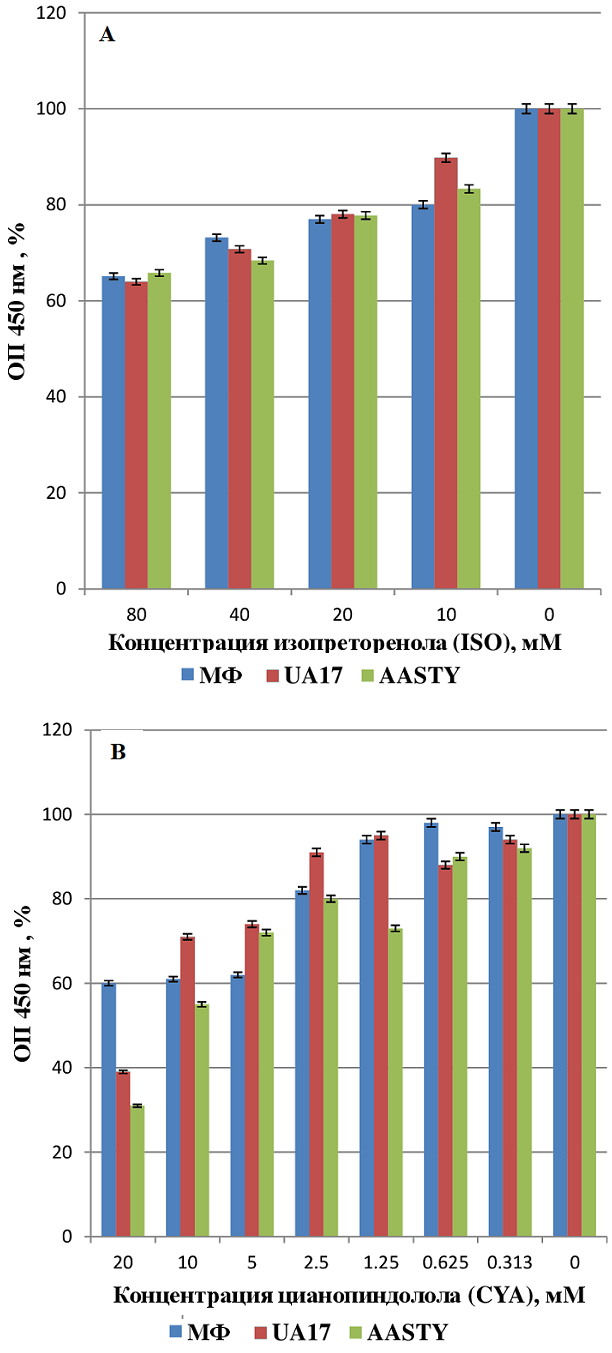
Β1-адренорецептор в составе нанодисков размером 10-16 нм сохраняет лиганд-связывающие свойства 1Национальный медицинский исследовательский центр кардиологии им. ак. Е.И. Чазова, 121552 Москва, ул. Академика Чазова, 15а; *e-mail: peclo@yandex.ru Ключевые слова: β1-адренорецептор; нанодиски; UltrasoluteTM Amphipol 17; AASTY 11-45 DOI: 10.18097/BMCRM00247 ВВЕДЕНИЕ В настоящее время в литературе имеется немало данных, свидетельствующих о возможном вкладе аутоиммунных процессов в патогенез сердечно-сосудистых заболеваний. В основном эти исследования касаются пациентов, страдающих хронической сердечной недостаточностью (ХСН) различной этиологии. В частности, аутоантитела к β1-адренорецептору (АДРБ1 АТ) обнаруживаются в сыворотке крови больных дилатационной кардиомиопатией (ДКМП, [1, 2]), болезнью Чагаса [3], перипартальной кардиомиопатией [4]. Было показано, что по крайней мере некоторые АДРБ1 АТ вызывают увеличение частоты и силы сокращений (положительный хронотропный и инотропный эффекты соответственно) кардиомиоцитов, выделенных из желудочков сердца новорожденных крысят. Кроме того, АДРБ1 АТ обладают прямым и непрямым (опосредованным через фибробласты сердца) кардиотоксическим действием. Современные представления о кардиопатогенных свойствах АДРБ1 АТ рассмотрены в обзорах [5-7]. Патогенетическая роль АДРБ1 АТ обусловливает соответствующие терапевтические стратегии, связанные с удалением этих антител из кровотока больных. Так, проведение процедуры специфической иммуноадсорбции у больных ДКМП (сорбенты на основе пептидов, воспроизводящих фрагменты второй внеклеточной петли АДРБ1) приводило к улучшению гемодинамических показателей [8]. Как неизбирательное, так и избирательное удаление иммуноглобулинов позволяло продлить время ожидания трансплантации сердца терминальным больным с ДКМП [9]. Таким образом, можно заключить, что выявление АДРБ1 АТ в крови больных и мониторинг содержания этих антител является актуальной потребностью клинической практики. «Золотым стандартом» определения АДРБ1 АТ считается функциональный тест, который был впервые предложен в 1987 г. Wallukat с соавторами, а затем ими же усовершенствован и валидирован [10]. Метод основан на феномене появления положительного хронотропного эффекта в первичной культуре спонтанно сокращающихся кардиомиоцитов новорожденных крысят в присутствии АДРБ1 АТ. Сложность метода не позволяет использовать его в условиях клинических лабораторий. Наиболее удобным для повседневной лабораторной работы является формат твердофазного иммуноферментного анализа (ИФА). До недавнего времени для обнаружения АДРБ1 АТ широко применяли ИФА с использованием в качестве антигена линейных пептидов, воспроизводящих в большинстве случаев аминокислотные последовательности второй внеклеточной петли АДРБ1 [11]. Данный метод, однако, не раз подвергался заслуженной критике ввиду его низкой чувствительности, обусловленной, по-видимому, тем, что линейные пептиды не способны адекватно воспроизводить конформационно-зависимые эпитопы молекул рецептора, с которыми предположительно связываются АДРБ1 АТ [12-14]. Были также предприняты попытки (в том числе и в нашей лаборатории) создания протоколов выявления АДРБ1 АТ с помощью так называемых конкурентных ИФА, где в качестве антигена использовали трансгенные клетки, экспрессирующие на своей поверхности АДРБ1. Содержание АДРБ1 АТ в сыворотке крови пациентов оценивали по количеству связавшегося с антигеном мышиного рекомбинантного антитела к АДРБ1, конкурирующего с человеческими АДРБ1 АТ за места связывания с рецептором [15, 16]. Результаты оказались сложно интерпретируемыми, возможно, из-за частично денатурировапнного состояния антигена: клетки подвергались фиксации параформальдегидом [15] либо глутаровым альдегидом [16]. Для разработки адекватного метода твердофазного ИФА, позволяющего надежно и воспроизводимо выявлять АДРБ1 АТ, необходимо использовать в качестве антигена препарат рецептора в той же конформации, что и в исходной клеточной мембране. Перспективным подходом для решения этой задачи является солюбилизация АДРБ1 в форме нанодисков [17]. В нанодисках молекулы АДРБ1 оказываются включенными во фрагменты бислойной липидной мембраны, что, согласно современным представлениям, должно сохранять нативную конформацию рецептора. Для получения нанодисков используют либо мембранные каркасные белки (membrane scaffold proteins, MSP [17]), либо амфипатические полимеры. Последние позволяют экстрагировать мембранные белки в нативном липидном окружении непосредственно из живых клеток или из мембранных везикул [18, 19]. В нашей предыдущей статье подробно описаны результаты тестирования различных амфипатических полимеров по их способности солюбилизировать АДРБ1 таким образом, чтобы он был пригоден для использования в качестве антигена в твердофазном ИФА [20]. АДРБ1, солюбилизированный с помощью либо UltrasoluteTM Amphipol 17 (UA17), либо AASTY 11-45, сохранял свои антигенные свойства будучи адсорбированным в лунках пластикового планшета. Целью настоящей работы было дальнейшее изучение физико-химических свойств АДРБ1-содержащих нанодисков: определение их размеров методом динамического светорассеяния и оценка способности АДРБ1 связывать специфические лиганды. МЕТОДИКА Линия клеток, экспрессирующих АДРБ1, получение мембранной фракции (МФ) и солюбилизация мембранных белков Создание линии клеток ADL-7A, экспрессирующих АДРБ1 человека, свойства и условия культивирования этих клеток описаны нами ранее [21]. Подробные протоколы получения клеток ADL-7A и солюбилизации мембранных белков содержатся в нашей предыдущей работе [20]. Клетки выращивали в чашках Петри диаметром 10 см до плотности около 107 клеток на чашку, отмывали фосфатно-солевым буфером (ФСБ, «neoFroxx GmbH», Германия), затем снимали силиконовым скребком.. Суспензию клеток обрабатывали ультразвуком, дебрис осаждали при 1000 g в течение 15 мин при 4°С, после чего супернатант отбирали, переносили в пробирки для ультрацентрифугирования и осаждали МФ при 100000 g, 4°С в течение 1 ч. Осадок ресуспендировали в буфере, содержащем 50 мМ NaH2PO4, 200 мМ NaCl, 5 мкг/мл апротинина и лейпептина, pH8.0, аликвотировали и хранили при -70°С. С целью солюбилизации мембранных белков аликвоты МФ размораживали, измеряли в них концентрацию белка методом Бредфорда и доводили ее до 700 мкг/мл. Затем добавляли растворы полимеров UA17 или AASTY 11-45 (Synthetic Nanodisc Screening Kit MAXI, «Cube Biotech», Германия), используя 10% сток-растворы, приготовленные в соответствии с рекомендациями производителя. Конечная концентрация полимеров составляла 0.0625%, 0.125%, 0.25% и 0.5%. Препараты инкубировали при 37°С в течение 1ч с перемешиванием на ротаторе Hematology Chemistry Mixer model 346 (“Fisher”, США), затем центрифугировали при 100000 g, 4°С в течение 1 ч. Полученные супернатанты, содержащие МФ, солюбилизированную полимерами (далее МФ + ПОЛ), использовали в дальнейшей работе. Измерение размеров нанодисков методом динамического светорассеяния Определение размеров нанодисков в препаратах МФ+ПОЛ проводили методом динамического рассеяния света с использованием прибора Malver Zetasaizer Nano ZSP («Malvern Instruments», Великобритания) в режиме измерения размера частиц. Были использованы одноразовые пластиковые кюветы объемом 100 мкл и длиной оптического пути 1см. Анализировали рассеяние под углом 173°. Для каждого образца измерения повторяли трижды. Обработку данных и графическое представление выполняли в программе Zetasaizer Software 7.11. Иммуноферментный анализ в присутствии лигандов АДРБ1 Образцы исходной МФ и МФ+ПОЛ (5мкг/мл) адсорбировали на поверхности 96-луночных полистироловых планшетов для ИФА («Corning», США) в ФСБ при 4°С в течение ночи. На следующий день лунки планшетов промывали 4 раза ФСБ с 0.1% Tween-20 и вносили в них по 50 мкл раствора химерных (мышь/человек, 3 мкг/мл) рекомбинантных антител hAB2367 ко второй внеклеточной петле АДРБ1, полученных нами ранее [21], в блокирующем растворе, содержащем 20% казеинового концентрата CBC1 («SDT GmbH», Германия), 0.02% консерванта Proclin 300 («Sigma», США) и 0.1% Tween-20 в ФСБ, а также по 50 мкл растворов лигандов в том же буфере. Конечная концентрация изопротеренола («Sigma Aldrich», США) составляла 10 мМ, 20 мМ, 40 мМ и 80 мМ, цианопиндолола («Tocris Bioscience», США) – 0.313 мМ, 0.625 мМ, 1.25 мМ, 2.5 мМ, 5 мМ, 10 мМ и 20 мМ. Инкубацию проводили в течение 1 ч при комнатной температуре с перемешиванием на орбитальном шейкере (Kodak Amerlite Shaker Incubator, «Kodak», Великобритания) при скорости 750 об/мин. Затем лунки промывали 4 раза ФСБ с 0.1% Tween-20 и инкубировали 30 мин в тех же условиях с мышиными моноклональными АТ к человеческим IgG, конъюгированными с пероксидазой хрена [22], которые вносили в рабочем разведении в блокирующем растворе по 100 мкл в каждую лунку. Количество связавшегося конъюгата определяли при помощи хромогенного субстрата 3,3',5,5'-тетраметилбензидина (ТМБ). Значения оптической плотности (ОП) при 450 нм (после остановки реакции раствором серной кислоты) считывали при помощи микропланшетного ридера Stat Fax-2100 («Awareness Technology», США). Анализ каждого образца проводили дважды, полученные значения ОП усредняли. Ингибирование связывания антител hAB2367 с лигандами АДРБ1 (эффект конкуренции) выражали в % от исходного связывания в отсутствие лиганда . РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В предыдущей работе мы изучили способность различных амфипатических полимеров солюбилизировать АДРБ1 в форме, пригодной для использования в качестве антигена в твердофазном ИФА [20]. Предполагается, что разрабатываемый метод позволит надежно и достоверно определять содержание аутоантител к АДРБ1 в крови пациентов. Поэтому мы выбрали в качестве интегрального критерия эффективности солюбилизации максимальное связывание адсорбированными на пластике планшета препаратами МФ+ПОЛ (антигенами) специфических рекомбинантных антител hAB2367 ко второй внеклеточной петле АДРБ1 по отношению к аналогичному значению, получаемому с исходной МФ (условный показатель солюбилизации (УПС), выраженный в %). Наилучшими оказались полимеры UA 17 и AASTY 11-45 в концентрации 0.0625% (УПС 87% и 76% соответственно). Для изучения лиганд-связывающих свойств АДРБ1 в составе нанодисков МФ+UA 17 и МФ+AASTY 11-45 были проведены эксперименты с двумя лигандами АДРБ1: агонистом изопротеринолом (ISO) и антагонистом цианопиндололом (CYA). В лунки планшета для ИФА вносили препараты МФ и МФ + ПОЛ, затем рекомбинантные антитела hAB2367 (и антигены , и антитела – в фиксированных количествах), после чего добавляли тот или иной лиганд в различных концентрациях. Из данных, представленных на рисунке 1, следует, что и агонист (ISO), и антагонист (CYA) конкурируют с антителами за место связывания с АДРБ1, причем, чем выше концентрация лиганда, тем в большей степени подавляется связывание антител, что свидетельствует в пользу предположения о сохранности нативной структуры АДРБ1в составе нанодисков.
Как нам удалось выяснить ранее [20], полимеры UA17 и AASTY11-45 продемонстрировали обратную зависимость УПС от их концентрации: при низких конечных концентрациях (0.0625% и 0.125%) адсорбированные препараты МФ + ПОЛ связывали больше антител hAB2367. Одно из возможных объяснений этого феномена может заключаться в том, что увеличение концентрации полимера приводит к уменьшению размеров формирующихся нанодисков, из-за чего молекула АДРБ1 не может полноценно включаться в них, что ведет к нарушению структуры молекулы. Мы исследовали размеры нанодисков в препаратах МФ + ПОЛ, полученных при различных конечных концентрациях полимера UA 17: 0.0625%, 0.125%, 0.25% и 0.5%. Результаты измерений, проведенных с помощью метода динамического светорассеяния, представлены в таблице 1. Как можно видеть, размеры нанодисков в основном пике (пик 1, в котором содержится основная масса частиц препаратов) варьируют в диапазоне от 10 нм до 16 нм, причем, не наблюдается явной зависимости этих величин от концентрации UA 17. Это свидетельствует в пользу другого объяснения обратной зависимости УПС от концентрации полимера: возможно, избыток полимера блокирует места связывания рекомбинантных антител с АДРБ1. Как было показано ранее [20], самый высокий УПС (87%) наблюдался при концентрации UA17, равной 0.0625%. Этой концентрации соответствуют нанодиски размером 13.14 ± 0.25 нм и 16.13 ± 2.25 нм (результаты двух независимых измерений, табл.1). В случае другого выбранного нами для дальнейшей работы полимера AASTY 11-45 (УПС 76% при концентрации полимера 0.0625% [20]) размер нанодисков в основном пике оказался равным 14.14+/-0.93 нм (данные не показаны). В литературе отсутствуют сведения о размерах нанодисков, полученных с использованием UA17 и AASTY 11-45. Анализ соответствующих данных, касающихся других амфипатических агентов, показывает, что размеры нанодисков зависят от состава и длины полимера, pH и солевого состава буфера для солюбилизации [23]. Так, при использовании MSP в качестве амфипатического агента формируются нанодиски, имеющие размеры от 6 нм до 17 нм в зависимости от разновидности MSP [23]. Сополимер стирола и малеиновой кислоты (SMA) позволяет генерировать нанодиски размером 10-15 нм [23]. Нанодиски, полученные с помощью SMA, в составе которых находится бактериальный родопсин – белок, содержащий семь трансмембранных доменов (как и АДРБ1), имеют размеры 12+/-2 нм [24].
ЗАКЛЮЧЕНИЕ В работе продемонстрировано сохранение лиганд-связывающих свойств АДРБ1, солюбилизированного с помощью амфипатических полимеров UA17 и AASTY 11-45. Этот факт свидетельствуют в пользу предположения о сохранности нативной структуры АДРБ1 в составе нанодисков. Методом динамического светорассеяния впервые определен размер нанодисков, получаемых с использованием UA17. В диапазоне концентраций полимера от 0.0625% до 0.5% не обнаружено достоверных различий в размерах нанодисков, варьирующих от 10 нм до 16 нм. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. БЛАГОДАРНОСТИ Авторы благодарят эксперта лаборатории клеточной инженерии института экспериментальной кардиологии им. ак. В.Н. Смирнова Национального медицинского исследовательского центра кардиологии им. ак. Е.И. Чазова М.А. Слинкина за критические замечания и помощь в оформлении рукописи. ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Минздрава РФ (государственной задание по теме №152 «Разработка метода иммуноферментного анализа для определения аутоантител к β1-адренорецептору у кардиологических больных с использованием в качестве антигена очищенного рекомбинантного β1-адренорецептора в нативной конформации», рег. № НИОКТР 122020400212-0) и Общества с ограниченной ответственностью «Мона», (Москва, ОГРН 5087746251896). ФИНАНСИРОВАНИЕ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|