|
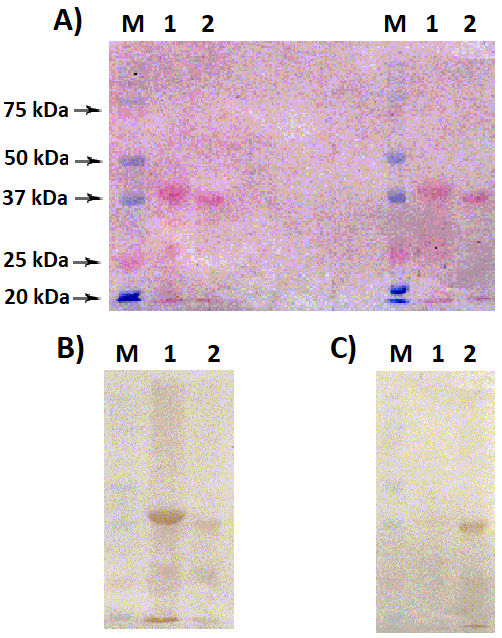
Взаимодействие поликлональных антител мыши и овцы с основными формам реналазы человека и крысы Научно-исследовательский институт, биомедицинской химии имени В.Н. Ореховича, 119121 Москва, Погодинская ул., 10; *e-mail: valfed38@yandex.ru Ключевые слова: : поликлональные антитела; реналаза-1 человека (RNLS1-human); реналаза-2 крысы (RNLS2-rat) DOI: 10.18097/BMCRM00248 ВВЕДЕНИЕ Реналаза (RNLS) – белок, которому свойственны различные функции внутри и снаружи клеток [1-3]. Внутриклеточная RNLS – FAD-зависимая оксидоредуктаза (КФ 1.6.3.5), катализирующая окисление изомерных форм b-NAD(P)H, восстановленных по 2 или 6 положению никотинамидного кольца вместо метаболически активного 4 положения [4]. Внеклеточная RNLS, теряющая в ходе секреции N-концевой пептид, ответственный за связывание FAD [5], оказывает различные защитные эффекты на клетку посредством взаимодействия с рецепторными белками [6-7]. Количественно уровень белка RNLS в биологических тканях/клетках обычно оценивается при помощи Вестерн-блот анализа с использованием коммерчески доступных антител (например, [8]). Их получают, иммунизируя животных при помощи синтетических пептидов, соответствующих определенным фрагментам аминокислотной последовательности (см. например, [9]). Ввиду вариабельности аминокислотных последовательностей RNLS из различных биологических источников, эффективность взамодействия полученных антител с целевыми белками может существенно отличаться. В данной работе мы исследовали взаимодействие поликлональных антиреналазных антител овцы и мыши, полученных при иммунизации полноразмерными белками реналазы человека (RNLS1-human) и крысы (RNLS2-rat) соответственно. Полученные результаты свидетельствуют о том, что мышиные антитела против полноразмерной RNLS2-rat взаимодействуют более избирательно с это формой реналазы крысы, чем антиреналазные антитела овцы, взаимодействующие с исследованными препаратами реналаз человека и крысы. МАТЕРИАЛЫ И МЕТОДЫ Реактивы Поликлональные антитела овцы против полноразмерной рекомбинантной RNLS1 человека (RNLS1-human) были получены и очищены в «Покард» (Россия). Моноклональные антитела против кроличьего/овечьего IgG и кроличьего/мышиного IgG, конъюгированные с пероксидазой хрена, производства «ИМТЕК» (Россия). Набор белковых маркеров для калибровки молекулярной массы приобретены у «Amersham» (Великобритания). Остальные химические реактивы, если не оговорено особо, были получены от «Sigma-Aldrich» (США). Рекомбинантные белки Получение рекомбинантных белков приведено в наших предыдущих публикациях [10-13]. Обе реналазы (RNLS1-human и RNLS2-rat) были экспрессированы в клетках E. coli в виде белков, содержащих С-концевую гексагистидиновую метку, с помощью которой в результате хроматографической очистки на Ni-сефарозе, были получены высокоочищенные препараты реомбинантные белки с электрофоретической чистотой около 90-95%. Получение поликлональных антител мыши против крысиной рекомбинантной реналазы крысы (RNLS2-rat) Для получения поликлональных антител к рекомбинантной RNLS2-rat проводили трехкратную внутрибрюшинную иммунизацию мышей, используя в качестве адъюванта гель гидроксида алюминия. Препарат рекомбинантной RNLS2-rat, предназначенный для иммунизации, предварительно сорбировали на адъюванте, для чего его разводили в физиологическом растворе натрия хлорида до конечной концентрации 100 мкг/мл с добавлением 100 мкг геля гидроксида алюминия. Сорбцию осуществляли в течение 14 ч при 4-7°С. Для иммунизации использовали восемь самок белых беспородных мышей весом 16-18 г, которым вводили препарат в объеме 0,5 мл. Одна иммунизирующая доза содержала 50 мкг RNLS2-rat и 50 мкг адъюванта гидроксида алюминия. Интервал между первой и второй иммунизациями составлял две недели, а между второй и третьей – четыре недели. В качестве контроля использовали не иммунизированное животное той же партии, что и опытные мыши. Через две недели после третьей иммунизации из шейной вены мышей отбирали кровь, из которой получали сыворотку, использованную в дальнейших экспериментах. Электрофорез белков в полиакриламидном геле (ПААГ) Электрофорез белков проводили в 12% ПААГ в присутствии додецилсульфата натрия (SDS, sodium dodecyl sulfate) по методу Laemmli [14]. Вестерн блот анализ Иммуноблоттинг проводили по методу Gallagher и соавт. [15] с небольшими модификациями, описанными ранее [16], с использованием препаратов поликлональных антител овцы против RNLS1-human и мыши против RNLS2-rat. В качестве вторичных антител использовали моноклональные антитела против кроличьих/овечьих IgG и кроличьих/мышиных IgG, конъюгированные с пероксидазой хрена («ИМТЕК») . РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ RNLS1-human – основная (если не единственная) форма реналазы, обнаруженная в ряде органов человека как на уровне мРНК, так и белка [2, 3]. Количественное определение белка RNLS1 предусматривает использование антиреналазных антител, которые дают далеко не всегда сопоставимые в разных лабораториях результаты [16]. Для основного транскрипционного варианта реналазы крысы (RNLS2-rat) известны данные об изменении уровня мРНК в тканях крыс со спонтанной гипертензией, по сравнению с нормотензивными животными [17], которые до сих пор не подтверждены на уровне белка. По данным электрофореза в 12% ПААГ в присутствии SDS, очищенные рекомбинантные RNLS1-human и RNLS2-rat представлены белками, молекулярные массы которых соответствуют расчетным 37.85 кДа и 34.95 кДа соответственно (рис. 1А). Вестерн блот анализ показал, что поликлональные антитела овцы против реналазы-1 человека взаимодействовали как с RNLS1-human, так и с RNLS2-rat; однако взаимодействие с рекомбинантным белком человека было более выраженным (рис. 1В). Иная картина обнаружена в ходе Вестерн блот анализа с поликлональными антителами мыши против RNLS2-rat, которые фактически не детектировали рекомбинантный белок человека (рис. 1С).
Аминокислотные последовательности этих белков, по данным программы Blast [18], характеризуются значительным сходством (рис. 2), которого, тем не менее, оказывается недостаточным для одинаково эффективного взаимодействия с использованными в данной работе антителами. Возможно, выявленные различия могут быть связаны с видовой специфичностью самих антител, а также различий, определяемых «несовпадающих» аминокислотных остатков исследуемых белков (RNLS1-human и RNLS2-rat). Это следует учитывать в контексте количественного определения RNLS1-human и RNLS2-rat в биологических образцах, основанного на использовании антител.
В более широком плане, выявленные различия результатов Вестерн блот анализа свидетельствуют о необходимости более тщательного выбора препаратов антител для количественной иммунодетекции целевых белков в биологических объектах. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей; иммунизацию мышей препаратами реналазы крысы осуществляли с соблюдением всех общепринятых норм гуманного отношения к лабораторным животным. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021–2030 гг.) (№ 122030100170-5).> КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|