|
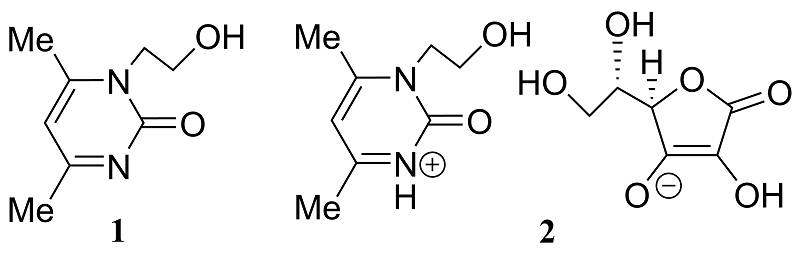
Гепатопротекторный эффект ксимедона и его конъюгата с L-аскорбиновой кислотой при отравлении мышей полулетальной дозой парацетамола Институт органической и физической химии им. А.Е. Арбузова – обособленное структурное подразделение ФИЦ КазНЦ РАН, 420088, г. Казань, ул. Академика Арбузова, 8; *e-mail: gregoir4@gmail.com Ключевые слова: производные пиримидина; ксимедон; гепатопротекторы; парацетамол; ацетаминофен; лекарственные поражения печени DOI: 10.18097/BMCRM00249 ВВЕДЕНИЕ Лекарственные поражения печени (ЛПП) представляют серьезную проблему для госпитализированных пациентов во всем мире. 17% ЛПП с летальным исходом приходятся на применение парацетамола (ацетаминофена). В России ЛПП регистрируются почти у 3% госпитализированных больных. ЛПП обусловлены приёмом противовоспалительных, противоопухолевых, противомикробных и других лекарственных средств. Токсичность различных препаратов приводит к повреждению гепатоцитов, нарушению биохимических процессов в печени и развитию острой печеночной недостаточности [1-3]. В последние десятилетия увеличивается количество случаев острой печеночной недостаточности, вызванной бесконтрольным приемом биологически активных добавок и средств растительного происхождения [4]. В данном исследовании в качестве модели ЛПП был использован парацетамол, как наиболее доступный и часто применяемый анальгетик-антипиретик, токсичность которого является второй по распространённости причиной трансплантации печени в мире [5]. Против острого токсического воздействия парацетамола применяется антидот N-ацетилцистеин (NAC), который необходимо использовать непосредственно после интоксикации, однако, существует потребность в поисках эффективной терапии, направленной на более поздние этапы развития отравления [6]. На рынке представлен большой спектр гепатопротекторных препаратов, направленных на защиту и восстановление ткани печени; однако, для них часто отсутствует клинически доказанная эффективность [7]. В создании новых эффективных гепатопротекторов активно исследуются производные пиримидина, обладающие высокой биологической активностью [8]. Одним из таких производных пиримидина является ксимедон (1,2-дигидро-4,6-диметил-1-(2-гидроксиэтил)-пиримидин-2-он) – отечественный лекарственный препарат, стимулятор регенерации клеток. Ксимедон и его производные, в том числе конъюгат ксимедона с L-аскорбиновой кислотой, уже известны своей способностью восстанавливать ткань печени крыс на модели острого токсического повреждения четыреххлористым углеродом [9]. Однако о гепатопротекторном эффекте ксимедона и его производных при ЛПП мало информации. Таким образом, целью данного исследования была оценка гепатопротекторного эффекта ксимедона и его конъюгата с L-аскорбиновой кислотой при отравлении полулетальной дозой парацетамола и их влияния на биохимические показатели состояния печени мышей. МЕТОДИКА Ксимедон и его конъюгат с L-аскорбиновой кислотой (рис. 1) были получены в лаборатории химии нуклеотидных оснований ИОФХ им. А.Е. Арбузова по описанным ранее методикам [9, 10].
Исследования были проведены на 110 самках мышей линии ICR (CD-1) массой от 28 г до 35 г, полученных из НПП Питомник лабораторных животных ФИБХ РАН (Пущино). Животных содержали в стандартных условиях вивария с 12-ти часовым световым днем и неограниченным доступом к еде и воде. Кормление осуществляли стандартным гранулированным кормом для грызунов. Для оценки гепатопротекторных свойств исследуемых соединений была использована мышиная модель, так как она является наиболее приближенной к состоянию человека [11]. Дизайн эксперимента был разработан на основе работы [12]. Животные были разделены на 10 групп: 1) интактная группа (n = 10), 2) контрольная группа (n = 20), которой вводили только парацетамол в полулетальной дозе 425 мг/кг, и у половины мышей забирали биоматериал спустя 5 часов после интоксикации, 3) 4 группы (n = 10 каждая), получавшие ксимедон в дозах 1, мг/кг 10, мг/кг 100 мг/кг и 200 мг/кг, 4) 4 группы (n = 10 каждая), получавшие конъюгат ксимедона с L-аскорбиновой кислотой в дозах 2.1 мг/кг, 21 мг/кг, 210 мг/кг и 420 мг/кг, содержащие эквивалентные дозы ксимедона. В ходе эксперимента мышей лишали корма за 12 ч до начала эксперимента, затем однократно перорально вводили 17% раствор Твина-80, содержащий парацетамол в полулетальной дозе 425 мг/кг, а в интактной группе эквивалентный объем 17% раствора Твина-80 без парацетамола. Полулетальная доза парацетамола валидировалась для мышей экспериментально. Сразу после введения парацетамола мышам возвращали корм. Через полчаса после введения парацетамола мышам однократно внутрибрюшинно вводили исследуемые соединения. За животными наблюдали в течение 5 дней, после чего проводили эвтаназию путем ингаляционной анестезии 5% изофлураном и отбирали образцы биологического материала для исследований. Для гистологического анализа печень мышей фиксировали в течение суток в 10% забуференном формалине («БиоВитрум», Россия), затем проводили гистологическую проводку при помощи автоматического гистопроцессора Tissue-Tek Vip5 («Sakura», Япония). Срезы ткани печени толщиной 4-5 мкм готовили на ротационном микротоме Accu-Cut SRM 200 («Sakura») и окрашивали гематоксилин-эозином («БиоВитрум», Россия). Визуализацию полученных срезов проводили на световом микроскопе Nikon H550S («Nikon», Япония). Забор крови осуществляли из сердца животного посмертно, затем, для отделения сыворотки, проводили центрифугирование при 3000 об/мин в течение 20 мин при 4°C с помощью центрифуги LMC-4200R («BioSan», Латвия). Активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), уровень глюкозы и общего белка в сыворотке крови мышей определяли с помощью готовых наборов реагентов («Диакон-ДС», Россия) и планшетного спектрофотометра Epoch («BioTech», США). Уровень малонового диальдегида (МДА) определяли в сыворотке крови и гомогенатах печени мыши согласно [13]. Сыворотку крови получали, как описано выше. 10% гомогенаты печени готовили после разморозки, в соответствии с руководством гомогенизатора TissueLiser LT («Qiagen», Германия) с использованием натрий-фосфатного буфера (pH 7.4). Полученные гомогенаты разбавляли так, чтобы концентрация белка в них составляла от 1 мг/мл до 10 мг/мл. Анализ уровня МДА в сыворотке и гомогенатах проводили с использованием 30% раствора трихлоруксусной кислоты (ТХУ) («Вектон», Россия) и 0.8% раствора тиобарбитуровой кислоты (ТБК) («AlfaAesar», США). Реакционную смесь нагревали до 100°C в течение 15 мин, затем охлаждали до комнатной температуры в течение 30 мин и центрифугировали при 5000 g 15 мин с помощью центрифуги Smart R17 Plus («Hanil», Корея). Надосадочную жидкость исследовали с помощью планшетного спектрофотометра Epoch («BioTech») при длине волны 532 нм. Статистическую обработку данных проводили с помощью программы SPSS Statistics. Все данные в статье представлены в виде среднего значения ± стандартная ошибка среднего. Нормальное распределение определялось по критерию Колмогорова-Смирнова. Для статистического анализа полученных данных использовали однофакторный дисперсионный анализ (ANOVA) с апостериорным критерием Тьюки. Различия считали статистически значимыми при p ≤ 0.05. Анализ выживаемости проводили с использованием метода Каплана-Майера. Для сравнения двух кривых выживаемости использовали непараметрический критерий Мантела-Кокса, различия считали значимыми при p ≤ 0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В ходе исследования было показано, что однократное введение парацетамола в дозе 425 мг/кг в контрольной группе приводило к гибели 50% животных в течение 3-х часов после введения (табл. 1). Смерть животных при воздействии парацетамола могла быть связана с его гепатотоксическим эффектом. Известно, что парацетамол метаболизируется в печени посредством цитохрома P450 с последующим образованием токсического соединения N-ацетил-P-бензохинонимина (NAPQI), который в свою очередь приводит к оксидативному стрессу и повреждению гепатоцитов [14].
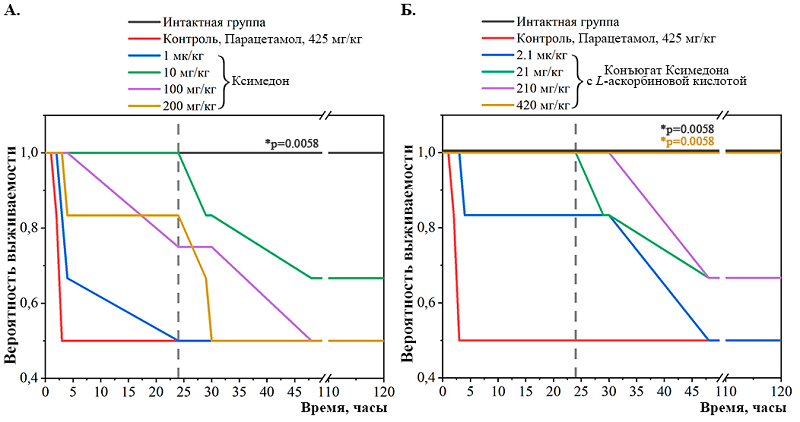
В то время как введение ксимедона в дозе 10 мг/кг спустя полчаса после воздействия парацетамола увеличивало количество выживших животных на 20% относительно контрольной группы. Однако введение ксимедона в дозах 1 мг/кг, 100 мг/кг и 200 мг/кг оказалось неэффективным и приводило к гибели 50% животных аналогично контрольной группе. Тем не менее, воздействие ксимедона во всех дозах достоверно (p <0.05) отсрочило время наступления смерти мышей после отравления парацетамолом в среднем на 25 ч по сравнению с контрольной группой, что может говорить о защитном эффекте данного соединения. Конъюгат ксимедона с L-аскорбиновой кислотой оказал больший эффект на выживаемость мышей после отравления парацетамолом. Так, при однократном внутрибрюшинном введении конъюгата Ксимедона с L-аскорбиновой кислотой в дозах 21 мг/кг, 210 мг/кг и 420 мг/кг происходило увеличение количества выживших животных на 10%, 20% и 50% соответственно по сравнению с контрольной группой. Кроме того, при воздействии конъюгата ксимедона с L-аскорбиновой кислотой во всех дозах увеличивалось время до наступления смерти мышей после отравления парацетамолом в среднем на 58 ч по сравнению с контрольной группой. Это может свидетельствовать о более выраженном защитном эффект конъюгата Ксимедона с L-аскорбиновой кислотой по сравнению с нативной молекулой Ксимедона. Затем был проведен анализ выживаемости мышей по методу Каплана-Майера, позволяющему дать интегральную оценку этого показателя (рис. 2, табл. 2). Было показано, что однократное введение парацетамола в дозе 425 мг/кг в контрольной группе достоверно приводило к снижению среднего значения времени выживания на 48.9% относительно интактной группы животных (χ2 = 7.62, p = 0.0058).
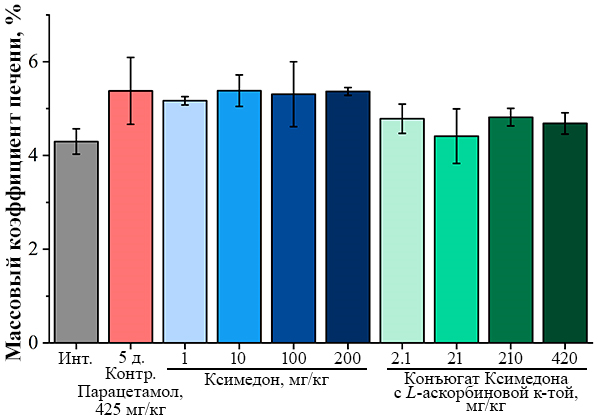
Введение ксимедона в дозах 1 мг/кг, 10 мг/кг, 100 мг/кг и 200 мг/кг способствовало увеличению среднего значения времени выживания мышей, которое не достигало уровня статистической значимости по сравнению с контрольной группой (рис. 2А, табл. 2). Конъюгат ксимедона с L-аскорбиновой кислотой оказал больший эффект на выживаемость мышей после отравления парацетамолом. При дозе конъюгата Ксимедона с L-аскорбиновой кислотой 420 мг/кг увеличение среднего значения времени выживания мышей достигало уровня статистической значимости по сравнению с контрольной группой. Это свидетельствует об усилении эффекта конъюгата ксимедона с L-аскорбиновой кислотой по сравнению с немодифицированной молекулой ксимедона (рис. 2Б, табл. 2). Далее была проведена оценка массового коэффициента и общей морфологии печени. Существенных достоверных изменений массового коэффициента печени среди всех групп отмечено не было (рис. 3). Тем не менее, при введении конъюгата ксимедона с L-аскорбиновой кислотой во всех дозах можно отметить тенденцию к сохранению массового коэффициента неизменным по сравнению с интактной группой.
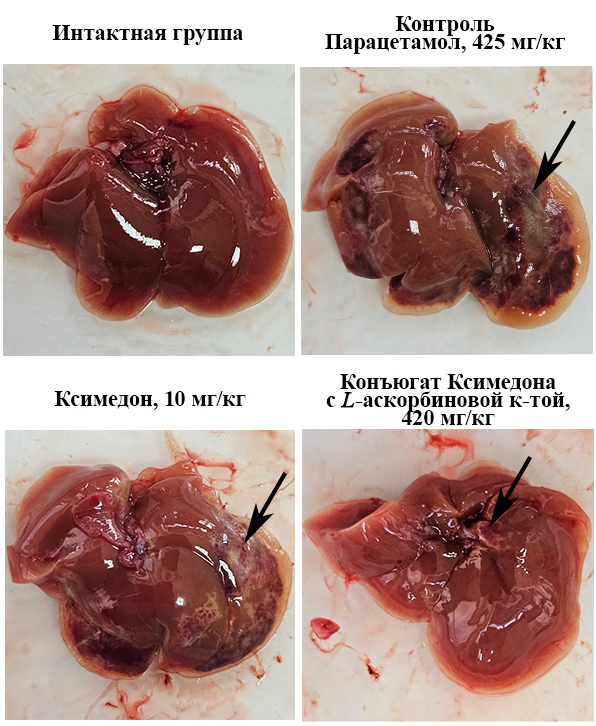
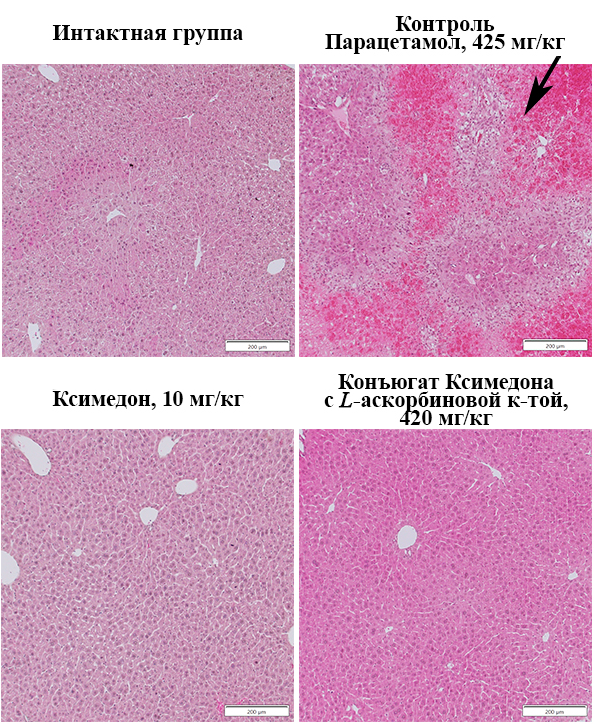
При изучении общей морфологии печени было показано (рис. 4), что спустя 5 дней после однократного введения парацетамола в дозе 425 мг/кг печень характеризовалась наличием обширных очагов некроза и геморрагий по сравнению с интактной группой животных. При этом печень мышей, которым вводили ксимедон и его конъюгат с L-аскорбиновой кислотой в наиболее повышающих выживаемость дозах (10 мг/кг и 420 мг/кг соответственно), характеризовалась значительным уменьшением зон некротических повреждений и геморрагий.
В ходе гистологической оценки ткани печени было показано (рис. 5), что в контрольной группе спустя 5 дней после однократного введения парацетамола в дозе 425 мг/кг отмечены изменения в архитектуре ткани органа по сравнению с интактной группой животных. В ткани печени контрольной группы были выявлены обширные очаги некротических изменений (баллонная дистрофия). При введении ксимедона и его конъюгата с L-аскорбиновой кислотой в наиболее эффективных, повышающих выживаемость дозах 10 мг/кг и 420 мг/кг соответственно, встречались признаки гепатоцеллюлярного повреждения и небольших некротических очагов, менее обширные по сравнению с контрольной группой.
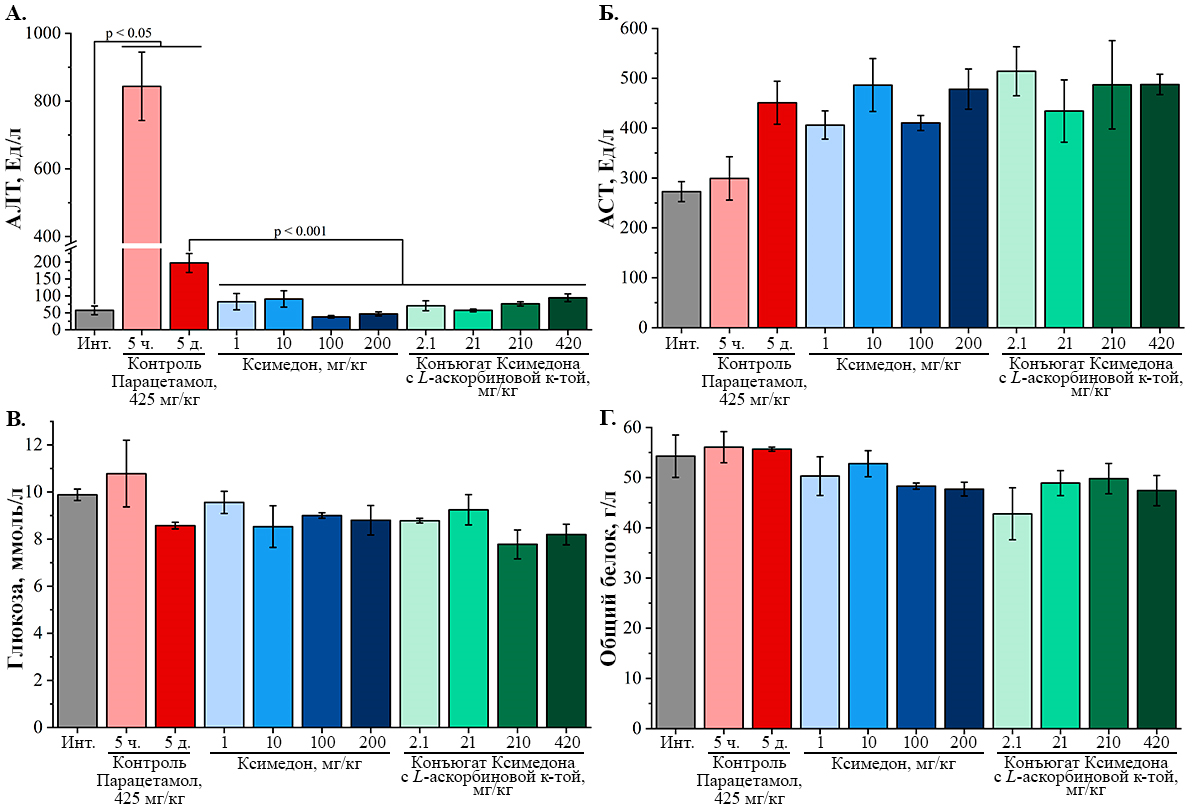
Также были оценены основные биохимические параметры функционального состояния печени мышей: активность сывороточных АЛТ, АСТ, концентрация глюкозы и общего белка (рис. 6) [15]. Через 5 ч после однократного введения парацетамола в дозе 425 мг/кг происходило значимое (p = 0.0002) увеличение активности АЛТ в 15 раз по сравнению с интактной группой, что говорит о развитии повреждения гепатоцитов, которое могло стать причиной гибели животных (рис. 6А). Через 5 дней после введения парацетамола в дозе 425 мг/кг также сохранялась повышенная в 3 раза (p = 0.047) активность АЛТ по сравнению с интактной группой. Однократное введение Ксимедона в дозах 1 мг/кг, 10 мг/кг, 100 мг/кг и 200 мг/кг приводило к значимому снижению активности АЛТ в 2.4 раза (p = 0.003), в 2.2 раза (p = 0.001), в 5.2 раза (p = 0.006) и в 4.2 раза (p = 0.001) соответственно по сравнению с контрольной группой. Важно отметить, что Ксимедон в дозах 100 мг/кг и 200 мг/кг восстанавливал активность АЛТ до уровня референсных значений здоровых мышей линии ICR (CD-1), которые составляют 25-76 Ед/л [16].
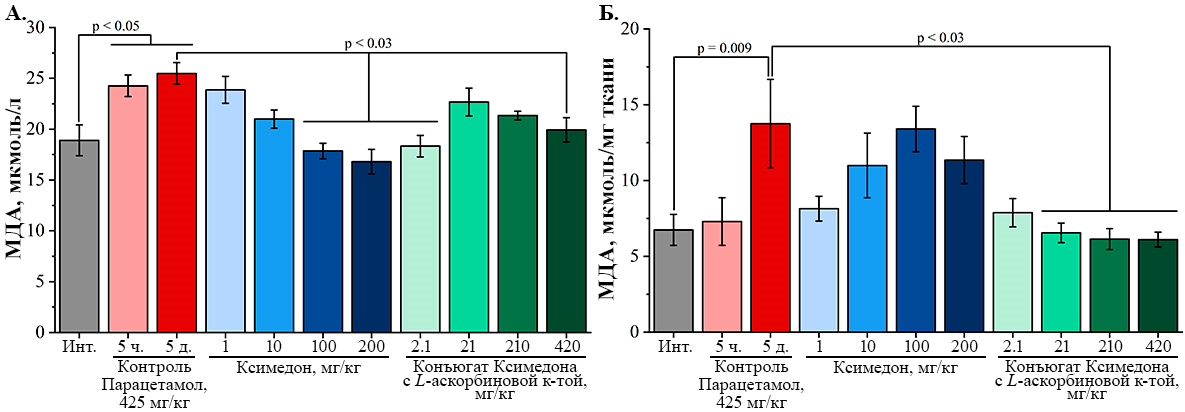
При введении конъюгата Ксимедона с L-аскорбиновой кислотой в дозах 2.1 мг/кг, 21 мг/кг, 210 мг/кг и 420 мг/кг также было показано достоверное снижение активности АЛТ в 2.8 раза (p = 0.0007), в 3.6 раза (p = 0.002), в 2.8 раза (p = 0.0009), в 2.1 раза (p = 0.0003) соответственно по сравнению с контрольной группой. При этом, конъюгат Ксимедона с L-аскорбиновой кислотой в дозах 2.1 мг/кг, 21 мг/кг, 210 мг/кг также восстанавливал активность АЛТ до уровня референсных значений здоровых мышей линии ICR (CD-1) [16]. Таким образом, снижение активности АЛТ при однократном введении изучаемых соединений говорит о проявлении гепатопротекторного эффекта исследуемых соединений при отравлении парацетамолом. Кроме того, данный гепатопротекторный эффект соединений может объяснять увеличение среднего значения времени выживания мышей, показанного выше. В случае маркера цитолиза клеток АСТ, было показано (рис. 6Б), что спустя 5 дней после однократного введения парацетамола в дозе 425 мг/кг отмечено недостоверное (p = 0.19) повышение активности АСТ в 1.7 раз по сравнению с интактной группой. В опытных группах, которым вводили Ксимедон и его конъюгат с L-аскорбиновой кислотой, также наблюдалась высокая активность АСТ, сопоставимая с контрольной группой. Повышенная активность АСТ в исследуемых группах может свидетельствовать о повреждениях в других органах помимо печени [15]. Статистически значимых отличий между опытными группами при изучении биохимических показателей метаболической функции печени – концентрации глюкозы и общего белка, обнаружено не было (рис. 6В, 6Г). Одним из важных показателей развития окислительного стресса/перекисного окисления липидов (ПОЛ) является уровень МДА в биологических образцах [17]. В ходе оценки уровня МДА в сыворотке крови было показано (рис. 7А), что спустя 5 часов после однократного введения парацетамола в дозе 425 мг/кг происходило значимое увеличение уровня МДА на 28.6% (p = 0.049) по сравнению с интактной группой. Статистически значимое увеличение уровня МДА на 34.9% (p = 0.019) наблюдалось и спустя 5 дней после однократного введения парацетамола по сравнению с интактной группой, что свидетельствует о развитии окислительного стресса у животных.
Введение ксимедона в дозах 1 мг/кг и 10 мг/кг приводило к незначительному снижению уровня МДА на 5 день наблюдения по сравнению с контрольной группой. При этом, введение ксимедона в дозах 100 мг/кг и 200 мг/кг способствовало статистически значимому снижению уровня МДА на 29.8% (p = 0.013) и 34.1% (p = 0.0004) соответственно по сравнению с контрольной группой. Введение конъюгата ксимедона с L-аскорбиновой кислотой в дозах 2.1 мг/кг и 420 мг/кг также приводило к значимому снижению уровня МДА на 28.1% (p = 0.003) и 21.8% (p = 0.026) соответственно по сравнению с контрольной группой. При этом, воздействие конъюгата ксимедона с L-аскорбиновой кислотой в дозах 21 мг/кг и 210 мг/кг также незначительно снижало уровень МДА на 11.0% (p = 0.892) и 16.3% (p = 0.341) соответственно по сравнению с контрольной группой. Таким образом, ксимедон и его конъюгат с L-аскорбиновой кислотой способствовали снижению системного окислительного стресса, вызванного парацетамолом. В ходе оценки уровня МДА в гомогенатах ткани печени мышей было показано, что через 5 часов после однократного введения парацетамола в дозе 425 мг/кг не наблюдалось значимого повышения уровня МДА по сравнению с интактной группой (рис. 7Б). Однако на 5 день после введения парацетамола в дозе 425 мг/кг происходило значимое (p = 0.009) увеличение показателя МДА на 104.2% по сравнению с интактной группой, что говорит о развитии окислительного стресса в клетках печени. При введении ксимедона в дозах 1 - 200 мг/кг наблюдалось некоторое снижение показателя МДА по сравнению с контрольной группой, которое не достигало уровня статистической значимости. Конъюгат ксимедона с L-аскорбиновой кислотой в дозах 21 мг/кг, 210 мг/кг и 420 мг/кг, в отличие от ксимедона, значимо снижал уровень МДА на 52% (p = 0.03), 55% (p = 0.02) и 56% (p = 0.006) соответственно по сравнению с контрольной группой. Важно отметить, что именно эти дозы конъюгата ксимедона с L-аскорбиновой кислотой приводили к повышению выживаемости мышей при отравлении парацетамолом по сравнению с нативной молекулой ксимедона. Таким образом, можно предположить, что более выраженный эффект на выживаемость мышей при воздействии конъюгата ксимедона с L-аскорбиновой кислотой также мог быть связан с более высокой антиоксидантной активностью конъюгата. Интересно отметить, что изменение уровня МДА в данном исследовании согласуется с данными, полученными при лечении ксимедоном и его конъюгатом с L-аскорбиновой кислотой острого токсического гепатита крыс, вызванного четыреххлористым углеродом [18]. Таким образом, в ходе проведенного исследования было показано, что введение полулетальной дозы парацетамола приводило к серьезному структурно-функциональному повреждению ткани печени мышей с нарушением биохимических показателей, что соответствует литературным данным [19]. Тем не менее, однократное внутрибрюшинное введение ксимедона способствовало значимой задержке наступления смерти мышей, а также имело тенденцию к увеличению среднего времени выживания животных. Это, по-видимому, было обусловлено гепатопротекторным эффектом ксимедона, направленным на восстановление структуры и биохимических параметров функционального состояния печени. При этом, конъюгат ксимедона с L-аскорбиновой кислотой оказал более выраженный эффект по сравнению с исходной молекулой ксимедона. Данный эффект, по-видимому, был связан не только с восстановлением биохимических параметров крови, но также с более выраженной антиоксидантной активностью конъюгата ксимедона с L-аскорбиновой кислотой в ткани печени. Гепатопротекторный эффект Ксимедона, возможно, был обусловлен изменением активности метаболизма клеток и ускорением переработки токсичного метаболита парацетамола NAPQI. Из литературы известно, что ксимедон способен влиять на активность аденилатциклазы и уровень cAMP в клетках [20]. В свою очередь изменение уровня вторичного посредника cAMP может приводить к различным биологическим эффектам, в том числе модулировать процессы воспаления, пролиферации/апоптоза и метаболизма клеток [21]. При этом, конъюгат ксимедона с L-аскорбиновой кислотой способствовал усилению гепатозащитных свойств нативной молекулы. Предположительно, в результате получения молекулы конъюгата ксимедона и L-аскорбиновой кислоты повышается биодоступность соединения. Ускорение преодоления гемато-тканевых барьеров молекулой ксимедона в комплексе с L-аскорбиновой кислотой, возможно, могло осуществляться при взаимодействии с клеточными транспортерами L-аскорбиновой кислоты [22]. Кроме того, известно, что ассоциация различных молекул с аскорбиновой кислотой может повышать их биологический эффект и биодоступность [23, 24]. Показано также, что L-аскорбиновая кислота сама по себе обладает гепатопротекторными свойствами [25] и могла сыграть роль в обеспечении усиления защитного эффекта ксимедона. Однако из литературных данных известно [26], что в моделях отравления парацетамолом L-аскорбиновая кислота проявляет положительный эффект только в дозах, превышающих 1000 мг/кг либо в меньших дозах, но в виде жирорастворимой формы L-аскорбиновой кислоты – аскорбилпальмитата [27]. Из чего следует, что в форме конъюгата ксимедона с L-аскорбиновой кислотой, эффективного в дозах от 21 мг/кг, гепатозащитные свойства аскорбиновой кислоты существенно усиливаются. ЗАКЛЮЧЕНИЕ Ксимедон и его конъюгат с L-аскорбиновой кислотой проявляют гепатозащитный эффект при лекарственных поражениях печени, повышая выживаемость животных после отравления полулетальной дозой парацетамола. Гепатопротекторный эффект данных соединений проявляется в сохранении архитектуры и функционального состояния ткани печени, в том числе происходит восстановление биохимических параметров цитолиза клеток печени – аланинаминотрансферазы и маркера перекисного окисления липидов – малонового диальдегида. Конъюгат ксимедона с L-аскорбиновой кислотой проявляет более выраженные гепатозащитные свойства по сравнению с исходным соединением. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Животных содержали в соответствии с положениями руководства по доклиническим испытаниям под редакцией А.Н. Миронова [28] при свободном доступе к корму и воде и 12-часовом световом дне, регулируемом автоматически. Все исследования и протоколы по работе с животными были одобрены Комиссией по Биоэтике ФИЦ КазНЦ РАН (Протокол № 24/1 от 4 октября 2024 года). ФИНАНСИРОВАНИЕ Работа выполнена в рамках финансирования Государственного задания № 122011800131-8 Федерального исследовательского центра «Казанского научного центра Российской академии наук». КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов по представленной статье. ЛИТЕРАТУРА
|