|
К ВОПРОСУ О МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ МЕХАНИЗМАХ ВЗАИМОДЕЙСТВИЯ ОСТЕОБЛАСТОВ КОСТНОЙ ТКАНИ С БИОЛОГИЧЕСКИМИ МАТЕРИАЛАМИ ПРИ ОСТЕОПЛАСТИКЕ Самарский государственный медицинский университет, Научно-исследовательский институт биотехнологий, 443079, Самара, ул. Чапаевская, 89; *e-mail: tatjana.medv@rambler.ru Ключевые слова: остеобласты; клеточная адгезия; активация репаративных процессов; сигнальные пути и каскады ферментативных реакций DOI: 10.18097/BMCRM00262 ВВЕДЕНИЕ Костнопластические материалы уже давно успешно используются в медицинской практике с целью активации репаративных процессов и ускорения восстановления структуры и функции кости. Значительное число работ, появившихся в последнее время и имеющих отношение к разработке проблем восстановительных процессов в костной ткани при замещении дефектов биологическими пластическими материалами, в той или иной степени направлено на изучение внутриклеточных событий, лежащих в основе морфологических изменений. Акцент исследований в этой области смещается в направлении изучения молекулярно-генетических механизмов, собственно и определяющих процессы регенерации.
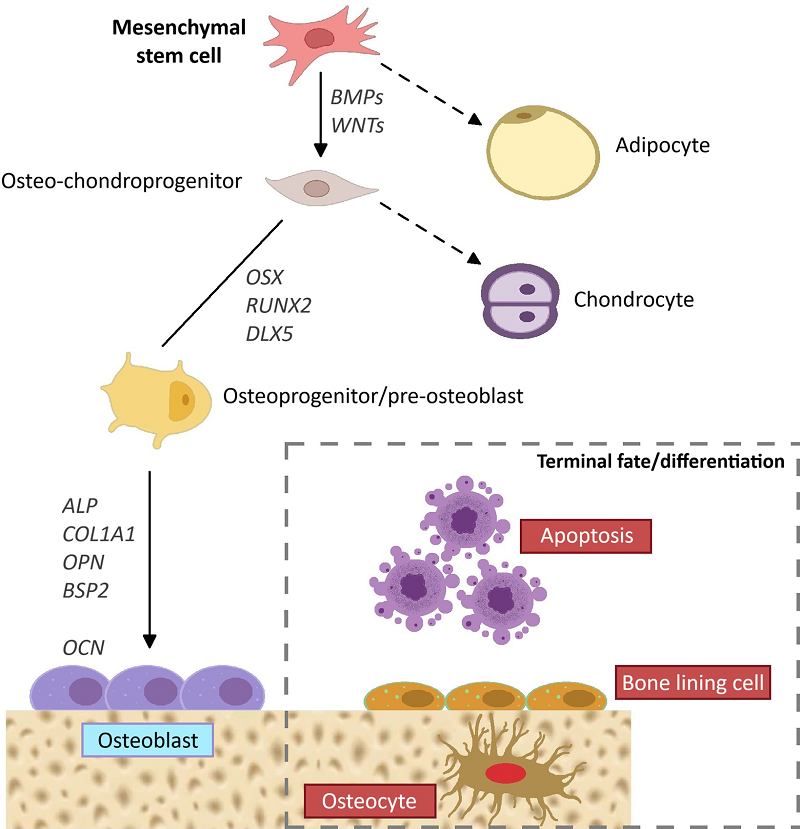
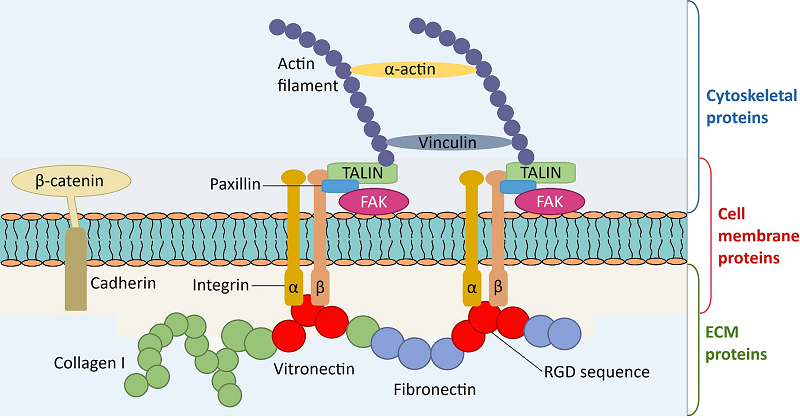
Становится все более очевидным, что адгезия остеобластов на биологических материалах является ключевым этапом в передаче физико-химических сигналов из биоматериалов в остеобласты, тем самым инициируя каскад остеоинтеграции и регулируя взаимодействия между остеобластами и биологическими материалами [1-3] (рис. 1). Установлено, что остеобласты вначале взаимодействуют с биологическим материалом опосредованно через специфические белки внеклеточного матрикса (extra-cellular matrix - ЕСМ), особенно витронектин, фибронектин и коллаген I типа (рис. 2) [4]. Немедленно, в течение нескольких секунд, опережая прямой контакт остеобластов с имплантатом, белки ЕСМ крови могут сорбироваться на поверхности биологического материала [5]. Благодаря слабым физико-химическим взаимодействиям (водородным связям, ван-дер-ваальсовым взаимодействиям, электростатическим силам) между поверхностными молекулами подложки и белками возникает так называемый экстраматериальный матрикс [4-5]. Из белков ЕСМ крови на биологических материалах обнаруживают также альбумин, фибриноген, иммуноглобулины и ряд других. Таким образом, именно образование «белкового слоя» на имплантатах способствует адгезии остеобластов [6].
Остеобласты соединяются с белками ЕСМ с помощью специфической последовательности RGD - трипептида Arg-Gly-Asp, характерного для витронектина, фибронектина, коллагена I типа, остеопонтина, костного сиалопротеина, тромбоспондина. RGD-последовательность является основным лигандом, который взаимодействует с мембранными белками остеобластов (в основном интегринами), обеспечивая клеточную адгезию [5, 7]. Передаваемые через интегрины сигналы могут затем активировать первоначальную сборку ряда белков цитоскелета. Цитоскелетные белки клеточной адгезии остеобластов высокоорганизованны как сеть взаимосвязанных белков вблизи периферии клеток и образуют так называемые фокальные пластинки. Такие пластинки обеспечивают сильную адгезию к биологическим материалам и состоят из набора молекул, включая талины, киндлин, винкулин, α-актин, интегрин-связанную киназу (ILK), а также киназу фокальной адгезии (FAK) [8]. Созревание фокальных пластинок может со временем окончательно стабилизировать остеобласты на поверхностях биологических материалов и трансдуцировать сигналы в цитоскелетную сеть и ядро [9]. 1. ТРАДИЦИОННЫЕ ПУТИ ОСТЕОГЕННОЙ ДИФФЕРЕНЦИРОВКИ 1.1. Сигнальные пути, связанные с интегрином Связанные с интегрином сигнальные пути могут быть разделены на два типа: сигнальные пути, зависимые от комплекса Src-FAK, и сигнальные пути, не зависимые от комплекса Src-FAK. Сигнальные пути, зависимые от комплекса Src-FAK
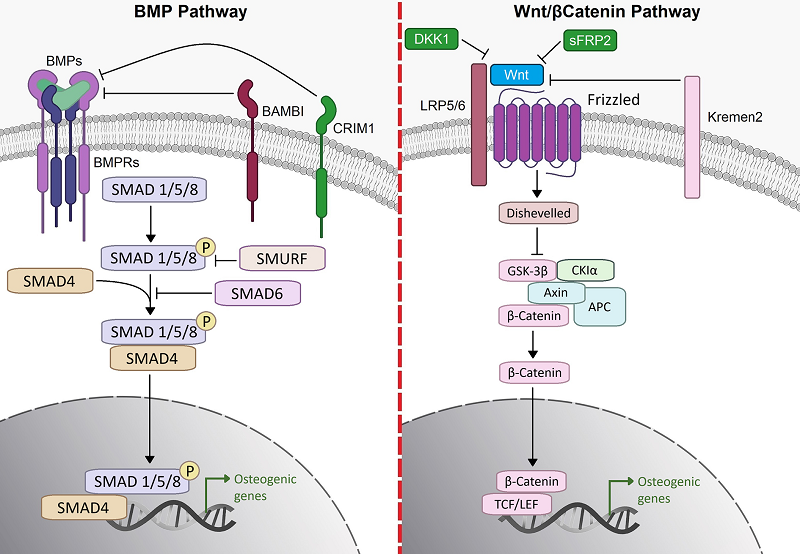
PI3K/Akt/mTOR сигнальный путь. Это внутриклеточный сигнальный путь, главными компонентами которого являются ферменты: фосфоинозитид-3-киназа (PI3K), протеинкиназа В (РКВ), также известная как Аkt, и киназа mTOR. Играет роль единого универсального механизма передачи пролиферативного сигнала на аппарат трансляции, ответственного в клетках за интеграцию пролиферативных стимулов и одновременную активацию трансляции. Рецепторные тирозинкиназы (RTK), экстрацеллюлярные домены которых связываются с лигандом, активируют PI3K I класса. Фосфорилирование сайтов Tyr397 FAK может затем создать домен SH2 и рекрутировать субъединицу р85 PI3K. Вслед за этим PI3K фосфорилирует Akt с помощью PDK-1, что приводит к активации комплекса mTOR 1 (mTORC1). Akt активирует mTOR-комплекс 1 (mTORC1) с помощью многозонного фосфорилирования TSC2 в комплексе TSC1-TSC2, и это блокирует способность TSC2 действовать как GTPазу-активирующий белок (GAP, GTPase activating protein) для Rheb, что позволяет накапливать Rheb-GTP. Rheb-GTP активирует mTORC1, который фосфорилирует нижестоящие мишени, такие как 4Е-ВР1, и гидрофобную последовательность на S6-киназах. mTORC1 регулирует инициирование трансляции и биогенез рибосом на S6K1 и 4Е-ВР1, что усиливает адгезию и пролиферацию остеобластов [11]. В дополнение к своей относительно прямой роли в формировании кости через mTOR, Аkt представляет собой киназу семейства AGC, которая также может фосфорилировать другие семейства субстратов, что имеет решающее значение для формирования кости. Среди них группа транскрипционных факторов Forkhead (FOXO). Эти транскрипционные факторы не специфичны для остеобластов в отличие от других ядерных факторов, таких как RUNX2, OSTERIX и ATF4. Именно транскрипционные семейства FOXO1, FOXO3 и FOXO4 группы Forkhead высоко экспрессируются в хондроцитах и остеобластах. Активированная киназа Аkt может фосфорилировать FOXO и контролировать их транскрипционную активность, сохраняя их в цитоплазме и не способствуя их транспорту в ядро. Кроме того, Аkt в сочетании с костным морфогенетическим белком 2 (ВМР2) опосредует дифференцировку остеобластов из мезенхимальных стромальных клеток (МСК) [12]. Ras-MAPК/ERK1/2 сигнальный путь. Первичный сигнальный путь, связанный с комплексом Src-FAK, регулирует выживаемость, пролиферацию и дифференцировку остеобластов. После активации посредством интегринов фосфорилирование сайтов Tyr925 комплекса Src/FAK может обеспечить связывание комплекса Grb2-SOS и индуцировать преобразование Ras-GDP в Ras-GTP [13]. Активация Ras может способствовать экспрессии таких белков ЕСМ, как фибронектин, витронектин и коллаген I типа. Экспрессия осуществляется через активацию экстрацеллюлярной сигнальной киназы 2 (ERK2) [14]. По данным Ge и соавт., фосфорилирование FAK ведет к фосфорилированию и активации RUNX2 – ключевого транскрипционного фактора в остеобластах [15]. Введение RUNX2 в мезенхимальные стволовые клетки стимулирует дифференцировку остеобластов. Напротив, сверхэкспрессия RUNX2 в остеобластах с коллагеновыми позициями типа I блокирует терминальную дифференцировку и увеличивает резорбцию кости. Эти данные показывают, что RUNX2 необходим для спецификации линии остеобластов из мезенхимальных предшественников, но уровни RUNX2 должны быть жестко отрегулированы в костных клетках [16]. Сигнальный путь p130Сas-RhoA GTP-аза. Было также обнаружено, что комплекс Src-FAK может влиять на структуру цитоскелета и морфологию клеток и дополнительно регулировать адгезию, распространение и полярность клеток остеобластов. Обогащенные пролином области (PPR) опосредуемого интегрином комплекса Src/FAK могут связывать белки, содержащие домен Srchomology-3 (SH3), такие как p130 Crk-ассоциированный субстрат (p130Cas), что приводит к активации RhoA-GTPазы и способствует сокращению клеток, регулируя реорганизацию цитоскелета [17]. Сигнальные пути, не зависимые от комплекса Src-FAK
Помимо этого, существуют сигнальные пути, действие которых активируется вне зависимости от комплекса Src-FAK. Для подобных сигнальных путей важным регуляторным фактором является ILK [18]. Клеточно-матриксные взаимодействия в основном опосредуются интегринами, которые распознают и связывают специфические субстраты (например, фибронектин и коллаген I типа) и передают информацию от ЕСМ внутрь клетки. Связывание лиганда с интегринами приводит к образованию высокодинамичных комплексов прикрепления ЕСМ, называемых комплексами фокальной адгезии (FA), состоящими из каркасных белков, актиновых филаментов и сигнальных белков. Среди белков, которые образуют FA и тем самым структурно и функционально связывают интегрины с актиновым цитоскелетом, выявляются киназа фокальной адгезии (FAK) и киназа, связанная с интегрином (ILK). В отличие от FAK роль ILK менее охарактеризована. Известно, что ILK связывает цитоплазматические домены субъединиц интегрина ß1 и ß3 и служит каркасом для некоторых других компонентов комплекса FA, которые взаимодействуют с актином. В клеточной адгезии, опосредованной интегрином, ILK сочетает как структурные, так и сигнальные функции. Соединяя интегрин с актином, ILK проявляет свойства молекулы-адаптера, образуя тройной комплекс с парвином и богатым цистеином и гистидином белком PINCH. Этот комплекс получил название IPP (ILK-PINCH-parvin). В опытах in vitro показано, очищенная ILK функционирует как киназа серин/треонинового типа, регулирующая фосфорилирование киназа-гликоген-синтазы -3ß (GSK-3ß) (по Ser9) и протеинкиназы В/Akt) (по Ser473) [18]. 1.2. Кадгерин/катенин – сигнальные пути В качестве других важных клеточных мембранных белков кадгерины могут также служить сигнальными молекулами трансдукции (рис. 3) и опосредуют несколько важных клеточных активностей. Хорошо известно, что связь ß-катенина с цитоплазматическими доменами кадгеринов играет ключевую роль в сигнальных путях, связанных с кадгеринами [19]. Сверхэкспрессия N-кадгерина ингибирует остеогенную дифференцировку МСК посредством негативной регуляции сигнальных путей β-катенина и ERK1/2. Основной механизм ингибирования остеогенеза N-кадгерином может заключаться в подавлении сигнальных путей β-катенина и ERK1/2. что приводит к уменьшению транслокации ß-катенинов в ядро [19]. Также было обнаружено, что кадгерин-2 подавляет канонические сигнальные пути Wnt (жизненно важные для остеогенной дифференцировки) из-за удержания ß-катенина в цитоплазме остеобластов [20-21]. По современным представлениям β-катенин – это белок, участвующий в клеточной адгезии и в регуляции экспрессии генов. В клеточной адгезии β-катенин выполняет свои функции, соединяя цитоплазматическую часть кадгерина с α-катенином и F-актином. При регуляции экспрессии генов β-катенин выступает в качестве внутриклеточного передатчика сигнала в сигнальном пути Wnt, играющем важную роль в эмбриональном развитии и гомеостазе тканей [22].
Таким образом, помимо осуществления физического прикрепления остеобластов к биоматериалам, клеточная адгезия также приводит к активации нескольких сигнальных путей, из которых связанные с интегринами и кадгеринами сигнальные пути являются наиболее важными. В то время как сигнальные пути, связанные с интегринами, всегда оказывают положительное влияние на процессы адгезии остеобластов, сигнальные пути кадгерина могут подавлять сигнальные пути Wnt/β-катенин и ингибировать дифференцировку остеобластов. Это свидетельствует о том, что адгезия остеобластов играет центральную роль в инициировании раннего каскада остеоинтеграции путем регулирования задействованных путей передачи сигналов клеток, определяя исход ранней остеоинтеграции. 2. РОЛЬ РНК В ДИФФЕРЕНЦИРОВКЕ ОСТЕОБЛАСТОВ Хотя на сегодняшний день многое известно о классических путях детерминации и терминальной дифференцировки остеобластов, существует ряд новых способов, с помощью которых этот процесс контролируется и настраивается в соответствии с постоянно меняющимися потребностями организма. Они обобщены в обзорной работе [23], в которой приводятся данные о различных типах РНК, оказывающих влияние на процессы дифференцировки остеобластов. Некодирующая РНК (нкРНК) – это общий термин, относящийся к любой РНК, которая не транслируется в белок. Гены, кодирующие эти виды РНК, находятся в неэкзонной области генома, которая составляет подавляющую часть генетического материала сложных организмов. За прошедшие годы было открыто множество различных семейств нкРНК, включая микроРНК (miRNA), длинные некодирующие РНК (lncRNA), малые ядрышковые РНК (minRNA), малые ядерные РНК (minsRNA) и недавно открытые кольцевые РНК (circRNAs). В дифференцировке остеобластов участвуют miRNAs, lncRNAs и circRNAs. Наиболее полно охарактеризован класс молекул miRNA, которые в среднем состоят из 22 нуклеотидов и появляются в результате транскрипции специфических последовательностей ДНК, кодирующих более длинный первичный предшественник. который затем процессируется в предшественник miRNA. Сообщается, что некоторые miRNAs оказывают влияние на ВМР и Wnt пути дифференцировки остеобластов, тем самым нарушая или благоприятствуя дифференцировке [24]. Так, семейство miR-29, а именно miR-29а и miR-29b, увеличивается во время остеобластогенеза, тем самым способствуя формированию кости на ранних этапах за счет подавления ключевых ингибиторов пути Wnt [25]. Показано также, что во время индуцированной ВМР-2 остеогенной дифференцировки miR-133 и miR-135 подавляются, что приводит к ингибированию ключевых проостеогенных факторов RUNX2 и SMAD5, причем SMAD5 является ключевой молекулой в передаче сигналов ВМР. Двумя другими важными miRNAs, которые регулируют путь RUNX2, являются miR-2861 и miR-3960. Первый воздействует на гистондеацетилазу НДАС5, снижение активности которой приводит к повышенному накоплению RUNX2. Аналогичный эффект был выявлен для miR-3960, которая действует на репрессор RUNX2 Homeobox А2 (HOXA2). Другим непрямым регулятором RUNX2 является miR-15b, которая воздействует на SMAD Ubiquitination Regulatory Factor 1 (SMURF1) (Регуляторный фактор убиквитинирования), предотвращая убиквитинирование RUNX2. Ряд miRNAs непосредственно влияют на RUNX2, тем самым способствуя снижению остеогенной дифференцировки. Ключевые примеры: miR-338-3р и miR-637 [26]. Совершенно другой транскрипт, который, однако, приводит к сходным эффектам, является мишенью miR-138: киназа FAK. Длинные некодирующие РНК содержат от 200 до более 10000 нуклеотидов. Значительная длина таких РНК позволяет им быть универсальными молекулами с описанными функциями, простирающимися от контроля транскрипции и трансляции мРНК, посттрансляционных модификаций до определения структуры хроматина [27]. Они могут также предоставлять сайты связывания для специфических miРНК. Хотя это семейство РНК менее изучено, чем miRNAs, в последние несколько лет появились сообщения, предполагающие роль этого класса в дифференцировке остеобластов[28]. Так, например, новая lncRNA, названная lncRNA-1, способствует дифференцировке остеобластов, приводя к активации нескольких основных регуляторов остеогенеза, включая RUNX2 и SP7. РНК 111050 является еще одним особенно интересным примером, способным усиливать остеогенную дифференцировку МСК за счет активации нескольких ключевых факторов, в том числе OСN, COL 1A2, OPN и RUNX2. Примечательна также lncРНК HOTAIR: уровни ее экспрессии снижены при ВМР-2-индуцированной остеогенной дифференцировке, а ее избыточная экспрессия снижает экспрессию RUNX2 и COL1A1[29-31]. Область исследования относительно молода, и lncRNAs являются особенно сложными для изучения молекулами; тем не менее, к настоящему времени было получено несколько результатов, связанных с их ролью в остеогенной дифференцировке, и мы ожидаем, что эта область будет расширяться в ближайшем будущем [32]. CircRNAs, в отличие от других ncRNAs, обычно возникают в результате альтернативного сплайсинга кодирующих мРНК, которые ковалентно связаны на 3´- и 5´-концах [33].Хотя механизм действия большинства circRNAs до сих пор неясен, некоторые из них проявляют явные проостеогенные эффекты [34]. Примером может служить hsa-circ0074834, способствующая заживлению костных дефектов [34]. Недавно было показано, что компонент 3 комплекса поддержания минихромосомы, включающий circRNAs (circMCM3AP) и O-маннозилтрансфераза 1 (circ POMT 1), способствует остеогенезу посредством передачи сигналов BMP по механизму, который, по-видимому, зависит от RUNX2, COL 1 и miR-6881-3p [35]. Большинство ncРНК, описанных к настоящему времени, влияют на экспрессию одного или нескольких ключевых генов дифференцировки остеобластов, что объясняет их влияние на этот процесс [28]. В литературе отсутствуют данные, позволяющие рассматривать этапы имплантации и реакцию костной ткани при остеопластике на примере различных семейств РНК. Однако, предполагая в перспективе появление и расширение исследований о роли РНК в постимплантационном остеогенезе, мы достаточно подробно остановились на вопросе связи известных семейств РНК и дифференцировки остеобластов. Таким образом, прикрепление клеток на поверхности биологических материалов, используемых для имплантации, оказывает заметное влияние на успешное восстановление кости. Поверхности биологических материалов генерируют сигналы, которые могут быть распознаны и трансдуцированы посредством трансмембранных факторов адгезии внутрь клетки. Благодаря такому механизму генерируемые сигналы затем активируют ряд транскрипционных факторов для регулирования родственного гена и экспрессии белка. 3. ИЗУЧЕНИЕ МЕХАНИЗМА РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ Разрабатываемая в Научно-исследовательском институте биотехнологий Самарского государственного медицинского университета программа комплексного изучения костнопластических материалов включает изучение морфологическх характеристик, химического состава, микроструктурных и биохимических свойств, адгезии клеток к их поверхности. Исследования показали, что технологии, используемые при производстве костнопластических материалов в «Лиопласт»Т, обеспечивают сохранение полного комплекса биологически активных компонентов используемых тканей, что способствует созданию оптимальных условий для генетически запрограммированной физиологической регенерации в организме человека [36]. Микроструктурные и биохимические свойства таких материалов анализировали с помощью сканирующей электронной микроскопии, микрокомпьютерной томографии, рамановской спектроскопии и протеомного анализа. Свойство клеточной адгезии имплантатов оценивали с использованием клеточных культур и флуоресцентной микроскопии. Микроструктурный анализ выявил иерархическую пористую структуру материала с полным удалением клеточного дебриса и компонентов костного мозга. Протеомный анализ подтвердил сохранение коллагена и внеклеточных белков, стимулирующих и ингибирующих клеточную адгезию, пролиферацию и дифференцировку. Спектроскопия комбинационного рассеяния позволила установить, что коллаген является основным белковым компонентом имплантатов и образует фибриллярный каркас костного матрикса. Протеомный анализ деминерализованной губчатой ткани человека показал наличие коллагена и белков внеклеточного матрикса. Выявлены пять основных типов коллагена (I, IV, VI, XII, XIV), фибронектин, витронектин, остеопонтин, матричный Gla-белок, трансформирующий фактор роста TGF-β1, мимекан, костный сиалопротеин 2 и ряд других белков в органическом матриксе спонгиозы человека [36]. Костные имплантаты, таким образом, могут служить источником биологически активных соединений, важных для ранней остеоинтеграции. Молекулярная и редуцированная формы коллагена в имплантате в таком случае могут проявлять себя как сигнальные молекулы, запускающие каскады ферментативных реакций и внутриклеточные сигнальные пути [37]. Использование масс-спектрометрического анализа позволило также выявить в составе получаемых костно-пластических материалов ДНК - связывающие транскрипционные факторы (белки цинковых пальцев 267, 394, 585) и РНК – связывающий белок ELAVL3, стабилизирующий мРНК; эти белки принимают участие в клеточной дифференцировке [38]. Наряду с этим обнаружен репрессор транскрипции CRY1, являющийся главным компонентом циркадных часов. Циркадные часы регулируют различные физиологические процессы путем генерации 24-х часовых ритмов генной экспрессии, влияя на особенности метаболизма и поведения. Регулятор комплексов гистонметилтрансферазы JARID2 участвует в дифференцировке стволовых клеток и нормальном эмбриогенезе, включая сердце, развитие нервной трубки и кроветворение. Мембранный рецептор коллагена, интегральный трансмембранный гликопротеин интегрин альфа-10 Integrin alpha-10 ITGA10, состоящий из нековалентно связанных α- и β-цепей, участвует в клеточной адгезии, а также в опосредованной поверхностью клеток передаче сигнальной информации. Дифференциальный характер экспрессии интегрина опосредован факторами роста и дифференциации[38]. Результаты выполненных исследований свидетельствуют о наличии в составе исследуемых аллогенных костнопластических материалов важных компонентов, обеспечивающих синтетические процессы и клеточную дифференцировку, которые служат основой для проявления функциональной активности костной ткани. Изучение состава и функциональных особенностей пластических материалов позволяет вывести подобные исследования на новый уровень – создание модели взаимодействия имплантат – костная ткань. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. ФИНАНСИРОВАНИЕ Авторы заявляют об отсутствии внешних источников финансирования. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|