|
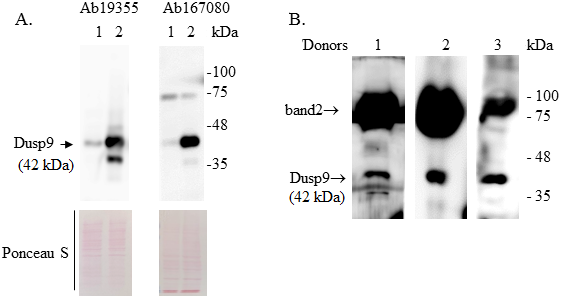
ДЕТЕКЦИЯ СУПРЕССОРА ОПУХОЛЕЙ ПОЧКИ DUSP9 В МОЧЕ ЗДОРОВЫХ ДОНОРОВ Российский научный центр радиологии и хирургических технологий имени академика А.М. Гранова, 197758, Санкт-Петербург, п. Песочный, ул. Ленинградская, 70; *e-mail: polischouka@mail.ru Ключевые слова: DUSP9/MKP-4 протеинфосфатаза; карцинома почки; внеклеточные везикулы; экзосомы DOI: 10.18097/BMCRM00267 ВВЕДЕНИЕ DUSP9 (dual specificity phosphatase 9) или MKP-4 (mitogen-activated protein kinase phosphatase-4) принадлежит к семейству протеинфосфатаз, негативно регулирующих ERK1/2, p38 и JNK MAP-киназы, дефосфорилируя их как по остаткам тирозина, так и по серина/треонина. Значительное снижение экспрессии DUSP9 в образцах почечно-клеточной карциномы по сравнению с образцами прилежащей условно нормальной ткани почки впервые было обнаружено в 2002 г, а затем подтверждено на большом количестве клинического материала различными исследовательскими группами [1]. Показано, что 20-80-кратное подавление экспрессии гена DUSP9 отмечено в 95% исследованных опухолевых образцов, в том числе в образцах опухоли, взятых у пациентов на ранних стадиях заболевания [1]. С помощью in vitro и in vivo моделей было продемонстрировано, что DUSP9 обладает онкосупрессорными свойствами [2]. Результаты, полученные нами и другими научными группами, свидетельствуют о том, что DUSP9 участвует в регуляции процессов метастазирования и пролиферации опухолевых клеток, в приобретении опухолевыми клетками резистентного к терапевтическим препаратам фенотипа, а также может быть одной из мишеней для терапевтического воздействия на метастатическую форму карциномы почки [1, 2]. Накопленные данные позволяют предположить, что DUSP9 может быть использован в клинике для диагностических и, возможно, терапевтических целей. В диагностических целях анализ экспрессии DUSP9 может позволить обеспечить раннее выявление опухолей почки, а также мониторирование ответа опухоли на терапевтическое воздействие. Использование DUSP9 в этих целях предполагает наличие образцов жидкостной биопсии. Однако до сих пор единственным клиническим материалом, используемым для исследования DUSP9, были постоперационные биопсийные образцы опухоли почки. В данной работе мы исследовали возможность обнаружения DUSP9 в моче человека. МЕТОДИКА В работе использовали клеточную линию карциномы почки человека ACHN, полученную из опухолевых клеток плеврального выпота пациента с метастатическим раком почки (ATCC®CRL-1611™, “Биолот”, Россия). Условия культивирования клеток, процесс конструирования экспрессионной плазмиды, несущей ген DUSP9, и метод трансфекции клеток сконструированной плазмидой был описан нами ранее [1, 3]. Также в работе использовали свежесобранные образцы дневной порции мочи от 3 здоровых доноров женского пола одного возраста. Для обнаружения DUSP9 белка использовали Вестерн-блот анализ. В образцы мочи добавляли смесь ингибиторов протеиназ (Halt™ Protease Inhibitor Cocktail (HPIC), “ThermoFisher”, США), в количествах, указанных производителем, и центрифугировали их при определенных ускорениях. Фракцию, обогащенную экзосомами, получали методом последовательного центрифугирования. Этот метод считается «золотым стандартом» выделения экзосом и состоит из нескольких последовательных раундов центрифугирования с постепенно возрастающим ускорением [4]. После каждого раунда отбирали супернатант и использовали его в следующем раунде. Последним раундом было ультрацентрифугирование. Центрифугирование проводили по следующей схеме: 400 g (10 мин, 20ºС, осаждение клеток) ® 2000 g (10 мин, 20ºС, фрагменты клеток ) ®10000 g (10 мин, 20ºС, апоптотические тельца и крупные белковые комплексы) ®100000 g (90 мин, 4ºС, нановезикулы, в том числе экзосомы). Полученные после центрифугирования осадки мочи, также как и клетки ACHN, лизировали либо в RIPA буфере (150 мМ NaCl, 50 мМ трис-HCl, (pH 7.5), 1 мМ ЭДТА, 1% (по объему) ТритонХ-100, 0.1% (масса/объем) SDS и HPIC, все реагенты “ThermoFisher”) либо в 1х Laemmli Sample Buffer (“Bio-Rad”, США) c добавлением 50 мМ дитиотреитола. Белки лизатов разделяли в денатурирующем SDS/полиакриламидном (ПАА) геле и переносили на PVDF мембрану (Hybond P, “Cytiva”, США) в трис-глициновом буфере c метанолом (25 мМ трис, 192 мМ глицин, 20% (по объему) метанол (pH 8.3)). Неспецифические сайты связывания антител блокировали путем инкубации мембраны в буфере, содержащем 20 мМ Трис-НСl (pH 7.5), 150мМ NaCl, 0.1% (по объему) Tween 20, 5% (масса/объем) BSA (бычий альбумин, фракция V, “Sigma”, США), после чего мембраны инкубировали в течение ночи при 4ºС с первичными кроличьими антителами к исследуемым белкам. После отмывки от несвязавшихся первичных антител мембраны инкубировали с козьими антителами к кроличьему IgG, конъюгированными с пероксидазой хрена (ab205718). Все антитела получены из “Abcam” (Великобритания). Комплексы антиген-антитело детектировали с использованием SuperSignal™ West Dura Extended Duration Substrate («ThermoFisher») и хемилюменисцентного детектора ImageQuant LAS 4000 (“GE Healthcare”, США). РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Целью работы была попытка обнаружения белка DUSP9 в образцах мочи человека с помощью Вестерн-блот анализа. В научной литературе нет данных об электрофоретической подвижности DUSP9 при разделении белков из лизатов, полученных из клинических образцов. Однако такие данные существуют для белковых экстрактов, полученных из культивируемых клеток человека, в том числе из клеток карциномы почки человека ACHN [1]. Поэтому для контроля эффективности работы Вестерн-блот анализа мы использовали белковые экстракты из ACHN клеток. Ранее мы показали, что уровень DUSP9 белка в ACHN клетках очень низкий [1]. Поэтому в качестве негативного контроля экспрессии DUSP9 были использованы белковые экстракты из этих клеток, а в качестве позитивного – экстракты из ACHN клеток, трансфицированных сконструированным нами ранее экспрессионным вектором, содержащим последовательности кДНК гена DUSP9 [3]. Для детекции были использованы ab167080 и ab194355 антитела к DUSP9. Молекулярный вес DUSP9 белка в экстрактах ACHN клеток, трансфицированных вектором с геном DUSP9, находится между 35 кДа и 48 кДа (рис.1А), что соответствует литературным данным о размерах этого белка (42 кДа) в клетках культивируемых клеточных линий. В ACHN клетках, трансфицированных вектором без гена DUSP9, выявлена полоса небольшой интенсивности, соответствующая размеру DUSP9, отражающая эндогенный уровень DUSP9 белка в самих клетках ACHN. Таким образом, используемые нами условия Вестерн-блот анализа позволяют специфически детектировать DUSP9 в белковых лизатах человеческого биоматериала. Для обнаружения DUSP9 белка в моче человека был протестирован самый доступный для клинических лабораторий метод низкоскоростного центрифугирования. На наличие DUSP9 белка были проанализированы осадки, полученные при одноразовом центрифугировании различного количества мочи (от 1 мл до 15 мл) при разных центробежных ускорениях (400 g, 2000 g, 10000 g, 16000 g), разных температурах центрифугирования (4ºС, 20ºС, 37ºС) и времени центрифугирования (10 мин, 30 мин, 60 мин и 90 мин). Лучший вариант пробоподготовки был выбран на основании сравнения интенсивности DUSP9 полосы с молекулярной массой 42 кДа на Вестерн-блоте. Температура, при которой происходило центрифугирование, не оказывала существенного влияния на результат. Увеличение времени центрифугирования с 10 мин до 30-90 мин также не приводило к улучшению результата. Полоса, соответствующая DUSP9 в области 42 кДа, отсутствовала во фракциях, полученных при 400 g и 2000 g, однако появлялась во фракциях, полученных при 10000 g и 16000 g. В последних двух фракциях интенсивность полосы была одинаковой. Наибольшая интенсивность DUSP9 полосы в 42 кДа была выявлена при объёме пробы мочи 15 мл. На рисунке 1Б представлены результаты анализа осадков, полученных из 15 мл мочи при ее одноразовом центрифугировании в течение 10 мин при 10000 g и температуре 20ºС. Видно, что в пробах мочи детектируется специфическая для белка DUSP9 полоса в 42 кДа. Таким образом, белок DUSP9 в образцах мочи человека можно обнаружить, используя низкоскоростное центрифугирование в сочетании c Вестерн-блот анализом.
На рисунке 1Б также видно, что кроме специфичной для DUSP9 полосы в 42 кДа существует еще одна интенсивная полоса с молекулярной массой между 75 кДа и 100 кДа (полоса 2). Эта полоса отсутствовала на Вестерн-блотах белковых экстрактов из ACHN клеток (рис. 1А). Возможно, появление этой полосы связано с наличием в моче белка Тамма-Хорсфолла, также известного как уромодулин (УМ). Молекулярная масса УМ 95 кДа, что соответствует расположению полосы 2 на SDS-ПАА геле. В моче УМ находится в олигомерном состоянии в виде высокомолекулярных филаментов, образуя полимерную сеть. Показано, что полимерная сеть УМ может захватывать микровезикулы в процессе их осаждения центрифугированием [5]. Поэтому можно предположить, что появление полосы 2 обусловлено захватыванием белка DUSP9 полимерной сетью УМ в процессе центрифугирования, в результате чего DUSP9 визуализируется в том же положении, что и УМ. Также можно предположить, что полоса 2 появляется в результате неспецифического связывания УМ с антителами к DUSP9 белку. Чтобы проверить, так ли это, мы провели иммуноблотинг проб мочи с антителами к 5 другим белкам человека (табл. 1, рис.2). Все антитела кроличьи IgG, так же, как используемые нами антитела к DUSP9. Разведение каждого антитела было выбрано так, чтобы концентрации IgG в пробах были одинаковые. Для контроля неспецифического связывания со вторичными антителами были взяты козьи антитела к кроличьему IgG. Во всех случаях на дорожки SDS-ПАА геля было нанесено одинаковое количество белкового лизата осадка мочи, полученного при одном и том же выделении. Как видно на рисунке 2, полоса 2 присутствует только на дорожке с антителами к DUSP9. С учетом условий эксперимента, этот результат свидетельствует против неспецифического связывания IgG c УМ либо каким-то белком мочи, имеющим в SDS-ПАА геле такую же подвижность, что и УМ. Еще одним предположением о происхождении полосы 2 может быть пострансляционная модификация DUSP9. Известно, что DUSP9 является мишенью для убиквитинирования [6]. Вопрос о происхождении полосы 2 на Вестерн-блоте требует дальнейшего изучения.
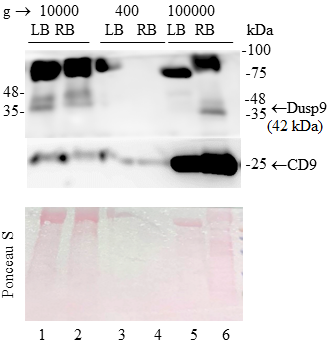
Ранее мы показали, что белок DUSP9 был обнаружен в экзосомной фракции кондиционной среды от ACHN клеток, трансфицированных DUSP9-экспрессирующим вектором [1]. Параллельно, мы показали, что миграционная способность трансфицированных ACHN клеток изменена по сравнению с нетрансфицированными. Вместе результаты свидетельствовали о том, что, по крайней мере некоторые функции DUSP9 могут быть опосредованы экзосомами, продуцируемыми тканями мочевыводящей системы. С учетом предыдущих результатов стояла задача определить, будет ли обнаружен DUSP9 белок во фракции мочи, обогащенной экзосомами. Про экзосомы известно, что они представляют собой мембранные пузырьки, формирующиеся клетками различных тканей и органов и транспортирующими биологически активные молекулы в межклеточном пространстве. Работы многих исследовательских групп указывают на то, что экзосомы, продуцируемые опухолью, играют одну из ключевых ролей в процессе канцерогенеза [7]. На рисунке 3 видно, что фракция мочи, полученная методом последовательного центрифугирования, конечным раундом которого было ультрацентрифугирование при 100000 g, обогащена экзосомами (в лизате содержится большое количество белкового маркера экзосом CD9 по сравнению с другими фракциями) и содержит DUSP9 (полоса 42кДа). Экстракция белков с помощью RIPA буфера, по-видимому, более эффективна, т.к. при использовании Laemmli буфера обнаружить DUSP9 в этой фракции не удалось. Количество обнаруживаемого DUSP9 во фракции 10000 g не зависит от используемого экстракционного буфера. В осадке клеток (400 g) DUSP9 не был обнаружен. Результат свидетельствует о том, что часть DUSP9 белка, находящегося в моче здорового донора, имеет внутринановезикулярное/экзосомальное происхождение.
ЗАКЛЮЧЕНИЕ Используя Вестерн-блот анализ, мы показали, что протеинфосфатаза DUSP9 может быть детектирована в осадках, полученных из 15 мл мочи здоровых доноров, в результате ее центрифугирования при 10000 g в течение 10 мин. Температура, при которой осуществляется центрифугирование, не влияет на результат. Также DUSP9 присутствует в обогащенной нановезикулами фракции, полученной методом последовательного центрифугирования, конечным раундом которого является ультрацентрифугирование при 100000 g и 4ºС в течение 1.5 ч. Таким образом, полученный результат показал, что экспрессия DUSP9 может исследоваться при использовании жидкостной биопсии, что в свою очередь, мы надеемся, значительно расширит возможности использования анализа экспрессии DUSP9 в клинических целях. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследование одобрено этическим комитетом по этике Российского научного центра радиологии и хирургических технологий (протокол № 01-04/2024 от 04 апреля 2024 г.). От здоровых добровольцев получено информированное согласие на участие в исследовании и использовании их биопроб. ФИНАНСИРОВАНИЕ Исследование финансировалось в рамках государственного задания Минздрава РФ №124021600040-2. КОНФЛИКТ ИНТЕРЕСОВ/p> Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|