|
АССОЦИАЦИЯ NADPH–ОКСИДАЗЫ 2 (NOX2) С РАЗВИТИЕМ АТОПИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЫ 1Казанский (Приволжский) федеральный университет,
420008, Казань, ул. Кремлевская 18; *e-mail: Ibragimov94@inbox.ru Ключевые слова: NOX2; NADPH–оксидаза 2; LС3–ассоциированный фагоцитоз; моноциты, атопическая бронхиальная астма DOI: 10.18097/BMCRM00272 ВВЕДЕНИЕ NADPH–оксидаза 2 (NOX2) представляет собой ключевой компонент иммунной системы, обеспечивающий защиту организма путем выработки активных форм кислорода (АФК): супероксид аниона (O2•−), гидроксильного радикала (•OH), пероксида водорода (H2O2) [1]. NOX2 экспрессируется преимущественно в нейтрофилах, моноцитах и макрофагах. Она участвует в процессах хемотаксиса (привлечения лейкоцитов к месту повреждения или инфекции), LC3–ассоциированного фагоцитоза (поглощения и уничтожения инфекционных агентов) и индуцировании респираторного взрыва (резкого увеличения уровня АФК в ответ на бактериальную или грибковую инфекцию). Именно эта способность NOX2 производить АФК лежит в основе процесса LC3–ассоциированного фагоцитоза (LAP) [2, 3]. На начальной стадии созревания фагосомы в ответ на соответствующие сигнальные события, такие как передача сигналов, от рецепторов FcγR и TLR, собирается активный комплекс NADPH-оксидазы, который обеспечивает выработку реакционноспособных видов кислорода (АФК) непосредственно внутри везикулы. Внутри фагосомы АФК продуцируются комплексом NADPH -оксидазы. Rubicon стабилизирует комплекс посредством взаимодействия с p22phox, в то время как p40phox взаимодействует с фосфатидилинозитол-3-фосфат (PI(3)P) для привлечения остальных компонентов. Одновременно цитозольный LC3 подвергается модификации с помощью специального конъюгационного аппарата, приводящего к формированию LC3-II на поверхности фагосомальной мембраны [3]. Вскоре после того, как LC3 соединяется с мембраной фагосомы, образовавшаяся структура быстро сливается с лизосомами, обеспечивая быструю очистку от захваченного материала. Отсутствие эффективного LC3–ассоциированного фагоцитоза (LAP) приводит к нарушению контроля над проникшими патогенами и запускает значительное увеличение продукции провоспалительных цитокинов, таких как IL-6 и IL-1β [4, 5]. Несмотря на важные защитные функции, повышенная экспрессия NOX2 негативно сказывается на организме, вызывая ряд неблагоприятных эффектов. [6]. Путём активации сигнальных путей (MAPK, NF-κB, PI3K/Akt) NOX2 стимулирует выделение провоспалительных цитокинов (IL-6, TNF-α, IL-1β), усиливая воспаление и способствуя хронизации патологического процесса. Эти цитокины усиливают воспаление, привлекая дополнительные иммунные клетки к очагу поражения и обеспечивая дальнейшее распространение воспалительного процесса [7]. Помимо стимуляции выделения провоспалительных цитокинов, повышенная продукция АФК, вызванная активностью NOX2, нарушает механизм LC3–ассоциированного фагоцитоза (LAP). Избыточная продукция АФК подавляет синтез фосфатидилинозитол-3-фосфата (PI(3)P), нарушая нормальный ход образования мембранной оболочки. PI(3)P необходим для привлечения ATG16L1/ATG5 комплекса, который формирует мембрану вокруг частиц-мишеней, инициируя дальнейшее протекание процесса LAP. Таким образом, NOX2 влияет на активность LC3 именно через изменение концентрации PI(3)P [8]. Астма является распространенным хроническим воспалительным заболеванием дыхательных путей. Наличие астмы имеет тенденцию к увеличению выработки активных форм кислорода (АФК), а антиоксидантная система в легких недостаточна для его смягчения. Повышенный уровень АФК может вызывать вредные патофизиологические нарушения астмы [1, 9, 10]. Большинство имеющихся публикаций сосредоточено на общих аспектах окислительного стресса и значении отдельных метаболитов АФК в воспалительном процессе дыхательных путей [11-14]. Целью настоящей работы было установление ассоциации NOX2 с отягощенностью протекания атопической бронхиальной астмы (АБА). МАТЕРИАЛЫ И МЕТОДЫ Характеристика исследуемых групп Объектом исследования были моноциты, выделенные из фракции лейкоцитов. Образцы фракции лейкоцитов здоровых доноров и пациентов с атопической бронхиальной астмой были предоставлены Казанским научно–исследовательским институтом эпидемиологии и микробиологии. Все пациенты находились под наблюдением врачей и не получали медикаментозного лечения во время проведения исследований. Здоровые доноры и пациенты с поставленным диагнозом проживают на территории Республики Татарстан. Каждая степень тяжести характеризовалась своими особенностями течения заболевания и симптоматики. Диагноз атопической бронхиальной астмы устанавливался врачом-пульмонологом на основании клинической картины, истории болезни и соответствующих лабораторных тестов. Постановка диагноза и оценка её степени тяжести осуществлялась на основе критериев, указанных в клинических рекомендациях Global Initiative for Asthma (GINA) [15]. Группа контроля (здоровые участники) включала 15 человек в возрасте от 25 до 32 лет включительно. Для пациентов с лёгкой персистирующей формой аллергической бронхиальной астмы (АБА) характерны редкие эпизоды одышки, возникающие приблизительно один раз в месяц, и только в дневное время. Приступы имели лёгкий характер и легко устранялись самостоятельно либо после единичного приёма бронхолитического препарата (ингаляционного или перорального). Группа пациентов с лёгкой АБА включала 15 человек в возрасте от 29 до 35 лет включительно. Для пациентов со средней персистирующей формой АБА характерны учащенные приступы одышки, возникающие чаще одного раза в неделю, но реже одного раза в сутки. Эпизоды сопровождались изменениями дыхательной функции и требовали однократного приёма бронхолитика и/или внутривенного введения глюкокортикоидов. Группа пациентов со среднетяжёлым течением АБА включала 15 человек в возрасте от 33 до 40 лет включительно. Для пациентов с тяжелой формой АБА характерны ежедневные симптомы и частые обострения, включая ночные приступы одышки. Приступы протекают тяжело и требуют комплексного подхода к лечению, включающего парентеральное введение бронхолитиков в сочетании с глюкокортикоидными препаратами. Группу пациентов с тяжелой АБА составляли 16 человек в возрасте от 25 до 68 лет. Заболевание значительно ограничивает физическую активность и нарушает сон пациента. Выделение моноцитов Выделение моноцитов проводили в два этапа: на первом этапе выделяли общую фракцию лейкоцитов методом центрифугирования в градиенте плотности фиколла (ρ = 1.077 г/мл), («ПанЭко», Россия); на втором этапе проводили обогащение фракции моноцитов методом адгезии [16]. На сегодняшний день для обогащения фракции моноцитов используют несколько основных подходов, отличающихся друг от друга по степени обогащения и жизнеспособности клеток. Среди них: метод обогащения путем адгезии к пластику, метод центрифугирования на градиенте перколла и метод магнитной сепарации с позитивной или негативной селекцией клеток. Однако обогащение методом адгезии является более доступным из указанных вариантов [17]. Обогащение методом адгезии проводили путем культивирования в среде RPMI в течение 2 ч при 37°C и 5% CO2. Не прикрепившиеся клетки отделяли путем удаления надосадочной жидкости, а прикрепившиеся клетки (моноциты) трижды промывали фосфатно–солевым буфером (таблетки фосфатно–солевого буфера, рН 7.4, «ПанЭко») [16]. Степень чистоты моноцитов определяли путем окрашивания суспензии клеток моноклональными антителами к мембранному рецептору CD14, конъюгированными с флуоресцеин изотиоцианатом (FITC Anti–human CD14, «BioLegend», США). Определение уровня АФК АФК определяли в моноцитах здоровых доноров и пациентов с атопической бронхиальной астмой методом проточной цитометрии c использованием DHR–123, адаптированным из ранее опубликованных работ [18-34]. Метод DHR–123 был оптимизирован для обеспечения максимально возможного сигнала флуоресценции, обнаруживаемого в образцах с наибольшей величиной разницы между положительными и отрицательными контролями. Исходный раствор DHR–123 (Dihydrorhodamine–123, «Sigma–Aldrich», США, 5.0 мг DHR–123 в 1.0 мл диметилсульфоксида (DMSO), «Евроген», Россия) хранили в аликвотах по 50 мкл при температуре −70°C. Перед проведением анализа 1 мкл исходного раствора разводили в 99 мкл фосфатно–солевого буфера. Для окрашивания одного образца использовали 20 мкл полученного раствора DHR–123 (50 мкг/мл), что составляет 1 мкг красителя на 100 мкл суспензии клеток (5×105 клеток), или конечный раствор с концентрации 10 мкг/мл [10]. Форбол–12–миристат–13–ацетат (PMA, Phorbol 12–myristate 13–acetate, Sigma–Aldrich, США) растворяли в DMSO. Далее 1 мкл из полученного раствора (1мг/мл) разводили в 199 мкл фосфатно–солевого буфера (раствор с концентрацией 5 мкг/мл). Для положительного контроля одного образца использовали 20 мкл раствора PMA, что составляет 0.1 мкг активатора на стимуляцию 100 мкл суспензии клеток (5×105 клеток). Перед началом анализа клетки инкубировали 10 мин на льду. При анализе на каждый образец использовали две пробы: в качестве отрицательного контроля использовали образец, инкубированный только с DHR–123; в качестве положительного контроля использовали образец, инкубированный с PMA и DHR–123. В первую пробирку FACS или эппендорф (отрицательный контроль) добавляли 20 мкл фосфатно–солевого буфера. Во вторую пробирку (положительный контроль) добавляли 20 мкл PMA (5 мкг/мл – 0.1 мкг на образец). Образцы вортексировали и инкубировали на водяной бане в течение 10 мин при 37 °C. Затем добавляли 20 мкл DHR–123 (50 мкг/мл – 1 мкг на образец) и клетки инкубировали в течение ещё 10 мин. Общее время инкубации составило 20 мин при 37°С на водяной бане в темноте. Затем образцы центрифугировали при 11000 g, а супернатант удаляли. Далее к образцам добавляли фосфатно–солевой буфер (PBS) и промывали клетки центрифугированием. Окислительное превращение дигидрородамина–123 (DHR–123) во флуоресцентный родамин–123 (Rho-123) определяли на проточном цитометре FACSCalibur («Becton Dickinson», США). Флуоресценция Rho-123, возникающая при окислении DHR–123, детектируется на канале FL1 (525 нм). Анализ медианы и геометрического среднего (gMean) интенсивности флуоресценции родамина–123 (Rho–123) проводили в программе FLOWJO согласно указанным протоколам [18, 27, 31]. Определение уровня экспрессии гена NOX2 Анализ уровня экспрессии гена NOX2 в моноцитах здоровых доноров и пациентов с атопической бронхиальной астмой проводили методом ОТ–ПЦР. Выделение РНК проводили фенол–хлороформным методом с использованием коммерческого реагента для выделения суммарной РНК из биологических образцов ExtractRNA («Евроген») согласно инструкции производителя. К клеткам добавляли 1 мл ExtractRNA, с последующим пипетированием и тщательным перемешиванием с помощью вортекса. Далее клетки лизировали при комнатной температуре в течение 10 мин, для полной диссоциации нуклеопротеидных комплексов. Затем центрифугировали лизат в течение 10 мин при 11000 g при комнатной температуре. Не касаясь осадка, аккуратно переносили супернатант в новую пробирку. К супернатанту добавляли 0.2 мл хлороформа, с последующим центрифугированием в течение 10 минут при 11000 g при комнатной температуре. В ходе центрифугирования происходило разделение смеси на три фазы: нижнюю – органическую фенол–хлороформную фазу желтоватого оттенка, интерфазу белого цвета и верхнюю бесцветную водную фазу содержащую РНК. Водную фазу отбирали под наклоном пробирки 45°, не касаясь интерфазы. К водной фазе добавляли 0.5 мл хлороформа с повторным центрифугированием в течение 10 мин при 11000 g при комнатной температуре. Далее верхнюю водную фазу переносили в чистую пробирку; добавляя 0.5 мл 100% изопропанола, с аналогичным центрифугированием при тех же условиях. Супернатант отбирали, оставляя осадок РНК на дне пробирки, к которому затем добавляли 1 мл 80% этанола. Пробирку центрифугировали в течение 5 мин при 11000 g при комнатной температуре, с последующим удалением супернатанта. Осадок высушивали при комнатной температуре в течение 5–7 мин или в термостате при 60–65°С в течение 1–2 мин. К осадку РНК добавляли воду, свободную от нуклеаз, в необходимом объеме. Для улучшения растворения образец прогревали при 55– 60°С в течение 3–5 мин. Синтез кДНК из полученной матрицы РНК проводили с использованием коммерческого комплекта реагентов Реверта–L согласно инструкции производителя («АмплиСенс», Россия). Для этого готовили реакционную смесь на 12 реакций. В пробирку RT–mix вносили 5 мкл RT–mix–1, к полученному раствору добавляли 6 мкл ревертазы (MMlv). Вносили в микропробирки по 10 мкл полученной реакционной смеси. Затем к реакционной смеси добавляли по 10 мкл РНК–пробы. Далее проводили обратную транскрипцию в термостате (Драй–блок Biosan TDB–120, «Biosan», Латвия) при температуре 37°С в течение 30 мин. Полученную в реакции обратной транскрипции кДНК разводили ДНК–буфером в два раза для последующей постановки ПЦР (к 20 мкл кДНК добавляли 20 мкл ДНК–буфера). Для проведения ПЦР использовали следующие компоненты реакционной смеси: 10X Taq Turbo буфер в объеме 2.5 мкл («Евроген»), dNTPs 50x (10мM) в объеме 0.5 мкл («Евроген»), Taq ДНК–полимераза в объеме 0.5 мкл («Евроген»), интеркалирующий краситель SYBR Green I 50x в объеме 0.5 мкл («Евроген»), DMSO в объеме 1 мкл («Евроген»), комплементарная ДНК матрица (1–100 нг на реакцию), прямой праймер NOX2 в объеме 1 мкл, обратный праймер NOX2 в объеме 1 мкл, до конечного объема 25 мкл реакционной смеси доводили H2O («Евроген»). Аналогичные реакционные смеси готовили для референсного гена B2M.
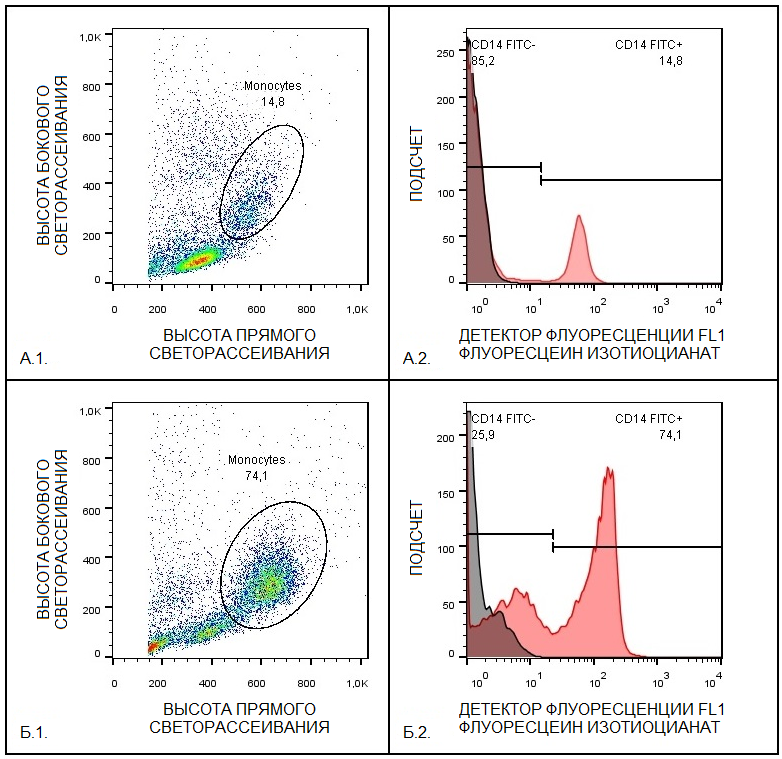
Полимерзно-цепную реакцию проводили на приборе CFX96 (CFX96 Touch Real–Time PCR Detection System, «Bio–Rad», США), с использованием следующих режимов: предварительная денатурация 1 цикл при 93°С в течение 3 мин; денатурация /отжиг /элонгация до 40 циклов: денатурация при 93°С в течение 15 с, отжиг праймеров при 61°С в течение 20 с, элонгация (визуализация) при 72°С в течение 30 с на 1 т.п.о. [35]. Расчёт экспрессии гена NOX2 проводили при помощи анализа порогового цикла с использованием эталонного гена B2M по методу ∆∆CT [35, 36]. Статистический анализ Нормальность распределения полученных данных проверяли критериями Колмогорова-Смирнова и Лиллиефорса, а также критерием Шапиро-Уилка. Для сравнения трех или более групп с нормальным распределением использовали однофакторный дисперсионный анализ с критерием Тьюки. Значение p<0.05 считали значимым. РЕЗУЛЬТАТЫ Выделение моноцитов из фракции лейкоцитов является распространенным способом получения очищенных моноцитов для исследований in vitro. На первом этапе исследования методом разделения в градиенте плотности фиколла (ρ = 1.077 г/мл) была получена фракция лейкоцитов с процентным соотношением моноцитов от 5.23 % до 6.21 %, так же наблюдалось повышенное соотношение моноцитов 14.8%. Методом адгезии были получены фракции моноцитов с процентным соотношением 74.1%. Наличие белка CD14, показанное методом проточной цитометрии подтвердило, что полученная фракция содержит моноциты (рис. 1).
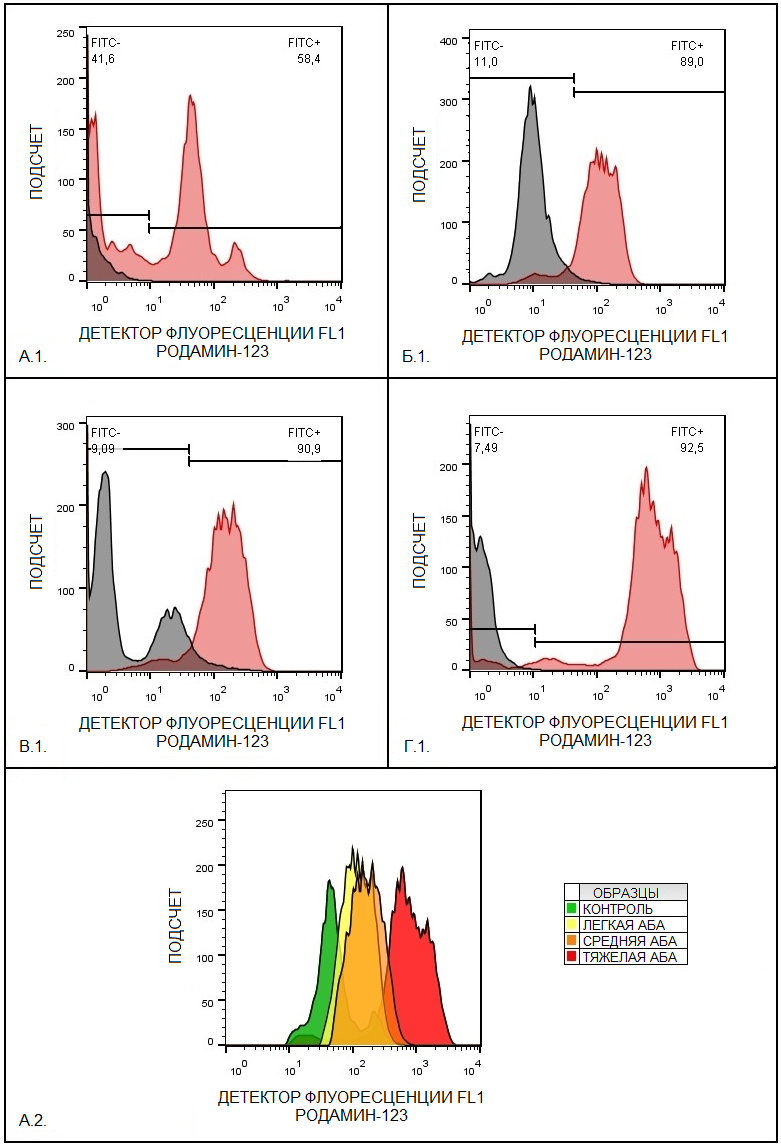
Стимуляция PMA вызывала значительное увеличение флуоресценции родамина во всех исследуемых группах (рис. 2: A.1., Б.1., В.1., Г.1.). Базальные уровни флуоресценции (левые части рисунков A.1., Б.1., В.1., Г.1.) демонстрировали низкие уровни генерации АФК в покоящихся клетках, тогда как стимулированные PMA клетки проявляли резкое увеличение флуоресценции (правые части рисунков A.1., Б.1., В.1., Г.1.), свидетельствующее о высокой способности моноцитов реагировать активным дыхательным взрывом на внешние раздражители.
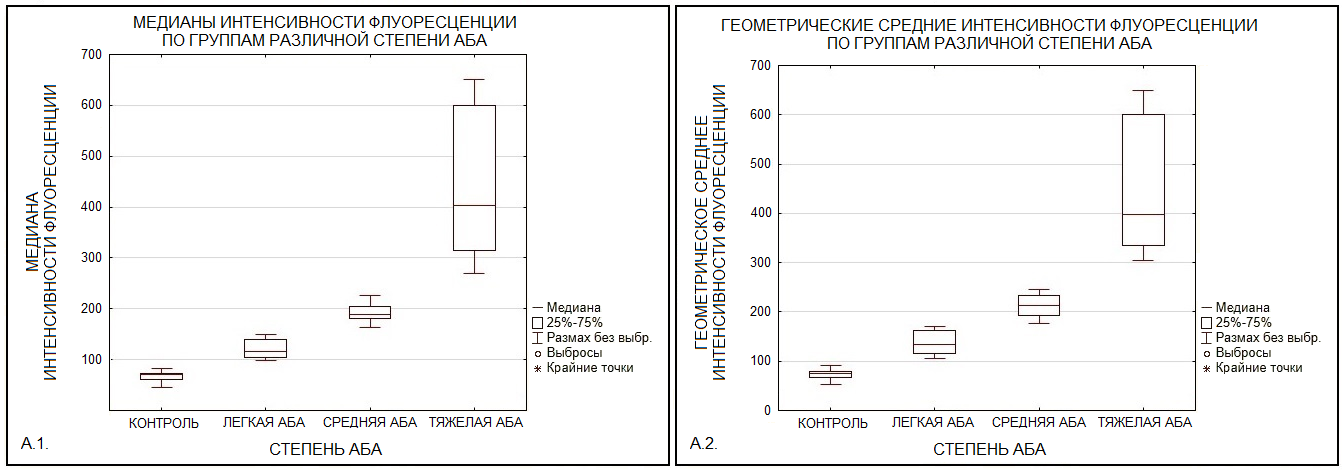
Полученные результаты свидетельствуют о сохранении функциональной активности моноцитов у пациентов, несмотря на индивидуальные вариации базальных и индуцированных уровней активности. Высокая чувствительность моноцитов к стимулу PMA подчёркивает значимость мониторинга их функций при оценке эффективности противовоспалительной терапии и рисков обострения заболеваний. Анализ интенсивности флуоресценции Rho–123 в моноцитах выявил значительные различия между группами пациентов с различной степенью тяжести атопической бронхиальной астмы (АБА) и контрольной группой здоровых доноров. Медианное значение флуоресценции канала (FL1) в группе здоровых доноров (контроль) составило 66.46 ± 14.56, тогда как для легкой БА – 119.36 ±19.24, для средней БА – 191.84±21.99, а для группы пациентов с тяжелой БА – 440 ± 153.17 (рис. 3.А.1.) Геометрическое среднее флуоресценции в группе здоровых доноров – 73.5±14.38, в группе пациентов с легкой БА – 134.44±24.7717; в группе пациентов со средней БА – 212.33±28.57; в группе тяжелой БА – 447.50± 146.79 (рис. 3.А.2.).
Обнаружено значимое увеличение медианы флуоресценции Rho–123 в группе пациентов с тяжёлой формой АБА по сравнению с группой здоровых доноров и пациентами с лёгкой степенью АБА, а также по сравнению с группой пациентов со средней степенью АБА (p<0.001). Геометрическое среднее интенсивности флуоресценции Rho–123 пациентов со средней степенью АБА было повышено по отношению к контрольной группе (p<0.05), а также меньше по отношению к группе с тяжелой степенью АБА (p<0.001). У пациентов с тяжёлой формой АБА выявлен значимый рост геометрического среднего интенсивности флуоресценции по сравнению со всеми исследуемыми группами (p<0.001): контрольная группа, лёгкая форма АБА и средняя форма АБА. Эти данные свидетельствуют в пользу того, что тяжесть заболевания коррелирует с увеличением активности моноцитов, что может быть связано с усилением воспалительных процессов и окислительного стресса. На следующем этапе исследования методом ОТ–ПЦР были определены уровни экспрессии гена NOX2 (рис. 4).
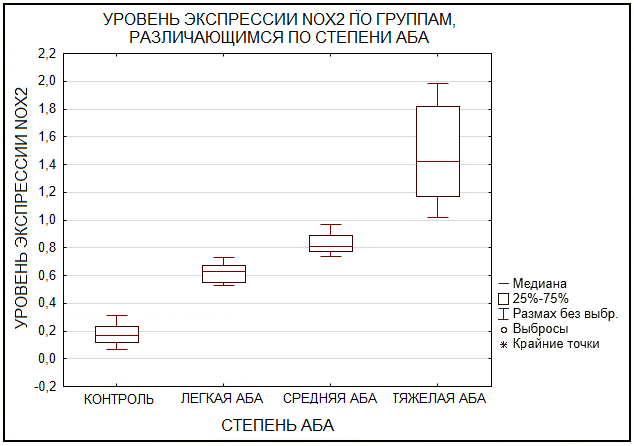
Анализ экспрессии гена NOX2 в моноцитах выявил значительные различия между группами пациентов с различной степенью тяжести атопической бронхиальной астмы (АБА) и контрольной группой здоровых доноров. В моноцитах здоровых доноров (контроль) относительный уровень экспрессии NOX2 составил 0.177379± 0.096110, в группе с легкой АБА – 0.621562±0.075649, в группе со средней АБА – 0.836449±0.077394, в группе с тяжелой астмой – 1.483824± 0.411264. При этом выявлено статистически значимое повышение экспрессии гена NOX2 у пациентов со средней и тяжёлой степенью АБА по сравнению с пациентами остальных групп: среднее значение показателя в группе средней степени значимо отличалось от контроля, группы лёгкой степени и группы тяжёлой степени; аналогично, показатель в группе тяжёлой степени был выше значений контрольной группы, группы лёгкой степени и группы средней степени (p<0.001). Результаты свидетельствуют о том, что тяжесть заболевания коррелирует с увеличением экспрессии NOX2, что может быть связано с усилением воспалительных процессов и окислительного стресса. ОБСУЖДЕНИЕ В нашей работе было обнаружено PMA-зависимое увеличение продукции АФК моноцитами больных АБА с увеличением отягощенности степени тяжести заболевания (рис. 2, 3). Повышенный уровень АФК вызывает усиление окислительного стресса и нарушение процессов аутофагии, что ведет к ухудшению состояния пациентов. Окислительный стресс усиливается при тяжелой астме и во время обострений, что в свою очередь приводит к воспалению и гиперреактивности дыхательных путей. Повышенная экспрессия гена NOX2, показанная методом ОТ–ПЦР (рис. 4), в моноцитах пациентов с астмой может способствовать этому явлению. Ранее нами [37] было установлено снижение экспрессии белка Rubicon в моноцитах пациентов с астмой тяжелой формы, в том числе нарушение протекания LC3–ассоциированного фагоцитоза. С учетом того, что белок Rubicon взаимодействует с компонентами комплекса NOX2, поддерживая стабильность и функциональную активность этого ферментативного комплекса [38], низкая экспрессия белка Rubicon и гиперэкспрессия NOX дополнительно усугубляют воспалительные процессы и повышают риски развития серьезных патологических изменений. В совокупности полученные данные позволяют предположить, что гиперэкспрессия NOX2 отрицательно влияет на LC3-ассоциированный фагоцитоз (LAP), снижая возможности ликвидации патогенов и ослабляя общую иммунокомпетенцию. Представленные результаты обосновывают необходимость разработки терапевтических стратегий, ориентированных на регулирование активности NOX2 и оптимизацию контроля воспалительных процессов. Такие подходы включают применение антиоксидантов и ингибиторов NOX2 для уменьшения уровней АФК, использование препаратов, нормализующих активность LC3-ассоциированного фагоцитоза (например, аналогов АТФ и модуляторов NF-κB), а также совершенствование представлений о взаимодействии NOX2 с другими сигнальными каскадами для создания таргетных лекарственных средств. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследование было проведено в полном соответствии с действующими этическими стандартами и принципами биоэтики. Все использованные образцы (фракции лейкоцитов) были предоставлены Казанским научно-исследовательским институтом эпидемиологии и микробиологии. Исследование выполняли согласно внутренним правилам и процедурам института, включая требования к безопасности и конфиденциальности данных. Все процедуры проводили в строгом соответствии с нормативными актами и регламентами, регулирующими проведение научных исследований в области биологии и медицины в Российской Федерации. ФИНАНСИРОВАНИЕ Работа выполнена в рамках программы «Стратегическое академическое лидерство Казанского федерального университета» (ПРИОРИТЕТ-2030). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов по представленной статье. ЛИТЕРАТУРА
К данной статье приложены дополнительные материалы, свободно доступные в электронной версии (http://dx.doi.org/10.18097/BMCRM00____________) на сайте журнала. |