|
СУПЕРОКСИДГЕНЕРИРУЮЩАЯ И АНТИОКСИДАНТНАЯ АКТИВНОСТЬ НИКОТИНАМИДНЫХ КОФЕРМЕНТОВ IN VITRO Институт теоретической и экспериментальной биофизики РАН, 142290, Пущино, Московская область, ул. Институтская, 3; *эл.почта: sirotatv@rambler.ru Ключевые слова: никотинамидные коферменты; NAD; NADP; NADH; NADPH; супероксид; нитросиний тетразолий DOI: 10.18097/BMCRM00276
Сокращения: АФК - активные формы кислорода; НСТ - нитросиний тетразолий;
АОА – антиоксидантная активность; СОД – супероксиддисмутаза.
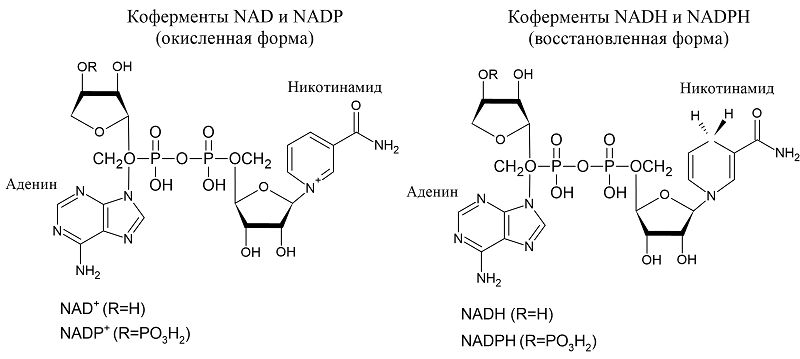
ВВЕДЕНИЕ Основная функция никотинамидных коферментов (NAD, NADH, NADP, NADPH), как известно, участие в окислительно-восстановительных реакциях энергообеспечения клетки. Свойства вещества определяются его химическим строением; NAD – основной компонент в каждом из этих соединений (рис.1).
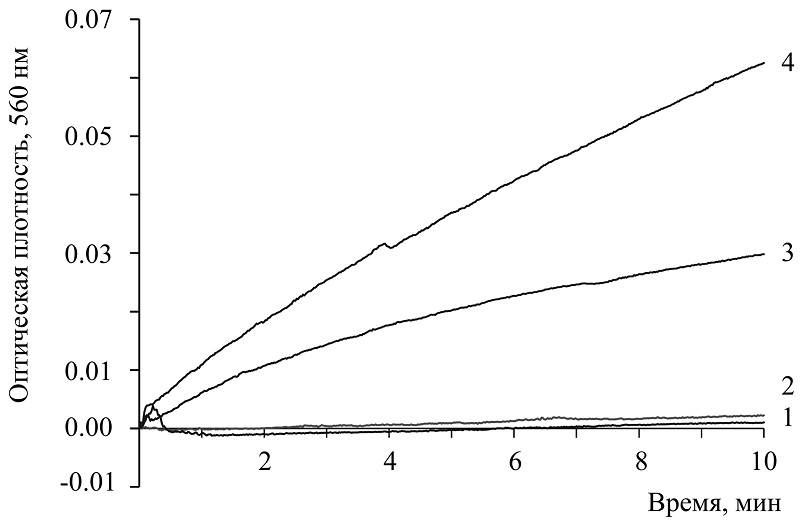
Так функционируют коферменты как кофакторы оксидоредуктаз. Окислительно-восстановительный гомеостаз в клетке поддерживается парами NAD/HADH и NADP/NADPH; непосредственно при их участии происходит процесс появления активных форм кислорода (АФК) и функционирование системы антиоксидантной защиты [1-5]. Нарушение баланса в этих реакциях приводит к энергетическому стрессу, окислительному стрессу и, в конечном итоге, к патологическим состояниям [1, 4, 5]. Участие никотинамидных коферментов установлено и в других клеточных процессах, таких как клеточная сигнализация, возрастные изменения и гибель клеток, а также в функционировании иммунных защитных систем организма [3-6]. Функции никотинамидных коферментов связаны, таким образом, с фундаментальными процессами в клетке и организме в целом. Ранее мы обнаружили новое свойство никотинамидных коферментов: как окисленные, так и восстановленные формы коферментов способны генерировать супероксид в щелочной среде, т.е. они обладают супероксидгенерирующей активностью [7, 8]. Было известно, что NAD и NADP могут образовывать аддукты с различными ионами, в том числе и с гидроксильным анионом ОН▬ [9, 10], однако значение этого феномена с позиции АФК и понятия «супероксид», не обсуждалось. Нами предложен механизм этого феномена, который связан с молекулой никотинамида в составе кофермента, но он иной [8], отличный от окислительно-восстановительных реакций. В настоящей работе представлены и другие свойства коферментов: в системе in vitro они проявляют также антиоксидантную активность (АОА). Цель настоящей работы – продемонстрировать супероксидгенерирующую активность коферментов, учитывая ранее проведенные эксперименты [7, 8] и исследовать АОА этих соединений МЕТОДИКА Реактивы В работе использовали следующие реактивы: никотинамид («AppliChem», Германия); NAD («Sigma», США; «Dia-M», Россия); NADPH, NADP, NADH («Reanal», Венгрия; «Sigma-Aldrich», США; «Fluka», Германия); СОД (superoxide dismutase, КФ 1.15.1.1, 3.35 units/мг белка, «Sigm»a); XO (хanthine oxidase, КФ 1.17.3.2), 0.3 units/mg protein («Sigma-Aldrich»); Na2CO3, нитросиний тетразолий («Sigma»; «Dia-M»), NaHCO3 («J. T. Baker», Голландия); фармакопейную форму 0.1% адреналина гидрохлорида Московского эндокринного завода. Во всех экспериментах восстановленные формы пиридиннуклеотидов, NADH и NADPH, спектрально проверяли на наличие пика при длине волны 340 нм. Кинетические исследования проводили на спектрофотометре UVIKON 923 Double Beam UV/VIS Spectrophotometer («Kontron instruments», Италия) в 1-см кювете в режиме «time Driver» при длине волны 560 нм в соответствующих буферных растворах при комнатной температуре или иной, указанной в подписях к рисунку. В работе также использовали спектрофотометр Specord UV/VIS («Carl Zeiss Jena», Германия). Супероксигенерирущую активность выявляли с использованием известного классического реагента НСТ (нитросиний тетразолий), применяемого для идентификации О2─●. НСТ под действием образующегося супероксида восстанавливается до диформазана, который регистрируется при длине волны 560 нм [11]. В спектрофотометрическую кювету с буфером вносили исследуемые вещества, 0.075 мМ НСТ присутствовал во всех пробах. В экспериментах c NAD после записи кинетики реакции в течение 10 мин и последующих еще 10 мин содержимое кюветы переносили в пробирку с плотно закрывающейся пробкой, чтобы изолировать от кислорода воздуха, и оставляли на продолжительное время. Наблюдали появление или отсутствие окрашенных продуктов в опытной и соответствующих контрольных пробах. Также для идентификации О2─● были проведены эксперименты с супероксиддисмутазой (СОД). Антиоксидантную активность определяли с применением супероксидгенерирующей ферментативной системы ксантин-ксантиноксидаза [12] и супероксидгенерирующей модельной химической реакции автоокисления адреналина [13, 14]. Регистрировали образование диформазана. Способность исследуемых соединений ингибировать ксантин-ксантиноксидазную реакцию или процесс автоокисления адреналина оценивали как проявление АОА. Ксантин-ксантиоксизазную реакцию проводили, как описано [12]: в 50 мМ Na2CO3 буфере, рН 10.2, с 0.4 мМ ЭДТА, в присутствии 0. 025 мМ НСТ и коммерческого препарата ксантиноксидазы, 11 мкг белка /мл. Реакцию начинали внесением 0.1 мМ ксантина. Реакцию автоокисления адреналина в щелочной среде проводили по протоколу, описанному ранее [13, 14.] Спектральные исследования проводили в 0.2 М карбонатном буфере (рН 10.6) в присутствии 0.05 мМ НСТ, реакцию начинали внесением 0.058 мМ адреналина. Время регистрации во всех измерениях составило 3-4 мин. Накопление диформазана оценивали по изменению оптической плотности в единицу времени и рассчитывали по формуле: ∆Е/∆t = (Et-E1)/ ∆t, где E1 – регистрируемая оптическая плотность при 560 нм сразу же после внесения адреналина; Et – оптическая плотность через время ∆t, в течение которого регистрируется автоокисление адреналина. АОА выражали в условных единицах: 1% ингибирования = 1 усл.ед. Статистическую обработку результатов проводили с использованием t критерия Стьюдента (программы Microsoft Excel): определяли среднее значение (M), стандартное отклонение (SD). Представленные графики являются конкретными экспериментальными кривыми из типичных многократно полученных при 4-6 параллельных измерениях в каждом опыте. МЕТОДИКА Феномен наличия супероксидгенерирующей активности никотинамидных коферментов описан нами ранее [7, 8]. В настоящем исследовании представлены эксперименты, демонстрирующие это свойство (рис. 2)
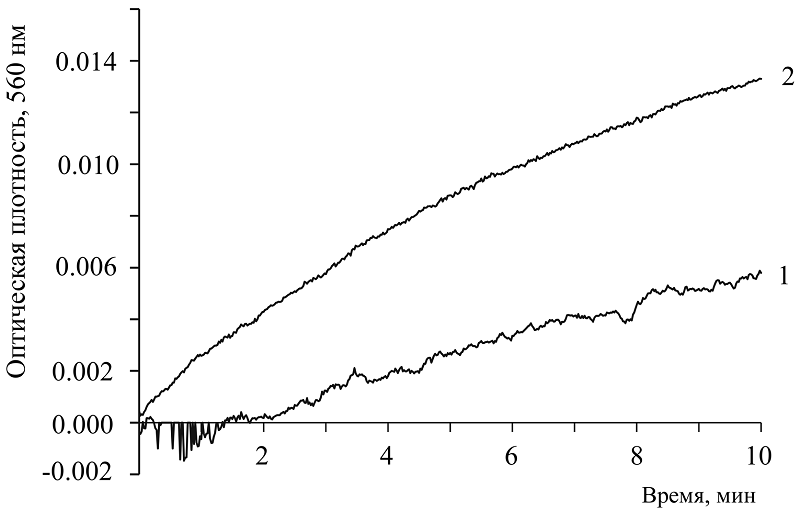
Показана кинетика образования диформазана при участии NADH (кривая 3) и NADP (кривая 4). В присутствии NAD диформазан не регистрируется в течение 20 мин (кривая 1 и 2) и требуется значительно большее время для его выявления. Как описано в разделе «Методика», после записи кинетики этой пробы, содержимое кюветы переносили в пробирку и через некоторое время видели появление окрашенного продукта. Такой же результат наблюдали и ранее [7]. На рисунке 3 показано: СОД ингибирует процесс генерации супероксида, что указывают на образование именно О2─● (кривая 1). Наблюдается появление лаг периода в продолжение 2 мин, и через 4 мин ингибирующий эффект составлял приблизительно 75 %. Для существования супероксида и его идентификации необходима щелочная среда. При создании таких условий и была обнаружена супероксидгенерирующая активность исследуемых соединений. Щелочные условия используют в различных методиках для регистрации О2 ─● [7, 8, 12-16]. В обнаруженном феномене донором электрона является именно сама молекула кофермента, которая способна образовывать аддукты с гидроксильным анионом ОН ─ буфера. В результате такого взаимодействия происходит образование О2 ─●. Механизм процесса описан в нашем исследовании [8]. В обзорных статьях, где обсуждаются различные системы генерации супероксида [6, 17], никотинамидные коферменты не рассматриваются.
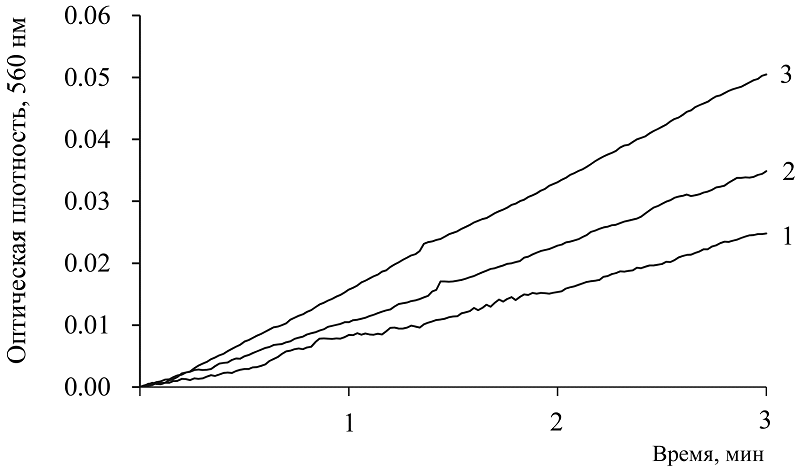
Установленные прооксидантные свойства коферментов предполагают проявление ими и антиоксидантной активности, поскольку окислительно-восстановительные процессы в биологических системах сопряжены и происходят при участии определенных соединений, таковыми и являются коферменты. Используя модельные супероксидгенерирующие системы, было проведено исследование антиоксидантных свойств коферментов. Применяли две супероксидгенерирующие модели: ферментативная реакция ксантин-ксантиноксидаза [12] и химическая реакция автоокисления адреналина в щелочной среде, моделирующая процесс хиноидного окисления катехоламинов в организме [14-16]. Ингибирование генерации супероксида оценивали как АОА. На рисунке 4 показана кинетика реакции накопления диформазана в присутствии 1.0 и 0.5 мМ NADPH (кривые 1 и 2) в реакции ксантин-ксантиноксидаза; ингибирующий эффект составлял 53% и 32% соответственно.
В этой же супероксидгенерирующей системе исследованы и другие соединения (табл. 1). В таблице представлены результаты определения АОА: скорость реакции образования диформазана и рассчитанная АОА (см. раздел «Методика»). Кроме коферментов были исследованы вещества, которые как компоненты входят в состав молекулы кофермента (рис.1), никотинамид и аденозин. Установлено, что все соединения достоверно ингибируют процесс генерации супероксида. Наибольшим антиоксидантным эффектом, сравнимым с СОД, обладал NADP (1 мМ); наблюдался и выраженный концентрационный эффект. В той же концентрации восстановленная форма кофермента NADPH была менее эффективна. Несколько иным было действие NADH: увеличение концентрации NADH от 1 мМ до 2 мМ не приводило к усилению ингибирования. Антиоксидантные свойства выявлены у никотинамида и аденозина, которые, как было показано ранее [7, 8], не обладали супероксидгенерирующей активностью.
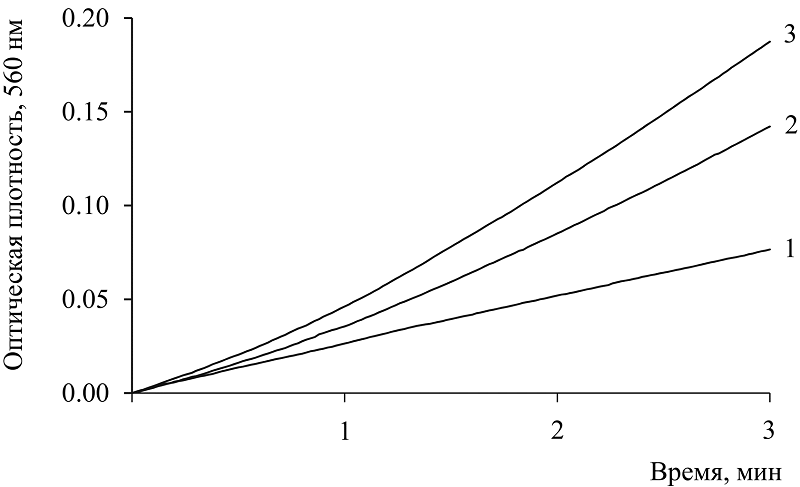
Некоторые коферменты были исследованы и в другой супероксидгенерирующей модельной системе – реакция автоокисления адреналина в щелочной среде, которая известна как цепная реакции и используется для выявления и исследования антиоксидантных свойств различных препаратов [13-16]. На рисунке 5 показано сравнение ингибирующего действия NADH (кривая 1) и NAD (кривая 2). Восстановленный кофермент сильнее ингибирует генерацию супероксида, 60% и 28%, соответственно.
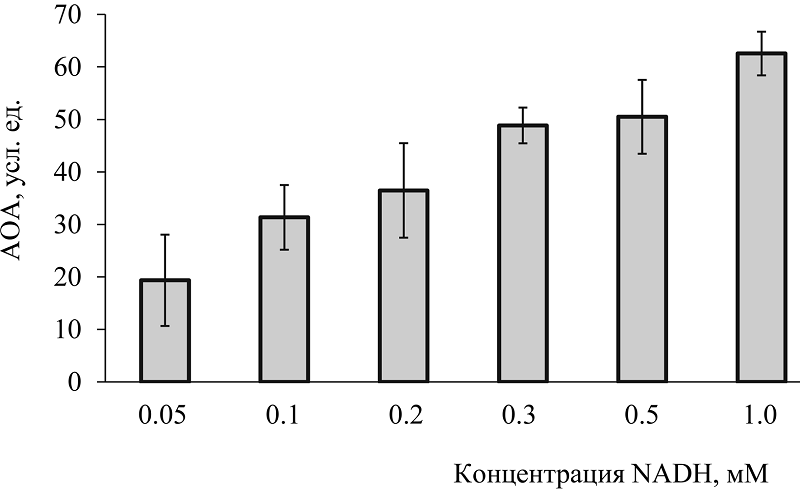
На рисунке 6 демонстрируется ингибирующее действие различных концентраций NADH в этой же реакции; представлены величины рассчитанной АОА кофермента. Установлено, что коферменты ингибируют генерацию супероксида в модельных супероксидгенерирующих системах, т.е. являются антиоксидантами, т.е. ловушками О2▬• (рис. 4-6, табл. 1). Такой же способностью обладают никотинамид и аденозин, входящие в состав молекулы кофермента (табл. 1). Супероксидгенерирующую активность проявляют только коферменты, т.е. они прооксиданты (рис. 2 и [7, 8]), но таких свойств нет у аденозина, АDP, АTP [7] и никотинамида [8].
Результаты настоящей работы раскрывают новые химические свойства коферментов: способность генерировать супероксиды в щелочной среде и быть ингибиторами в супероксидгенерирующих системах. Таким образом, in vitro коферменты проявляют супероксидгенерирущую и антиоксидантную активность и их можно считать бифункциональными биомолекулами. В литературе описываются различные способы генерации супероксид-анионов: химические, ферментативные, биологические, техногенные и др. [6, 17], но нет примеров с участием коферментов. В нашем исследовании показано, что коферменты способны генерировать супероксид путем образования аддуктов с ионами среды и через химическое изменение собственной молекулы. Можно предположить, что в клетке, в органеллах (например, митохондриях), где физиологическая температура существенно выше, чем в экспериментах in vitro, при локальных изменениях рН может появляться О2─● как неконтролируемый химический реагент. Возможно, что таким образом молекула кофермента и именно через рН способна самостоятельно участвовать в клеточной сигнализации, а при избытке супероксида в среде выполнять и роль антиоксиданта. Наличие антиоксидантной способности этих соединений также показано в настоящей работе. В литературе активно обсуждается возможность применения коферментов и их компонентов в терапевтических целях [3, 6, 18-23]; также отмечается важность способа их доставки [3, 23]. Проведенные исследования предполагают, что NAD может использоваться как терапевтическое средство при ишемических и травматических повреждениях мозга, при неврологических расстройствах опосредованных PARP-1 [3, 18-20, 22, 23]. Применяется интраназальный способ доставки лекарства [3, 23]. При лечении экспериментального аутоиммунного энцефаломиелита животным вводили препарат внутрибрюшинно и сделан вывод об эффективном и перспективном средстве лечения иммунных заболеваний и рассеянного склероза [20, 23]. NAD улучшил лечение регулируя SIRT1 путем ингибирования сигнального пути PI3K/Akt/mTOR [22]. Получены перспективные результаты с применением NAD в моделях, где с целью замедления процесса старения задействованы сиртуины [22-23]. Использовали ключевой предшественник NAD никотинамидмононуклеотид (NMH) для лечения в клеточной модели болезнь Паркинсона [21]. Необходимо отметить, что, вероятно, как перспективный путь в лечении и профилактике заболеваний, следует искать пути регуляции биосинтеза коферментов в организме и/или использование их предшественников. Такой подхoд мы рекомендовали и ранее [24]. В экспериментальных исследованиях с использованием коферментов как лекарственных препаратов необходимо учитывать их свойство – способность генерировать супероксид в щелочной среде и быть антиоксидантом. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая работа не содержит описания исследований с использованием людей и животных в качестве объектов. БЛАГОДАРНОСТИ Авторs выражают благодарность Н.Е. Ляминой за техническую помощь в проведении экспериментов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Государственного задания ИТЭБ РАН № 075-00223-25-00. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|