К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ |
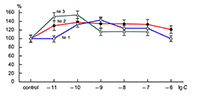
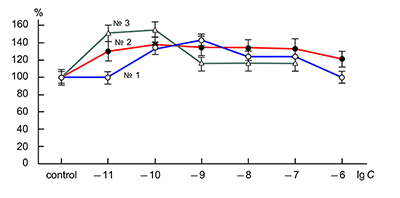
Влияние новых синтетических аналогов пептидного препарата Семакс 1Институт физиологически активных веществ Российской академии наук 142432 Черноголовка Московской обл., Северный проезд, 1; *e-mail: bovina_e@ipac.ac.ru 2Институт молекулярной генетики Российской академии наук, 123182 Москва, площадь академика И.Г. Курчатова, 2 Ключевые слова: пептиды-аналоги препарата Cемакс; АМРА рецепторы; нейроны Пуркинье DOI: 10.18097/BMCRM00033 ВВЕДЕНИЕ Эндогенные пептиды играют важнейшую регуляторную роль во многих функциях организма человека, в том числе в регуляции его когнитивной сферы. Одним из самых известных примеров в этой области может служить влияние АКТГ на память [1]. На основе фрагмента последовательности АКТГ с 4 по 10 аминокислотный остаток был создан известный препарат Семакс [2], который обладает ноотропным, нейрозащитным, антиоксидантным и антигипоксическим действием [3]. Как показали наши исследования, в основе когнитивно-стимулирующей и отчасти нейропротекторной активности лежит его способность потенцировать токи АМРА-рецепторов нейронов млекопитающих [4]. Поэтому синтез и исследование физиологической активности новых аналогов Семакса имеет не только теоретический, но и большой практический интерес. Целью данной работы явилось изучение влияния новых пептидов — аналогов препарата Семакс — на токи АМРА-рецепторов нейронов Пуркинье мозжечка крыс. МАТЕРИАЛЫ И МЕТОДЫ Электрофизиологическим методом patch-clamp [5] изучено действие 6 новых пептидов на АМРА-рецепторы (подтип глутаматных рецепторов центральной нервной системы млекопитающих). Эксперименты проведены на одиночных изолированных нейронах Пуркинье. Нейроны Пуркинье выделяли из мозжечков головного мозга 12–16-дневных крыс популяции Вистар. Для выделения использовали модифицированный метод Канеда [6]. Срезы мозжечка толщиной 400–600 мкм помещали в термостатируемую камеру объемом 10 мл. Раствор для выделения имел следующий состав (в мМ): NaCl 150.0; KCl 5.0; CaCl2 2.0; MgSО4×7H2O 2.0; HEPES 10.0; глюкоза 15.0; pH 7.42. Срезы инкубировали в этом растворе в течение 60 мин, после чего раствор заменяли на аналогичный раствор, содержащий проназу (2 мг/мл) и коллагеназу (1 мг/мл), и инкубировали в течение 70 мин. После отмывки первоначальным раствором в течение 20 мин срезы помещали в чашку Петри и разъединяли механическим способом при помощи пастеровской пипетки. Растворы во время выделения нейронов непрерывно продували 100%-ным О2 при 34°C. Исследуемые нейроны помещали в рабочую камеру объемом 0.6 мл. Рабочий раствор имел состав (в мМ): NaCl 150.0; KCl 5.0; CaCl2 2.6; MgSО4×7H2O 2.0; HEPES 10.0; глюкоза 15.0; pH 7.36. Трансмембранные токи вызывали активацией АМРА-рецепторов путем аппликации растворов агониста этих рецепторов — каиновой кислоты (КК) методом быстрой суперфузии. Регистрацию токов осуществляли при помощи боросиликатных микроэлектродов (сопротивление 2.5–5.5 мОм), заполненных раствором следующего состава (в мМ): KСl 140.0; EGTA 11.0; CaCl2 1.0; MgCl2 1.0; HEPES 10.0; ATP 5.0; pH 7.2. Для регистрации токов использовали прибор EPC-9 («HEKA», Германия). Запись токов осуществлялась на компьютер при помощи лицензионной программы Pulse («HEKA»). Полученные результаты обрабатывали программой Pulsefit («HEKA»). РЕЗУЛЬТАТЫ Как показали проведенные исследования, четыре из шести изученных пептидов оказывают влияние на амплитуду токов АМРА-рецепторов, однако действие каждого из них имеет свои особенности. Пептиды № 1 (H-Arg-Glu-Arg-Pro-Gly-Pro-OH) и № 3 (H-Arg-Glu-Arg-Gly-Pro-OH) вызывают потенциацию токов АМРА-рецепторов в диапазоне концентраций 10–10–10–7 М (рис. 1). Для действия этих пептидов наблюдается дозозависимость.
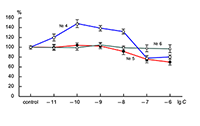
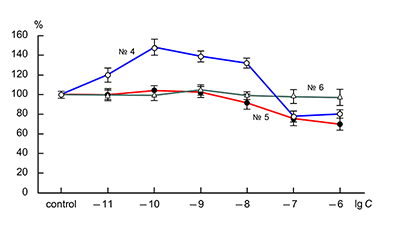
Действие пептида № 2 (H-Arg-Glu-Arg-Val-Gly-Pro-OH) несколько отличалось от действия описанных выше пептидов: в диапазоне концентраций 10–11–10–8 М дозозависимости величины потенциации не наблюдалось (рис. 1). Результаты исследования действия KKRRPGP, MIT-1 (H-Arg-Lys-Lys-Arg-Pro-Gly-Pro-OH) и MIT-2 (H-Lys-Arg-Arg-Lys-Pro-Gly-Pro-OH) на АМРА-рецепторы представлены на рисунке 2. Видно, что только один пептид – KKRRPGP – оказывает дозозависимое влияние на амплитуду токов АМРА-рецепторов, тогда как другие пептиды – MIT-1 и MIT-2 - не оказывают влияния на токи АМРА-рецепторов.
ОБСУЖДЕНИЕ Таким образом, установлено, что новые пептиды способны потенцировать токи АМРА-рецепторов в низких концентрациях 10–11–10–8 М. Как было показано нами ранее, Семакс также потенцирует токи АМРА-рецепторов, но его потенцирующее действие осуществляется в более высоких концентрациях — 10–7–(3 ×10–5) М [4]. Семакс, как известно, обладает когнитивно-стимулирующим действием [3]. Показанное у новых пептидов свойство позитивных модуляторов АМРА-рецепторов также предполагает наличие у них нейропротекторных и когнитивно-стимулирующих свойств. БЛАГОДАРНОСТИ Работа выполнена по теме 48.8. «Поиск и исследование механизмов действия нейропротекторов и стимуляторов когнитивных функций» в рамках Государственного задания ИФАВ РАН (тема по ГЗ № 0090-2017-0019). ЛИТЕРАТУРА
|