К 40-летию Института физиологически активных веществ РАН
|
СОДЕРЖАНИЕ Рисунок 1 Структурные формулы изученных лигандов. Рисунок 2 Обработка данных спектрофотометрического титрования методом Бенеши-Гильдебранда. Рисунок 5Диаграммы распределения форм ионизации кислот L3 (a), L2 (b) и L1 (c) в зависимости от рН. Таблица 1 Константы диссоциации изучаемых кислот (µ = 0.1, KCl). Таблица 2 Константы устойчивости комплексов меди(II) с изучаемыми лигандами (µ = 0.1, KCl). |
1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентан и его аналоги как перспективные органические лиганды для связывания катиона меди(II)
1Институт физиологически активных веществ Российской академии наук
142432 Черноголовка Московской обл., Северный проезд, 1;
*e-mail: mager1988@gmail.com
2Институт физической химии и электрохимии им. А.Н. Фрумкина РАН, 119071, Москва, Ленинский проспект 31 корп. 4. 3Марийский государственный университет, 424000, Республика Мари Эл, Йошкар-Ола, пл. Ленина 1 Ключевые слова: дифосфоновые кислоты; константы диссоциации; комплексы катиона меди(II); константы устойчивости; потенциометрия; спектрофотометрия DOI: 10.18097/BMCRM00043 ВВЕДЕНИЕ Водорастворимые комплексы меди с органическими лигандами представляют интерес для решения многих медико-биологических задач. В частности, соединения стабильных и радиоактивных изотопов меди с органическими лигандами являются весьма перспективными веществами для поиска новых химиотерапевтических [1] и радиофармацевтических препаратов [2-4]. Супрамолекулярные комплексы меди с органическими лигандами являются катализаторами гидролиза фосфатэфиров в физиологических средах [5] и используются в качестве модельных соединений при изучении строения центров координации металлов в протеинах [6,7]. Результаты исследования связывания катионов меди с рядом МРТ-контрастных агентов [8] и люминесцентных маркеров [9] позволяют выявить нарушения гомеостаза этого жизненно важного элемента, которые сопутствуют болезням Альцгеймера, Паркинсона и Вильсона. Комплексообразование некоторых нестероидных противовоспалительных препаратов с медью позволяет уменьшить побочные действия этих лекарств [10]. Некоторые комплексы меди с органическими лигандами проявляют антимикробную [11] и фунгицидную активность [12-14]. Органические кислоты фосфора являются весьма перспективными лигандами для связывания d- и f-элементов и поэтому представляют интерес для селективного выделения этих металлов [15-19], который стимулирует работы по синтезу и исследованию физико-химических свойств как вновь синтезированных, так и известных соединений этого класса [20-27]. В настоящей работе изучены процессы диссоциации и комплексообразования с катионом Сu(II) ряда фосфорилсодержащих подандов: четырехосновной кислоты - 1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентана (L1), двухосновной кислоты - 1,5-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]-пентана (L2), полиэфирная цепь которого не содержит координирующего атома кислорода (рис. 1). Для сравнения аналогичные данные получены и для полиэфирной дикарбоновой кислоты (L3).
Соединения L1, L2 являются дифосфоновыми кислотами, а соединение L3 дикарбоновой кислотой, и все три относятся к классу синтетически доступных ациклических аналогов краун-эфиров - подандов кислотного типа, полиэфирная цепь которых содержит два этиленгликолевых звена. Выбор диэтиленгликолевой цепи в качестве полиэфирного фрагмента обусловлен результатами изучения комплексообразующих свойств в водноспиртовой среде потенциометрическим методом ряда дифосфоновых кислот – аналогов L1 с различным числом полиэфирных звеньев по отношению к двухзарядным катионам металлов с близкими радиусами: Ca(II), Mg(II), Cd(II), Ni(II), Cu(II) и Zn(II), которые показали, что именно два этиленгликолевых звена в производных L1 обеспечивают наибольшую селективность связывания Cu(II) в ряду катионов d-металлов - разница в значениях констант устойчивости комплексов с Cu(II) по сравнению с другими металлами составляет 3-4 порядка [27]. Недавно установлено, что моноалкиловые полуэфиры - диэтиленгликолевые производные L1 являются весьма эффективными экстрагентами, количественно извлекающими Th(IV) и U(VI) в присутствии лантанидов из разбавленных растворов азотной кислоты [28-29]. На основе L1 разработаны экстракционно-хроматографические материалы импрегнированного типа для селективного извлечения промышленно значимых радионуклидов 99-Мо [31] и 147-Pm из азотнокислых растворов [32]. Более того, фосфорилподанд L1 является весьма перспективным соединением для разработки бинарных экстрагентов для эффективного извлечения Th из азотнокислых растворов [33]. МАТЕРИАЛЫ И МЕТОДЫ Синтез L1, L2 и L3 осуществляли по методике, описанной в [31]. В работе использовали 0.01 М растворы фосфорилподандов в диметилформамиде (ДМФА), приготовленные по точной навеске. Раствор CuSO4 (в концентрации 0.01 М) готовили растворением 5-водного сульфата меди(II) марки «ч.д.а.»; точную концентрацию ионов металла в нем устанавливали комплексонометрическим титрованием при рН 8.0, создаваемым раствором аммиака, с использованием индикатора мурексида. Раствор NaOH с концентрацией 0.1 М готовили из фиксанала. Все исследования проводились в водной среде с 5% содержанием (по объему) ДМФА при температуре 22°С. Спектрофотометрические измерения проводили на спектрофотометре СФ-46 с использованием кюветы с толщиной поглощающего слоя, равной 1 см. Электропроводность растворов измеряли на кондуктометре АНИОН 4100 («Инфраспак-Аналит», Россия). Потенциометрические измерения проводили на иономере марки рН-150МА, электрод которого калибровали по буферным растворам. Постоянство ионной силы (µ = 0.1) поддерживали раствором KCl. Константы диссоциации определяли по данным трёх независимых титрований для каждой кислоты, константы устойчивости комплексов – по данным двух титрований. РЕЗУЛЬТАТЫ Для определения состава комплексов (мольного соотношения металл – лиганд; M – L) использовали спектрофотометрический метод. При смешении растворов фосфорилподандов и сульфата меди(II) наблюдается гиперхромный эффект на длинах волн как лиганда (оба лиганда имеют полосу на 300 нм), так и металла (750 нм). Полоса 300 нм обладает гораздо большим коэффициентом экстинкции, поэтому измерения проводили на ней. В основе спектрофотометрического эксперимента лежала серия насыщения, представляющая собой серию растворов с одинаковой концентрацией ионов меди(II) и разной концентрацией поданда. Математическую обработку полученных зависимостей оптической плотности от концентрации лиганда проводили методом Бенеши-Гильдебранда [34], основанном на анализе зависимости СМ∙l/A от 1/CLn, которая для искомого n носит прямолинейный характер (СМ и СL – исходные концентрации металла и лиганда, А – оптическая плотность, l – толщина поглощающего слоя, n – количество молекул лиганда в комплексе). Линейная зависимость (формула 1) и отсутствие линейной зависимости (формула 2) указывает на образование комплексов состава 1:1 (метод представлен на рис. 2 на примере системы Cu(II) – L3).
Преобразовав зависимости оптической плотности от концентрации подандов в логарифмические (-lgA = f(-lgCL)), получили прямые с угловым коэффициентом tga, равным n [35]. Во всех трех системах он оказался равным ~1: 0.8429 (L1), 0.8327 (L2), 0.9173 (L3).
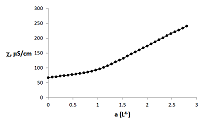
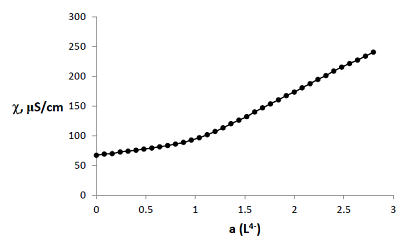
Для комплекса L1 данный состав подтвержден и методом кондуктометрического титрования раствора меди(II) раствором нейтрализованного поданда (рис. 3). Кривая титрования имеет излом при соотношении металл – лиганд = 1 : 1.
Для нейтрализации использовали раствор NaOH, взятый в мольном соотношении L1 – NaOH = 1:4. Протекающий в растворе процесс можно представить уравнением:
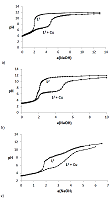
Определение констант диссоциации L1, L2 и L3 и констант устойчивости комплексов с катионом меди(II) было проведено методом потенциометрического титрования (ПМТ) растворов подандов раствором NaOH в отсутствии и присутствии ионов Cu(II) при мольном соотношении металл – лиганд = 1 : 1. Результаты потенциометрического титрования лигандов и их комплексов представлены на рисунке 4. Расчеты констант устойчивости комплексов проводили с использованием метода Шварценбаха [36].
Кривые потенциометрического титрования двухосновных кислот L3 и L2, имеют один скачок на двух эквивалентах добавленной щелочи, что соответствует одновременной диссоциации двух протонов. На кривой титрования четырехосновной кислоты L1 наблюдаются два скачка: первый соответствует одновременному отрыву двух протонов, второй - соответствует диссоциации оставшихся двух протонов, что свидетельствует в пользу независимой ионизации концевых фосфоновых и карбоновых фрагментов в исследованных соединениях. Рассчитанные значения констант диссоциации представлены в таблице 1.
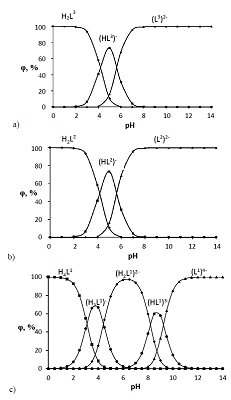
Как видно из таблицы 1, кислотные свойства дикарбоновой кислоты L3 ожидаемо несколько ниже, чем у дифосфоновой кислоты L2. На основе полученных значений констант диссоциации были построены диаграммы распределения форм ионизации L1, L2 и L3 в зависимости от рН среды (рис. 5), которые представляют несомненный интерес при создании бинарных экстрагентов [37] и медицинских препаратов на основе этих соединений [1–4].
Расхождение кривых титрования в присутствии и отсутствии ионов меди(II) служит доказательством протекания процессов комплексообразования во всех трех системах и даёт возможность определить значения констант устойчивости (табл. 2). Анализ кривых потенциометрического титрования позволяет сделать вывод, что связывание катиона меди(II) соединением L3 начинается лишь после добавления 2-х эквивалентов щёлочи при рН около 6, в то время как образование комплексов с катионом Cu2+ с фосфорилсодержащими подандами L2 и L1 начинаются в более кислой области при рН > 4. При этом в реакцию с Cu2+ вступают преобладающие в данной области рН депротонированные формы исследуемых лигандов (рис. 4). Замена карбоксильных групп в молекулах ациклических полиэфиров на фосфоновые приводит к заметному увеличению устойчивости образующихся комплексов меди(II) с близкими по строению лигандами L3 и L1 (logb=3.91 и logb=8.51). Полученные значения констант устойчивости комплексов меди(II) близки к описанным в литературе значениям для подобных лигандов, полученным в воде в присутствии 3.5 об.% этанола [27]
Наличие скачка на кривой ПМТ кислоты L1 при 5 эквивалентах NaOH свидетельствует о том, что данное соединение не насыщает полностью координационную сферу меди(II), в которой, вероятно, имеются еще 2-3 молекулы растворителя – H2O. Это согласуется с результатами рентгеноструктурного анализа моноядерного комплекса с катионом меди(II) ближайшего аналога L1 - 1,5-бис[2-(диоксифосфорил)-фенокси]-3-оксапентана меди(II), согласно которому катионы меди(II) находятся в искаженном плоскоквадратном окружении двух атомов кислорода молекул воды и двух атомов кислорода хелатного дианиона фосфорилподанда [38]. Близкие значения логарифмов констант устойчивости комплексов [CuL2] (logb=3.16) и [CuH2L1] (logb=3.18) также подтверждают ранее выявленный факт [38] неучастия центрального атома кислорода полиэфирной цепи в координации с катионом меди(II). ЗАКЛЮЧЕНИЕ Спектрофотометрическим, кондуктометрическим и потенциометрическим методами изучена диссоциация и комплексообразование с катионом Сu(II) фосфорилподандов кислотного типа: четырехосновного – 1,5-бис[2-(диоксифосфорил)-4-этилфенокси]-3-оксапентана (L1), двухосновного - 1,5-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]-пентана (L2), а также их карбонильного аналога - полиэфирной дикарбоновой кислоты 1,5-бис[2-(оксикарбонилфенокси)]-3-оксапентана (L3) в воде в присутствии 5% диметилформамида. Определены значения констант диссоциации и получены диаграммы распределения форм ионизации изученных соединений в зависимости от рН среды. Определены значения констант устойчивости комплексов с катионом Cu2+ состава 1 : 1 (M : L). На основании полученных результатов можно сделать вывод о перспективности использования изученных соединений в качестве компонентов радиофармацевтических препаратов на основе радионуклидов меди(II). БЛАГОДАРНОСТИ Работа выполнена в рамках Государственного задания 2018 года (темы №0090-2017-0024 и 0081-2014-0015) и при частичной поддержке Программы Президиума РАН № 34 и гранта РФФИ № 18-33-00685. ЛИТЕРАТУРА
|