|
Система антиоксидантной защиты слюны при немелкоклеточном раке легкого
1Омский государственный педагогический университет, 644043, Омск, ул. Тухачевского 14; Ключевые слова: слюна; немелкоклеточный рак легкого; антиоксидантная защита DOI: 10.18097/BMCRM00061 ВВЕДЕНИЕ Регулирование окислительно-восстановительного гомеостаза имеет решающее значение для поддержания нормального клеточного роста и обмена веществ. Окислительный стресс определяется как дисбаланс между образованием активных форм кислорода (ROS) и способностью клетки вызывать эффективный антиоксидантный ответ. При более низких концентрациях ROS являются важными сигнальными молекулами, участвующими в клеточной пролиферации, миграции и апоптозе [1]. Идентифицировано несколько источников ROS в клетках и тканях, включая митохондриальную цепь переноса электронов и NADPH-оксидазы (NOX) [2]. При более высоких концентрациях большинство ROS вредны для клеток из-за накопления необратимых повреждений белков, липидов и, самое главное, ДНК, приводящих к мутациям и клеточной гибели [3]. ROS могут генерироваться либо экзогенными источниками, такими как ультрафиолетовое излучение, токсичные химические вещества и лекарства, физиологические изменения, либо внутриклеточными (эндогенными) источниками, такими как ферменты NOX на плазматической мембране, миелопероксидазы в фагоцитах либо как побочные продукты функции дыхательной цепи в митохондриях [4-7]. Система ингибирования избыточной генерации ROS состоит из неферментативного и ферментативного звеньев [8]. К специфическим антиоксидантным ферментам можно отнести супероксиддисмутазу (SOD), каталазу, глутатионпероксидазу, глутатионредуктазу и трансферазы [9,10]. Эта группа ферментов, локализующихся преимущественно внутриклеточно, обладает способностью разрушать свободные радикалы, а также участвовать в разложении гидроперекисей нерадикальным путем. Среди неферментных антиоксидантов можно выделить мочевую кислоту, аскорбат и альбумины, способные перехватывать избыточно продуцируемые свободные радикалы [11,12]. Продукты антиоксидантной защиты традиционно определяют в плазме крови, однако существует возможность использования слюны в качестве исследуемого биологического материала [13-15]. Следует отметить, что исследование слюны имеет преимущества по сравнению с использованием венозной или капиллярной крови, обусловленые неинвазивностью сбора и отсутствием риска инфицирования при получении биоматериала [16]. При этом слюна адекватно отражает биохимической статус и физиологическое состояние человека, что позволяет использовать ее в клинической лабораторной диагностике [17,18]. Цель исследования – изучение системы антиоксидантной защиты в слюне пациентов с немелкоклеточным раком легкого. МАТЕРИАЛЫ И МЕТОДЫ В исследование включены 468 пациентов Клинического онкологического диспансера г. Омска и 215 практически здоровых людей, выбранных в качестве контрольной группы. Основная группа включала 290 больных раком легкого с различными гистологическими типами: плоскоклеточный рак – 116 (70 мужчин, возраст 59.5 [55.0–67.0] лет; 36 женщин, возраст 56.5 [54.0–63.0] лет), аденокарцинома – 174 человека (120 мужчин, возраст 61.0 [55.5–65.0] лет; 54 женщины, возраст 60.0 [57.0–65.0] лет). Группа сравнения включала 178 больных с незлокачественной легочной патологией, в том числе гамартомы – 77, туберкулемы – 41, саркоидоз – 29, фибромы – 31 человек (99 мужчин, возраст 55.0 [46.0–60.0] лет; 79 женщин, возраст 55.0 [44.0–61.0] лет). Контрольная группа включала условно здоровых пациентов, у которых при проведении плановой диспансеризации не было выявлено патологии легких (130 мужчин, возраст 53.5 [49.0–60.0] лет; 85 женщин, возраст 51.5 [46.0–59.0] лет). Включение в группы происходило параллельно. В качестве критериев включения рассматривались: возраст пациентов 30 – 75 лет, отсутствие какого-либо лечения на момент проведения исследования, в том числе хирургического, химиотерапевтического или лучевого, отсутствие признаков активной инфекции (включая гнойные процессы), проведение санации полости рта. Критерии исключения: отсутствие гистологической верификации диагноза. У всех участников до начала лечения проводили забор слюны в количестве 2 мл. Образцы слюны собирали утром натощак путем сплевывания в стерильные пробирки, центрифугировали при 7000 об/мин (центрифуга ЦЛн-16, ротор 4). Содержание альбумина определяли спектрофотометрически по реакции с бромкрезоловым зеленым, мочевой кислоты – уриказным методом с использованием наборов «Вектор-Бест» (Россия) [19]. Активность SOD определяли по накоплению продукта автоокисления адреналина супероксидным анион-радикалом в щелочной среде [20], активность каталазы – по методике Королюка [21]. Антиоксидантную активность (AOA) выявляли по регистрации скорости окисления восстановленной формы 2,6-дихлорфенолиндофенола (2,6-DCPIP) кислородом, растворенным в реакционной среде, активность пероксидазы определяли по интенсивности окисления перекиси водорода в присутствии бензидина [22,23]. Дополнительно были рассчитаны коэффициенты SOD/catalase и SOD/peroxidase, характеризующие работу физиологического каскада антиоксидантных ферментов [24]. Статистический анализ выполнен при помощи программ Statistica 10.0 («StatSoft», США) и пакета R (версия 3.2.3) непараметрическим методом с использованием в зависимых группах критерия Вилкоксона, в независимых группах – U-критерия Манна-Уитни. Описание выборки производили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25-го и 75-го процентилей [LQ;UQ]. Различия считали статистически значимыми при p ˂ 0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ На первом этапе проведена проверка характера распределения и гомогенности дисперсий в группах. Согласно тесту Шапиро-Уилка содержание всех определяемых параметров не соответствует нормальному распределению (p < 0.05). Проведённый тест на гомогенность дисперсий в группах (тест Бартлетта) позволил отклонить гипотезу, что дисперсии гомогенны по группам (p = 0.00017). Поэтому для обработки полученных данных были применены непараметрические методы статистики. Исследование выявило статистически достоверное уменьшение активности каталазы, SOD и концентрации мочевой кислоты как в основной группе, так и в группе сравнения (табл. 1). В обеих группах отмечен рост концентрации альбумина и активности пероксидазы по сравнению с контролем, тогда как AOA изменялась разнонаправленно: уменьшалась в группе сравнения и увеличивалась в основной.
Существенных отличий в динамике показателей антиоксидантной защиты в зависимости от гистологического типа немелкоклеточного рака легкого не выявлено (табл. 2). При этом в слюне пациентов с плоскоклеточным раком активность каталазы и SOD несколько ниже, чем при аденокарциноме. Это может быть связано с преобладанием определенной формы ROS: в случае аденокарциномы – супероксидного радикала, в случае плоскоклеточного рака – перекиси водорода [25]. Интересно отметить, что для обоих гистологических типов рака легкого наблюдается рост коэффициента SOD/catalase и уменьшение отношения SOD/peroxidase, более выраженное для плоскоклеточного рака легкого. Концентрация мочевой кислоты в слюне пацинтов с аденокарциномой в среднем ниже а концентрация альбумина и активность пероксидазы выше, чем в слюне пациентов с плоскоклеточным раком.
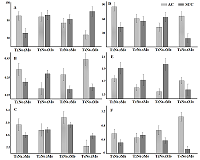
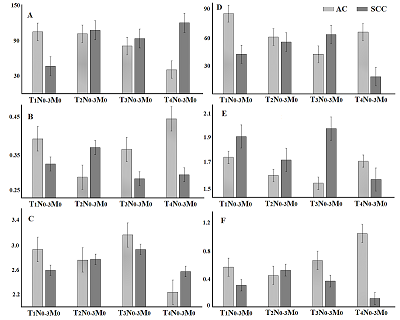
Сравнение показателей системы антиоксидантной защиты в зависимости от размера опухоли (рис. 1) показало, что несмотря на сложный характер динамики исследуемых параметров, можно все-таки выделить некоторые закономерности. Так, для аденокарциномы концентрация мочевой кислоты, активности SOD, каталазы и AOA с ростом опухоли уменьшаются. Отмечены локальные максимумы для каталазы на стадии T3N0-3M0, для SOD и AOA на стадии T4N0-3M0. Для плоскоклеточного рака легкого, наоборот, наблюдается рост данных показателей вплоть до стадии T3N0-3M0, а затем локальный минимум на стадии T4N0-3M0. Для обоих гистологических типов рака легкого динамика концентрации альбумина и активности пероксидазы однотипна. Оба показателя растут с локальным минимумом на стадии T2N0-3M0 для аденокарциномы и уменьшаются с локальным максимумом на этой же стадии для плоскоклеточного рака (рис. 1).
При наличии отдаленных метастазов в легких наблюдается дальнейшее уменьшение активности каталазы и концентрации мочевой кислоты, а также рост активности пероксидазы для обоих гистологических типов рака легкого (табл. 3). Однако активность SOD, уровень альбумина и AOA меняются разнонаправленно: первые два показателя уменьшаются для аденокарциномы и растут для плоскоклеточного рака, тогда как AOA наоборот. Дополнительный расчет коэффициентов SOD/catalase и SOD/peroxidase показал, что при наличии метастатического поражения наблюдается рост первого коэффициента и уменьшение второго (табл. 3). Следует отметить, что максимальные отклонения от соответствующих значений для контрольной группы наблюдаются в слюне пациентов с плоскоклеточным раком легкого.
Для активности пероксидазы слюны выявлена положительная корреляция с активностью каталазы и концентрацией альбумина (r = 0.2631 и r = 0.4813 – для аденокарциномы, r = 0.5085 и r = 0.2086 – для плоскоклеточного рака легкого). Интересно, что для плоскоклеточного рака выше коэффициент корреляции для каталазы, тогда как для аденокарциномы наоборот. Можно предположить в первом случае больший вклад ферментативных систем в антиоксидантную защиту, тогда как для аденокарциномы – неферментативных.
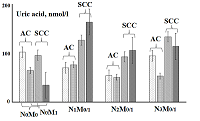
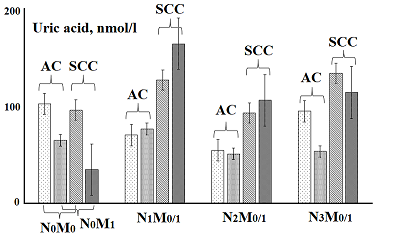
Анализ динамики исследуемых показателей при одновременном учете как отдаленного, так и регионарного метастазирования (рис. 2 - 4) показал, что для мочевой кислоты наиболее существенные отличия выявлены между стадиями N0M0/1 и N1M0/1; при отсутствии отдаленного и регионарного метастазирования уровень мочевой кислоты выше как для плоскоклеточного рака, так и для аденокарциномы (рис. 2).
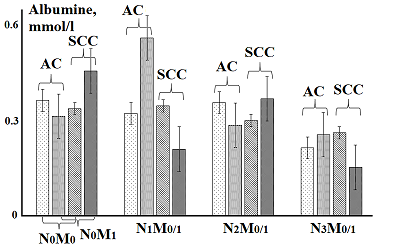
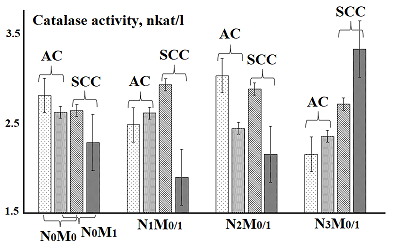
Для альбумина слюны отмечено уменьшение его концентрации для обоих гистологических типов рака легкого при переходе от N0M0 к N3M0, тогда как переход от N0M1 и N3M1 сопровождается локальными максимумами на стадии N1M1 для аденокарциномы и на стадии N0M1 для плоскоклеточного рака (рис. 3). При наличии как отдаленного, так и регионарного метастазирования конечный уровень мочевой кислоты для плоскоклеточного рака выше, а альбумина – ниже, чем для аденокарциномы. Активность каталазы при увеличении распространенности регионального метастазирования меняется неоднозначно, однако в целом на фоне только регионарного метастазирования она выше (рис. 4). Исключение составляет стадия N3M0/1, причем активность каталазы на этой стадии практически в 2 раза отличается между плоскоклеточным раком легкого и аденокарциномой.
Полученные данные свидетельствуют о том, что определение компонентов антиоксидантной защиты слюны может служить дополнительным тестом при раке лёгкого. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Исследование проведено в соответствии с Хельсинской декларацией, принятой в июне 1964 г. (Хельсинки, Финляндия) и пересмотренной в октябре 2000 г. (Эдинбург, Шотландия), и одобрено на заседании комитета по этике БУЗ Омской области «Клинический онкологический диспансер» от 21 июля 2016 г., протокол № 15. ЛИТЕРАТУРА
|