|
СОДЕРЖАНИЕ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 3 Зависимость активности L-аспарагиназы вариантов RrA от pH. Рисунок 4 Влияние температуры на активность L-аспарагиназы вариантов RrA. Рисунок 5 Термостабильность L-аспарагиназы мутантных вариантов RrA. Рисунок 6 Денатурация вариантов RrA в растворе мочевины, рН 7.4 (A) и рН 9.2 (B). |
Физико-химические свойства мутантных форм L-аспарагиназы из Rhodospirillum rubrum, обладающих антителомеразной активностью
1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Ключевые слова: L-аспарагиназа Rhodospirillum rubrum; сайт-направленный мутагенез; физико-химические свойства DOI: 10.18097/BMCRM00071 ВВЕДЕНИЕ Бактериальные L-аспарагиназы из Echerichia coli (EcA) и Erwinia (ErA) применяются для лечения острого лимфобластного лейкоза и некоторых лимфопролиферативных заболеваний в течение более 4-х десятилетий [1]. L-аспарагиназы (КФ 3.5.1.1.) катализируют гидролиз амидной группы боковой цепи L-аспарагина с образованием L-аспарагиновой кислоты и аммиака. Считается, что механизм цитотоксического действия и терапевтической эффективности L-аспарагиназ связан с истощением уровня свободного L-аспарагина в сыворотке крови и нарушением синтеза белка преимущественно в опухолевых клетках, отличающихся сниженным уровнем или полным отсутствием в них активности аспарагинсинтазы, в отличие от здоровых тканей [2-4]. Предполагается, что антипролиферативное (цитотоксическое) действие L-аспарагиназ сопровождается способностью фермента гидролизовать наряду с L-аспарагином и L-глутамин, что обусловливает развитие ряда побочных эффектов [5, 6]. Детальный механизм каталитического действия L-аспарагиназ, молекулярная основа их противоопухолевой активности и побочных эффектов при лечении, включая резистентность к терапии, до конца не ясны. Повышение в большинстве типов опухолей активности теломеразы, синтезирующей теломерные повторы TTAGGG на концах хромосом человека и предотвращающей их укорочение при репликации, обусловливает неограниченный потенциал клеточного деления [7]. Обычно, hTERT – каталитическая субъединица теломеразы, регулирующая уровень синтеза мультибелкового комплекса фермента – значительно активирована в опухолевых, но репрессирована в нормальных соматических клетках [8]. Повышенная активность теломеразы может быть одним из критических условий канцерогенеза, поэтому подавление функции hTERT и, следовательно, активности теломеразы является одним из подходов к терапии злокачественных опухолей [9]. Ранее нами был клонирован ген L-аспарагиназы Rhodospirillum rubrum RruA 3730 (RrA) в вектор pET23 [10]. Составной белок RrА17N,E149R включает 17N-концевую аминокислотную последовательность (MASMTGGQQMGRGSSRQ) с капсидным пептидом бактериофага Т7 [11]. Мутантная форма внутриклеточной L-аспарагиназы из Rhodospirillum rubrum RrA17N,K149E проявляла цитотоксическую (антипролиферативную) активность in vitro на клетках Jurkat, HL-60, MOLT 4 и др. [12] и in vivo у мышей с лимфаденозом Фишера L5178y [13], а также подавляла на 80% экспрессию теломеразы in vitro [14]. Вариант RrА17N,E149R,V150P с дополнительными заменами E149R и V150P еще сильнее снижал активность теломеразы до 15% от контроля в клетках Jurkat, HL-60, MOLT 4 и др. При удалении фрагмента 17N-концевой аминокислотной последовательности активность теломеразы восстанавливалась до 79% от исходного уровня (RrAE149R,150P). Вариант RrAE149R,V150P,F151T отличается от RrАE149R,V150P заменой только одного аминокислотного остатка (F151T), но его антителомеразная активность была сопоставима с таковой у мутантных форм RrА17N,E149R,V150P и RrA17N,K149E [14]. Мутантные формы RrА17N,D60K,F61L и RrA17N,A64V,E67K и др., а также используемые в медицине L-аспарагиназы EcA и ErA способностью подавлять активность теломеразы не обладают [14]. В связи с этим возникает вопрос, связано ли усиление антипролиферативных свойств мутантных форм RrA именно с изменением ферментативных свойств или c появлением новых регуляторных. RrA является первой цитоплазматической L-аспарагиназой, проявляющей антипролиферативную активность, обладающей низкой L-глутаминазной активностью (менее 0.1% от L-аспарагиназной), небольшой молекулярной массой (субъединица – 18 кДа, мономер содержит 172 аминокислотных остатка) и имеющей низкую гомологию с EcA и ErA. Варианты RrA с точечными мутациями, подавляющие активность теломеразы, представляют интерес как потенциальные противоопухолевые агенты с принципиально иным механизмом действия, в отличие от используемых в медицине L-аспарагиназ EcA и ErA. Целью настоящей работы был анализ взаимосвязи между физико-химическими и кинетическими свойствами мутантных вариантов RrA, с одной стороны, и цитотоксичностью и способностью подавлять активность теломеразы – с другой. МАТЕРИАЛЫ И МЕТОДЫ
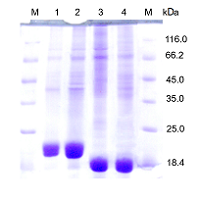
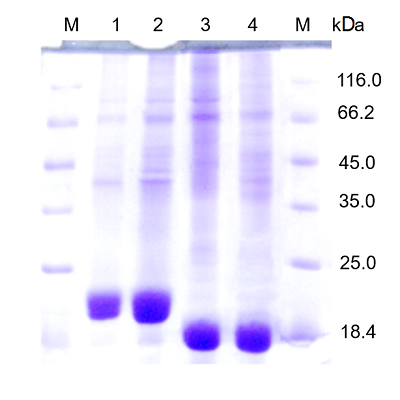
Реактивы В работе использовали: L-аспарагин («Reanal», Венгрия), глицин, KH2PO4, Na2HPO4, NaH2PO4, KCl («Serva», Германия), L-глутамин, реактив Несслера, ТХУ, бакто-триптон, бакто-дрожжевой экстракт («Fluka», Швейцария); NaOH, Na2B4O7x10 Н2O, глюкоза, лактоза («Merck», Германия); Tris («Bio-Rad», США); HCl, CH3COOH, CH3COONa («Реахим», Россия), ферменты и реактивы для ПЦР («СибЭнзим», Россия). Бактериальные штаммы и их культивирование Штаммы Escherichia coli XL-blue («Stratagen», Германия) и BL21(DE3) («Novagen», США) культивировали согласно условиям, описанным ранее [10, 12]. Индуктор (лактозу) добавляли в среду при OD600 ~1.2 до конечной концентрации 0.2%. Спустя 14 – 20 ч после индукции клетки собирали центрифугированием при 2500 g, 15 мин. Мутантные формы RrA RrAE149R,V150P,F151T, RrА17N,E149R,V150P, RrАE149R,V150P были получены с помощью сайт-направленного мутагенеза («Quik Change») Single-Primer Reactions in Parallel, используя вектор pET23a («Novagen», США), несущий ген RrA в качестве матрицы [12]. Мутации были подтверждены секвенированием ДНК по методу Sanger и др. [15]. Выделение и очистка L-аспарагиназ Стадии выделения и очистки L-аспарагиназ из клеток штамма-продуцента включали ультразвуковую обработку суспензии клеток, удаление дебриса центрифугированием (35000 g, 30 мин), две стадии ионообменной хроматографии на колонках с Q-Sepharose («Pharmacia», Швеция) и DEAE-Toyopearl 650m («ToyoSoda», Japan), ультрафильтрацию, обессоливание и концентрирование на PM10 мембранах («Millipore», США) в ячейке «Amicon», как описано ранее [12]. Все стадии очистки проводили при 4°С. Препараты L-аспарагиназ были стабилизированы глюкозой (до конечной концентрации 0.5%) и лиофилизированы. Ферменты хранили при -80°С. ПААГ-электрофорез и определение молекулярной массы и концентрации белка Концентрацию белка определяли методом Sedmak [16], используя в качестве стандарта бычий сывороточный альбумин. Чистоту белка и его молекулярную массу определяли при помощи электрофореза в 12.5%-ном ПААГ в присутствии ДДС-Na по методу Laemmli, используя в качестве контроля Protein Molecular Weight marker (#SM0431, «Thermo Fisher Scientific Inc», США) [17]. Определение ферментативной активности L-аспарагиназы Об активности фермента судили по количеству образовавшегося аммиака, которое определяли методом прямой несслеризации [18]. За единицу активности L-аспарагиназы (1 МЕ) принимали количество фермента, катализирующее высвобождение 1 мкмоль аммиака в мин при 37°С. Удельную активность выражали в ME/мг белка. Субстратную специфичность вариантов RrA оценивали этим же методом, используя в качестве субстрата L-аспарагин, L-глутамин, D-аспарагин в концетрации 8 – 200 мM. Влияние ионной силы на ферментативную активность вариантов RrA Зависимость активности RrA от ионной силы исследовали в 0.01 M NaHCO3 и 0.1 M Na-фосфатном буферах (pH 7.4), изменяя концентрацию КСl от 0 до 3 М. Влияние рН на ферментативную активность вариантов RrA Активность очищенного фермента (pHопт) изучали в интервале pH 4.5 – 9.7 при 37ºС с L-аспарагином в качестве субстрата, как описано ранее [12]. Влияние температуры на ферментативную активность RrA Температурный оптимум активности L-аспарагиназы (Топт) определяли в инкубационной смеси в 0.1 М Na-фосфатном буфере (pH 7.4) при температуре 25 – 70°С, как описано ранее [12,19]. Температурная и химическая денатурация Температурную денатурацию изучали в реакционной смеси (без субстрата), содержащей фермент и 0.1 M Na-фосфатный буфер (pH 7.5), прогретой при 30 – 80ºС в течение 10 мин. После инкубации стандартным способом оценивали остаточную ферментативную активность [18] и выражали её как процент активности прогретого фермента по отношению к непрогретому. Т50 – значение температуры, при которой фермент теряет 50% своей активности. Химическую денатурацию изучали при инкубации фермента (без субстрата) при 37ºС в течение 1 ч при концентрации мочевины 0 – 8 М в 0.1 M Na-фосфатном буфере, (pH 7.4 и 9.2). После этого определяли остаточную активность фермента. За 100% принимали активность фермента при 37°С в отсутствии мочевины. Кинетические свойства Определение кинетических параметров ферментов проводили, как описано ранее [12], в 0.1 М Na-фосфатном буфере pH 7.5 и боратном буферах рН 9.2. Обработку полученных данных и расчет Km и Vмакс. проводили при помощи программы Prism software version 7 («Graph pad», США). Расчетные характеристики белка, определяющие его стабильность в растворе, анализировали с помощью ProtParam, доступной на сайте http://tw.expasy.org/tools/protparam.html. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Проведено сравнение некоторых физико-химических и каталитических свойств вариантов RrА с точечными аминокислотными заменами: RrА17N,D60K,V150P, RrA17N,A64V,E67K, RrA17N,K149E,RrAE149R,V150P, RrA17N,E149R,V150P и RrAE149R,V150P,F151T, обладающих различной цитотоксической активностью и способностью подавлять экспрессию hTERT субъединицы теломеразы и активность теломеразы как in vitro, так и in vivo [12,13,14]. Выделение и очистка RrA вариантов При последовательной хроматографии бесклеточных экстрактов на колонках с Q-Sepharose и DEAE-Toyopearl 650m происходило удаление большей части балластных белков; хотя при этом терялось около 10% целевого белка, удельная активность фермента возрастала примерно в 7 – 8 раз, составляя около 170, 135, 140 и 130 МЕ/мг белка для вариантов RrA17N,K149E, RrAE149R,V150P, RrА17N,E149R,V150P и RrAE149R,V150P,F151T, соответственно. Видно, что внесенные точечные мутации несколько снижают удельную активность фермента. Молекулярная масса и чистота мутантных форм RrA Определение молекулярной массы и степени чистоты целевого белка проводили с помощью электрофореза в 12%-ном ДСН-ПААГ по методу Laemmli. На электрофореграмме очищенных препаратов выявлялись полосы в области 21 кДа для вариантов RrA17N,K149E, RrА17N,E149R,V150P и 18 кДа для вариантов RrАE149R,V150P, RrAE149R,V150P,F151T (рис. 1). По результатам обработки данных электрофореза с помощью программы Gel-Proanalyzer 3.1.00.00 («MediaCybernetics», США) чистота целевых белков составила не менее 82%.
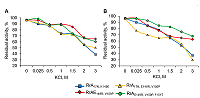
Субстратная специфичность вариантов RrA Изучение субстратной специфичности мутантных форм RrA проводили в стандартных условиях. Концентрация субстратов составляла 10 – 170 мМ в 0.1 М Na2HPO4–NaH2PO4 буфере (рН 7.4). Все изученные варианты RrA, снижающие активность теломеразы, сохраняли сходную способность гидролизовать L-аспарагин, как и варианты, не проявляющие антителомеразного действия – RrА17N,D60K,F61L и RrA17N,A64V,E67K [12, 14]. Незначительная активность при использовании D-аспарагина и L-глутамина в качестве субстратов составляла не более 1.6% и 0.1% от L-аспарагиназной, соответственно. Есть сообщения, что снижение L-глутаминазной активности у мутантов EcA и ErA сопровождалось уменьшением L-аспарагиназной активности; у мутантов L-аспарагиназы Helicobacter pylori (HpA) L-аспарагиназная активность сохранялась, но при этом отсутствовало цитотоксическое действие на HL-60 клетки [20, 21]. Низкая L-глутаминазная активность (не более 1%) известна лишь у небольшого числа бактериальных L-аспарагиназ [10, 22, 23, 24]. Зависимость активности мутантных вариантов RrA от ионной силы В отличие от полноразмерных L-аспарагиназ HpA и EcA и др., все варианты RrA проявляли выраженную зависимость активности от концентрации KCl в 0.1 М Na-фосфатном буфере или 0.01 М карбонатном буфере (pH 7.4). При увеличении концентрации КСl от 0 до 3.0 М в инкубационной среде активность всех мутантных форм RrA пропорционально снижалась (рис. 2), что согласуется с нашими предыдущими данными [12].
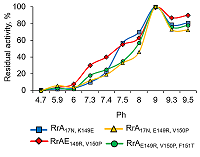
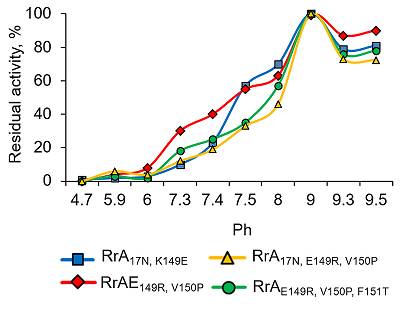
Зависимость активности всех вариантов RrA от ионной силы раствора указывает на преобладание электростатических взаимодействий в связывании молекул субстрата в активном центре и/или в стабилизации ферментного комплекса. Влияние рН на ферментативную активность вариантов RrA Зависимость активности вариантов RrA от рН среды изучали в разных стандартных буферных системах: натрий-ацетатной (pH 3.0 – 6.0), натрий-фосфатной (pH 6.0 – 8.0), Tris-HCl (pH 7.0 – 9.0) и боратной (pH 9.0 – 11.0) (рис. 3.).
Как видно из рисунка 3, зависимость активности L-аспарагиназы у всех изученных вариантов от pH была почти идентичной и имела куполообразную форму. Оптимум pH наблюдался в зоне значений 8.5 – 9.0. Введенные в целевой белок замены расположены вдали от активного центра [12], чем можно объяснить отсутствие различий в pHопт у исследованных вариантов RrA c различной антителомеразной активностью. При физиологическом значении pH 7.4 L-аспарагиназная активность RrA составляла 30 – 40% от максимальной и практически исчезала при pH 6.0. В то же время большинство известных рекомбинантных полноразмерных микробных L-аспарагиназ, в том числе используемых в медицине, имеют рН оптимум в более широком интервале (4.0 – 11.0) [23-27]. Следовательно, проявление антипролиферативных (антителомеразных) свойств мутантных форм RrA не связано с увеличением L-аспарагиназной активности при физиологических значениях pH. Влияние ионов металлов и некоторых реагентов на активность мутантных форм RrA Одной из важных характеристик ферментов является их чувствительность к воздействию ионов металлов, компонентов буферных растворов и специфических реагентов, что дает представление об оптимальных условиях проявления ферментативной активности и важности для катализа тех или иных функциональных групп белковой молекулы. В таблице 1 приведены результаты влияния некоторых металлов и реагентов на активность мутантных форм RrA. Ионы K+, Ca2+, Zn2+, Cs+, Co2+ существенно не влияли на активность L-аспарагиназы. Ионы Mn2+, Cu2+, Fe3+ снижали активность на 50 – 60%, а KMnO4 – на 80%. Ионы Mg2+ стимулировали активность фермента на 30%. Разнонаправленный эффект ионов металлов на активность различных L-аспарагиназ [23, 28, 29] может быть связан с их влиянием на образование фермент-субстратного комплекса или на структуру белковой молекулы. Обнаружение участка связывания цинка в бактериальных L-аспарагиназах ІІ типа Escherichia coli (EcAII) предполагает влияние металлов на противоопухолевую активность и иммунологический ответ [30].
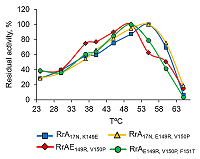
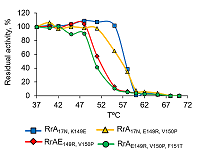
Подобно другим L-аспарагиназам, мутантные формы RrA, проявляющие также антителомеразный эффект, не являются металлозависимыми (проба с ЭДТА), не содержат SH-групп (проба с иодацетамидом), остатки серина (проба с PMSF) и цистеина (пробы с иодацетамидом и меркаптоэтанолом) в активном центре. Возможно, в активном центре присутствует карбоксильная группа (проба с KMnO4). Интересно, что активность всех вариантов RrA зависела от состава буферного раствора. Так, при рН 7.4 в 0.1 М Na-фосфатном буфере активность L-аспарагиназ была примерно в 2 раза ниже, чем в 0.1 М Tris-HCl буфере. Эти различия усиливались при повышении рН до 9.2. По данным литературы Tris способен увеличивать термодинамическую стабильность и активность некоторых функциональных белков и вовлекаться в ферментативные реакции, влияя на сайты связывания ферментов с металлами и, следовательно, на сродство к субстрату и каталитическую активность [31]. При этом возможно взаимодействие Tris с определённым белковым мотивом и формирование так называемого «кармана», являющегося своеобразным аллостерическим центром, в то время как Tris и его аналоги выступают в роли лигандов-эффекторов. Присоединение такого лиганда к аллостерическому центру изменяет третичную и/или четвертичную структуру молекулы фермента и, соответственно, конфигурацию его активного центра, вызывая изменение стабильности или ферментативной активности. Влияние температуры на активность вариантов RrA Влияние температуры на активность вариантов RrA изучали в диапазоне 20 – 70°С в Nа-фосфатном буфере при физиологических значениях рН 7.4. Как видно из рисунка 4, варианты RrA17N,E149R,V150P и RrAE149R,V150P,F151T, максимально подавляющие активность теломеразы (до 15% от исходного уровня) [12], имеют различный температурный оптимум. Варианты RrA, не влияющие на активность теломеразы (RrА17N,D60K,F61L и RrA17N,A64V,E67K) [12], также различаются по Топт (58ºС и 53ºС, соответственно). Сдвиг Топт с 56ºС для RrA17N,149E и RrА17N,E149R,V150P до 50ºС для вариантов RrAE149R,V150P,F151T и RrАE149R,V150P, возможно, определяется наличием или отсутствием дополнительной последовательности 17N. При физиологической температуре 37ºС L-аспарагиназная активность составляла ~ 50 – 60% от максимальной. Повышение температуры выше 57°С приводило к резкому падению активности фермента вплоть до полной инактивации при 65ºС всех вариантов RrA.
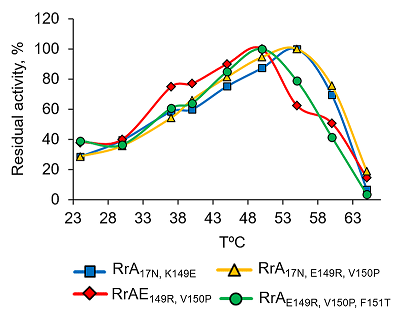
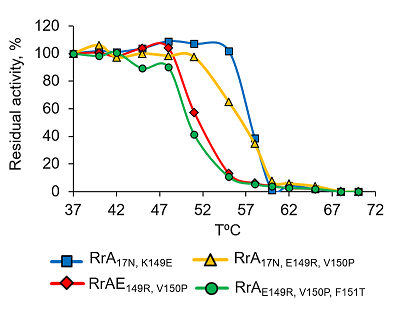
Термостабильность вариантов L-аспарагиназы RrA Оптимальная температура действия фермента тесно связана с его термостабильностью. Мутантные формы RrA инкубировали в 0.1 М К-фосфатном буфере (рН 7.4) при различных температурах в течение 10 мин, после чего определяли активность фермента. Как видно из рисунка 5, прогревание до температуры 47°С практически не влияло на активность рекомбинантных вариантов RrA, что согласуется с предыдущими исследованиями.
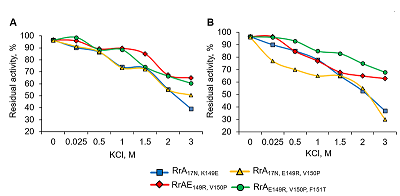
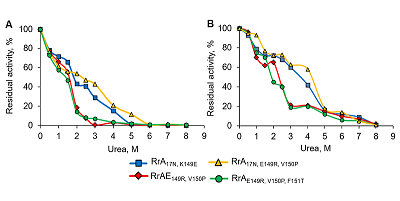
Значение Т50 для RrA17N,K149E, и RrА17N,E149R составляет 57 – 58ºС, а для RrАE149R,V150P и RrAE149R,V150P,F151T – 51ºС. При этом наибольшее снижение L-аспарагиназной активности наблюдалось в интервале температур от 52ºС до 60ºС. После 10 мин прогревания при 62°С все мутантные формы RrА почти полностью инактивировались. Зависимость активности фермента RrA от температуры аналогична таковой для препаратов, применяемых в клинической практике, однако, EcA и ErA а также YpA и др. более стабильны при повышенных температурах [25,32]. L-аспарагиназная активность мутантных форм RrA сохранялась на уровне > 95% от начальной в течение 3 сут. при температуре от 4ºС до 37ºС. Мутанты RrA были стабильны в течение 16 мес. при -20 – 70ºС в 10 мМ K-фосфатном буфере, содержавшем 1 M глицин, 1 мМ ЭДТА, 0.28 M КСl и 0.5% глюкозу. После 20 циклов замораживания-оттаивания все изученные мутантные формы RrA сохраняли не менее 80% исходной L-аспарагиназной активности. Стабильность RrA была аналогичной стабильности EcA и HpA, однако ErA была менее устойчива при замораживании-оттаивании [25, 32]. Стабильность RrA резко возрастала после лиофилизации. Влияние химической денатурации на стабильность вариантов RrA Исследована устойчивость вариантов RrA к денатурации в растворе мочевины в концентрации от 0 до 8 М в 0.1 М Na-фосфатном буфере при рН 7.4 и 9.2 (рис. 6). При инкубации RrA в течение 1 ч с 0 – 3 М мочевиной при рН 7.4 обнаружено резкое снижение L-аспарагиназной активности. Так, в присутствии 2 М мочевины активность вариантов RrA17N,K149E, RrA17N,E149R,V150P снижалась на 50%, а RrAE149R,V150P, RrAE149R,V150P,F151T на 80% от исходной. При возрастании концентрации мочевины до 6 М фермент полностью инактивировался.
Повышение рН до 9.2 оказывало стабилизирующее действие на целевой белок. Как и при физиологических значениях рН 7.4, варианты RrA17N,K149E и RrA17N,E149R,V150P были более стабильными, чем RrAE149R,V150P, RrAE149R,V150P,F151T. Инактивация RrA17N,K149E и RrA17N,E149R,V150P на 50% наблюдалась при концентрации мочевины 4 М, в то время как RrAE149R,V150P и RrAE149R,V150P,F151T в этих условиях теряли 80% активности. Полная инактивация всех вариантов RrA при рН 9.2 происходила в 7 – 8 М растворе мочевины. Из представленных результатов очевидно, что присутствие фрагмента 17N в составе мутантных вариантов RrA17N,K149E и RrA17N,E149R,V150P и RrА17NN,D60K,F61L [12] придает им большую стабильность по отношению не только к термоденатурации, но и к химической денатурации. В то же время взаимосвязи между устойчивостью к химической денатурации и способностью подавлять активность теломеразы не наблюдалось. В отличие от RrA, полноразмерные L-аспарагиназы HpA и ErA и др. стабильны в присутствии 3 M мочевины при рН 7.4 [25, 32]. Мочевина не приводит к денатурации L-аспарагиназы из Pyrococcus furiosus, и инактивация фермента наблюдается только в присутствии гуанидингидрохлорида [24]. Повышенная чувствительность L-аспарагиназной активности RrA к присутствию даже 1 M мочевины при pH 7.4 указывает на слабые водородные связи в белке и важность его структурной организации для функционирования фермента. Кинетические свойства вариантов RrA В 0.1 М K-фосфатном буфере (pН 7.4) значения Кm для L-аспарагина у мутантных форм в различной степени подавляющих теломеразную активность: RrA17N,K149E, RrAE149R,V150P, RrА17N,E149R,V150P, RrAE149R,V150P,F151T отличаются незначительно и составляют соответственно 0.413 ± 0.180 мМ; 0.501 ± 0.210 мМ; 0.385 ± 0.122 мМ; 0.348 ± 0.143 мМ. Наименьшим значением Кm 0.237 ± 0.07 мM в фосфатном буфере из всех мутантных форм RrA обладает RrА17N,D60K,F61L [12], однако она не влияет на теломеразную активность [14]. В 0.1 М боратном буфере pH 9.2 соответствующие величины Кm (мМ) для L-аспарагина были несколько ниже (0.250 ±0.098 мМ; 0.227 ± 0.087 мМ; 0.287 ± 0.156 мМ; 0.181 ± 0.087 мМ), что указывает на большее сродство ферментов к субстрату. Близость значений Кm у различных мутантных форм RrA может объясняться отдаленностью районов мутаций от участков белковой молекулы, участвующих в ферментативном катализе. Значения Vmax (мМ/мин) в отношении L-аспарагина у мутантных форм RrA17N,K149E, RrAE149R,V150P, RrА17N,E149R,V150P, RrAE149R,V150P,F151T были выше в 2 раза при рН 9.2 в боратном буфере (соответственно 43.29 ± 8.19 мМ; 44.98 ± 11.03 мМ; 39.33 ± 7.89 мМ; 42.24 ± 8.56 мМ), чем в K-фосфатном pH 7.4 (22.82 ± 7.67 мМ; 38.07 ± 10.12 мМ; 17.72 ± 9.45 мМ; 18.94 ± 8.99 мМ соответственно). Величину Km для L-глутамина вариантов RrA определить методом прямой несслеризации не представлялось возможным ввиду низкой активности L-глутаминазы. Антипролиферативное действие бактериальных аспарагиназ, применяемых в клинической практике (EcА и ErA), связывают со способностью гидролизовать L-аспарагин. [2, 3, 4]. Cледовательно, чем выше сродство фермента к субстрату, характеризующееся константой Михаэлиса, тем эффективнее противоопухолевый препарат. Все бактериальные L-аспарагиназы в настоящее время принято разделять на два основных типа [33, 34]: цитоплазматические ферменты 1 типа, характеризующиеся высокой Km (10 - 3 М) для L-аспарагина, не оказывающие противоопухолевое действие (Bacillus subtilis, Pyrococcus horikoshii и др. [24, 26]), и периплазматические 2 типа, обладающие противоопухолевой активностью и имеющие высокое сродство к аспарагину (Km 10 - 5 М), например, применяемые в клинической онкологии EcA и ErA [1, 32, 33]. Особенностью рекомбинантной RrA и ее мутантных форм, роднящей ее с внутриклеточными L-аспарагиназами 1 типа, является достаточно низкое сродство к субстрату (Km ~ 0.3 – 0.5 мМ) и крайне малая L-глутаминазная активность, не зависящая от внесенных в белок мутаций (не более 0.1% от L-аспарагиназной). В противоположность существующим представлениям об отсутствии антипролиферативного эффекта у внутриклеточных L-аспарагиназ, полученные нами ранее данные позволяют утверждать, что некоторые внутриклеточные L-аспарагиназы, независимо от таксономических характеристик, все же проявляют антипролиферативное действие [10, 12, 14]. Расчетные характеристики целевого белка Индекс GRAVY, равный -0.041 – 0.072, свидетельствует о хорошей растворимости данного белка в водных растворах. Алифатический индекс, равный 85.24 – 93.08, характеризует RrA как средне термостабильную белковую молекулу. Индекс нестабильности характеризует фрагмент 17N как нестабильный, однако, по нашим данным, он придает стабильность всей молекуле фермента. Изоэлектрическая точка вариантов RrA находилась в пределах 5.37 – 5.93. Заметим, что pI 5.37 Rru_A3730 L-аспарагиназы из природного штамма и вариантов RrAE149R,V150P и RrAE149R,V150P,F151T несколько выше клонированного нами RrAK149E (pI 5.05), что объясняется заменой положительно заряженного Lys на отрицательно заряженную Glu в положении 149. Наличие фрагмента 17N в составных вариантах RrA17N,K149E, RrА17N,E149R,V150P повышало pI до 5.40 и 5.93 соответственно. ЗАКЛЮЧЕНИЕ По степени возрастания ингибирования активности теломеразы (и антипролиферативной активности) варианты RrA можно расположить в следующей последовательности: RrА17N,D60K,F61L и RrA17N,A64V,E67K (0%) < RrAE149R,V150P (20%) < RrA17N,K149E (80%) < RrAE149R,V150P,F151T (83%) < RrА17N,E149R,V150P (85%) [14]. Однако соответствующих различий в кинетических свойствах, зависимости активности от ионной силы и значения оптимума рН у всех изученных мутантных форм L-аспарагиназ RrA не наблюдалось. Это можно объяснить тем, что внесенные в молекулу RrA аминокислотные замены 17N, E149R, V150P, F151T, влияющие на активность теломеразы, не затрагивают активный сайт фермента. Более того, вариант RrА17N,D60K,F61L имеет лучшие кинетические свойства и стабильность [12], но не влияет на активность теломеразы. Противоопухолевое действие мутантов RrA ниже, чем L-аспарагиназы EcA, что, вероятнее всего, связано с отличающимся на порядок значением Km или объясняется повышенной чувствительностью вариантов RrA к неоптимальным физиологическим значениям рН и температуры по сравнению с EcA. Варианты RrA не являются металлозависимыми, не содержат SH-групп, остатков серина и цистеина в активном центре. Вероятно, в активном центре присутствует карбоксильная группа. В отличие от EcA и ErA, на активность RrA влияет состав буферного раствора. При использовании 0.1 М Na-фосфатного буфера активность была примерно в 2 раза ниже, чем в 0.1 М Tris-HCl (рН 7.4) буфере. Различия усиливаются при повышении рН до 9.2. Вопреки предположению о том, что фрагмент 17N (MASMTGGQQMGRGSSRQ) слишком мал, чтобы влиять на целевой белок [10], присутствие в структуре вариантов RrA этой последовательности придает им большую устойчивость как к термоденатурации, так и к денатурации мочевиной. Например, в присутствии 2 М мочевины в 0.1 М K-фосфатном буфере (рН 7.4) наблюдается потеря 50% от исходной активности вариантов RrA17N,K149E, RrA17N,E149R,V150P и потеря 80% исходной активности вариантов RrAE149R,V150P, RrAE149R,V150P,F151T. Структурные различия проявляются также в сдвиге температурного оптимума с 56ºС для вариантов, несущих дополнительный фрагмент 17N, RrA117N, K149E, RrА17N,E149R,V150P до 50ºС для вариантов RrAE149R,V150P,F151T, RrАE149R,V150P, у которых этот фрагмент отсутствует. Если усиление цитотоксических (антипролиферативных) свойств мутантных форм RrA17N,K149E, RrА17N,E149R,V150P можно связать со стабилизирующим действием фрагмента 17N, то подавление пролиферации вариантами RrAE149R,V150P, RrAE149R,V150P,F151T требует другого объяснения. Возможно, что способность некоторых мутантных форм белка Rru_A3730 снижать экспрессию каталитической субъединицы hTERT и, следовательно, активность теломеразы одновременно с удалением L-аспарагина из среды, является причиной усиления их антипролиферативных свойств. БЛАГОДАРНОСТИ Авторы выражают глубокую благодарность к.б.н. Беляевой Наталье Федоровне (Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича) за участие в обсуждении результатов и Василию Николаевичу Лазареву (ФНКЦ физико-химической медицины) за секвенирование ДНК. ФИНАНСИРОВАНИЕ РАБОТЫ Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013-2020 годы и частичной финансовой поддержке РФФИ (грант №15–34–70020). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ЛИТЕРАТУРА
|