|
Оптимизация иммуноферментного метода для определения цилиарного нейротрофического фактора в слезной жидкости человека
1«Научно-практический психоневрологический центр Департамента здравоохранения г. Москвы», 115419 Москва, ул. Донская 43;*e-mail: druzhkova.tatiana@mail.ru Ключевые слова: цилиарный нейротрофический фактор; слезная жидкость; иммуноферментный анализ DOI: 10.18097/BMCRM00079 ВВЕДЕНИЕ Цилиарный нейротрофический фактор головного мозга человека – ciliary neurotrophic factor (CNTF) представляет собой одноцепочечный полипептид из 200 аминокислотных остатков с молекулярным весом 22.7 кДа. Известно, что он обнаруживается преимущественно в шванновских клетках и астроцитах 1 типа, важен для дифференцировки, питания и защиты развивающихся и поврежденных нейронов и глиальных клеток [1,2,3]. Ранее было показано, что CNTF выявляется и играет важную роль в метаболизме клеточных структур глаза животных. Сам фактор или его рецептор были обнаружены в наружных сегментах фоторецепторов [4], в ганглиозных клетках [4,5], во внутренних ядерных слоях сетчатки [6], в глиальных клетках Мюллера [4], в клетках решетчатой пластинки и астроцитах головки зрительного нерва [7,8]. Повышенное внимание к CNTF в офтальмологии в последние годы отчасти связано с клинической апробацией фирмой «Neurotech» (США) импланта NT-501, способного длительно продуцировать CNTF внутри глаза [9] и обеспечивать терапевтический эффект при некоторых офтальмологических заболеваниях [10,11]. К сожалению, работ по изучению роли CNTF в метаболизме нервных клеток глаза, выполненных на клиническом материале, очень мало, хотя выявление и количественный анализ CNTF в слезной и внутриглазной жидкости человека представляются крайне важными для уточнения патогенеза, мониторинга и оценки эффективности лечения многих тяжелых заболеваний органов зрения, в частности, глаукомы. Отчасти это обусловлено методическими трудностями количественного определения CNTF в биологических жидкостях глаза. Немногочисленные исследования в этом направлении проводились на дорогостоящем оборудовании с использованием сложных методик [12], выполнение которых затруднительно в условиях лечебных учреждений. Целью представленной работы были подбор и оптимизация доступного лабораторного метода количественного определения CNTF в слезной жидкости (СЖ, LF) человека. Общеизвестно, что иммуноферментный анализ (ИФА) позволяет с высокой специфичностью, чувствительностью и точностью определять крайне малые количества вещества в биологическом материале, обладая при этом стабильностью реагентов и простотой использования. Поэтому была предпринята попытка подобрать условия, при которых коммерческий набор для выявления CNTF в сыворотке, плазме крови человека и супернатантах клеточных культур Human CNTF Quantikine ELISA Kit («R&D Systems», США) можно было бы применить к анализу CNTF в СЖ. Основной проблемой, с которой пришлось столкнуться при попытке определения CNTF в СЖ при помощи указанного набора, оказалось недостаточное для анализа количество СЖ, собранной от каждого человека, особенно при офтальмологических патологиях, сопровождающихся синдромом «сухого глаза». Вынужденное разбавление СЖ перед анализом значительно снижало и так невысокую концентрацию CNTF в СЖ. При расчете концентрации по калибровочному графику (диапазон концентраций стандарта CNTF от 31.2 пг/мл до 2000 пг/мл, разбавитель - RD6-3), рекомендованному производителем, практически все результаты измерения попадали в область ниже уровня первого калибратора. Были поставлены следующие задачи:
МАТЕРИАЛЫ И МЕТОДЫ Пробоподготовка Забор стимулированной (выработанной слезной железой в ответ на механическое раздражение роговицы) СЖ в объеме 120 (70 - 150) мкл проводили из нижнего конъюнктивального свода пипеточным дозатором у 37 добровольцев без выявленных офтальмологических нарушений (средний возраст 65.7 (55 - 75) лет) после получения у них информированного согласия на участие в эксперименте. Полученный материал смешивали, разливали по 400 мкл, сразу замораживали и хранили при температуре 20°C не более трех мес. Перед проведением анализа пробы СЖ размораживали, доводили до комнатной температуры, центрифугировали при 4000 g с использованием лабораторной центрифуги Allegra Х-30R («Beckman Coulter», США) 10 мин и обрабатывали по методике, предложенной Okragly A.J. et al. [13]. Для этого в образцы СЖ с разной степенью разведения добавляли раствор 1 М HCl до рН 2.6 и инкубировали в течение 20 мин при постоянном перемешивании при помощи миксера Intelli Mixer RM-1L («ELMI», Эстония), затем нейтрализовали раствором 1М NaOH до рН 7.4. ИФА Концентрацию CNTF в СЖ определяли твердофазным методом ИФА с использованием набора Human CNTF Quantikine ELISA Kit на автоматическом иммуноферментном/биохимическом анализаторе ChemWell® 2910 Combi («Awareness Technology Inc.», США). Указанный прибор обеспечивал автоматизацию всех этапов выполнения анализа с точной системой дозирования (коэффициент вариации менее 1%) и считывания результатов измерений (коэффициент вариации менее 1%). Для проведения ИФА были использованы:
Для построения калибровочного графика проводили последовательные разведения стандарта (рекомбинантного человеческого CNTF) в диапазоне концентраций от 3.9 до 250 пг/мл. Для разведения стандарта и проб СЖ использовали: разбавитель для сывороток RD6-3, разбавитель для клеточных культур RD5P, стерильный фосфатный буфер (PBS, рН 7.4) с добавлением 0.1% раствора бычьего сывороточного альбумина (ВSA), PBS (рН 7.4) с добавлением 1% ВSA, PBS (рН 7.4) с добавлением 4% ВSA, проводя сравнительную оценку параметров тест-системы при разных разбавителях. Процедура проведения анализа полностью соответствовала инструкции производителя («R&D Systems»). Оптическая плотность проб измерялась с использованием основного фильтра 450 нм, отсекающего – 630 нм. Оценка параметров тест-системы Для каждого из перечисленных вариантов разбавителей трижды (в дублях) определяли основные параметры калибровочного графика и графика при разведении проб СЖ, ориентируясь на рекомендации Института клинических и лабораторных стандартов (CLSI), раздел EP-6А [14]. Степень увеличения определяемой концентрации CNTF после кислотной обработки проб СЖ на разных уровнях ее разведения оценивали по соотношению результатов измерений предварительно обработанных и не обработанных образцов. Интерферирующий эффект матрицы оценивали, ориентируясь на рекомендации CLSI, раздел EP14 А2 [15]. В предварительно обработанные кислотой пробы СЖ без разведения и с разведением в 4 раза добавляли известные концентрации рекомбинантного человеческого CNTF (50 пг/мл и 100 пг/мл) с последующим определением концентрации в пробах СЖ без добавления и с добавлением эндогенного CNTF и оценкой восстановления (соотношения измеренной и ожидаемой величин). В качестве дополнительного контрольного материала использовали контроль первого уровня QC20 P176824 («R&D Systems») с установочными значениями от 175 до 285 пг/мл для супернатантов клеточных культур (разбавитель – RD5P) и установочными значениями от 183 до 299 пг/мл для сыворотки крови (разбавитель – RD6-3). Для оценки погрешности результатов измерений на разных уровнях калибровочного графика (от 0 до 250 пг/мл) использовали три степени разведения контроля QC20 P176824 (1:1; 1:10; 1:100). Оценку погрешности измерений концентрации CNTF проводили в соответствии с рекомендациями CLSI, раздел EP5-А [16]. Внутрисерийную воспроизводимость оценивали, выполняя в одной аналитической серии по 10 повторных измерений контрольных образцов QC20 P176824 с разной степенью разведения и проб сливной СЖ в разведении 1:3 после их кислотной обработки. Межсерийную воспроизводимость оценивали с использованием перечисленных выше контрольных материалов в 10 аналитических сериях, проводя по 4 повторных измерения каждой пробы в каждой аналитической серии. Предел аналитической чувствительности метода в используемой тест-системе ИФА был определен в соответствии с рекомендациями CLSI, раздел EP17 [17]. Для этого выполнили 50 измерений разбавителя PBS (рН 7.4) с 1% ВSA и 50 измерений контроля QC20 P176824 в разведении 1:100. Статистическая обработка результатов Статистическую обработку результатов проводили в программе STATISTICA for Windows, ver. 10.0. Результаты представлены в виде среднее ± стандартное отклонение (M ± SD), указан также коэффициент вариации (CV). Сравнения проводили с помощью t-критерия Стьюдента. Линейность калибровочных графиков и результатов измерений при разведении СЖ для разных разбавителей проверяли с помощью теста Уалда-Вольфовица. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Сравнительный анализ калибровочных графиков при использовании разных разбавителей Для оценки возможности расчета концентрации CNTF в области низких значений при помощи калибровочного графика от 0 до 250 пг/мл представлялось целесообразным подобрать разбавитель для стандарта и образцов сливной СЖ с минимальным интерферирующим фоном. Полученные данные представлены в таблице 1.
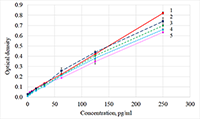
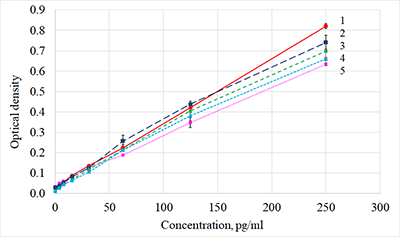
Калибровочные графики с использованием всех протестированных разбавителей в диапазоне концентраций от 0 до 250 пг/мл были линейны с высоким коэффициентом корреляции (табл. 1). Чувствительность метода определения при использовании разных разбавителей оценивали по углу наклона калибровочного графика. Достоверно более высокая чувствительность метода определения, выявленная при использовании RD6-3 (табл. 1) была обусловлена значимым различием между значениями калибраторов с большими значениями CNTF (выше 100 пг/мл) (рис. 1).
В области низких концентраций (0-50 пг/мл), куда попадали практически все значения CNTF, определяемые в СЖ (табл. 2), достоверного различия в чувствительности метода определения при использовании различных разбавителей не было. Поэтому при выборе разбавителя для последующего анализа более важными представлялись такие характеристики как низкий фон и средние показатели CV измерений стандарта, контрольного материала и проб СЖ, полученные с его использованием. Оптимальное соотношение указанных параметров имело место при использовании PBS с 1% ВSA (табл. 1).
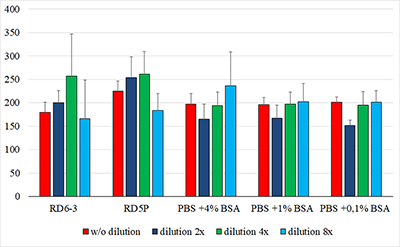
Влияние предварительной кислотной обработки проб СЖ на уровень детектируемой концентрации CNTF методом ИФА Ранее было показано, что кислотная обработка биологического материала повышает степень выявления ряда нейротрофических факторов, в частности, фактора роста нервов, нейротрофина-3, глиального нейротрофического фактора, нейротрофического фактора головного мозга, а также трансформирующего фактора роста при последующем определении их методом ELISA [13,18,19]. Точный механизм этого явления не ясен. По мнению ряда авторов это может быть связано с высвобождением биоактивных форм факторов из их проформ. Также вполне возможно, что кислотная обработка биологического материала способствует отщеплению части лигандов от поверхностных рецепторов исследуемых факторов, повышая их доступность к иммунологическому связыванию с антителами при проведении ИФА [13]. Мы попробовали использовать этот опыт для повышения уровня выявляемого количества CNTF при определении его в СЖ. Одновременно с анализом параметров тест-системы ИФА при смещении калибровочного графика в область низких концентраций была предпринята попытка повысить определяемый уровень CNTF предварительной кислотной обработкой проб сливной СЖ без разбавления и при разведении в 2, 4 и 8 раз. Для разведения СЖ использовали пять вариантов разбавителей (рис. 1) с проведением сравнительного анализа полученных результатов. Предварительная кислотная обработка образцов СЖ позволила в среднем вдвое достоверно повысить в них определяемый уровень концентрации CNTF (p < 0.005) (табл. 2). При этом не было обнаружено зависимости эффекта кислотной обработки проб СЖ от степени разведения и использованного разбавителя (рис. 2).
Линейность результатов измерений концентрации CNTF в пробах СЖ при ее разведении Для оценки линейности графика при разведении проб сливной СЖ использовали ее кратные разведения (2, 4, 8 раз). Линейная зависимость графиков с высоким коэффициентом корреляции имела место при использовании всех протестированных разбавителей (табл. 1). При этом угол наклона для графиков разведения проб СЖ разбавителями RD5P (79% - 137%), PBS с 4% ВSA (96% - 125%), PBS с 0.1% ВSA (90% - 129%), PBS с 1% ВSA (98% - 115%) не отличался от графика с использованием RD6-3 (табл. 1). Степень отклонения определяемых значений CNTF, полученных при разведении СЖ, от ожидаемых (значений СЖ без разведения, разделенных на степень разведения) оценивали по их соотношению, выраженному в процентах. При сопоставлении этих показателей на разных уровнях разведения оказалось, что лучшие показатели близости определяемых значений CNTF в СЖ к ожидаемым величинам имели место при применении PBS с 1% ВSA (98% - 115%) по сравнению с другими разбавителями: RD6-3 (76% - 108%), RD5P (79% - 137%), PBS с 4% ВSA (96% - 125%), PBS с 0.1% BSA (90% - 129%). При сравнении CV результатов измерений проб сливной СЖ на разных уровнях разведения выбранными разбавителями (табл. 2), оказалось, что лучшая комбинация показателей была при разведении СЖ в 4 раза PBS с 1% ВSA, совмещенном с её кислотной обработкой (CV = 4.2%). Поэтому для последующих серий экспериментов был использован именно этот вариант предварительной подготовки проб СЖ. Оценка влияния матрицы на результаты измерения Биологическая жидкость, в которой определяют измеряемый анолит и растворы для ее разведения могут влиять на результаты измерений в ИФА. Поскольку используемый нами набор Human CNTF Quantikine ELISA Kit был адаптирован на определение CNTF в сыворотке, плазме и в супернатантах клеточных культур, не было изучено сочетанное влияние СЖ и выбранного нами разбавителя (PBS с 1% BSA) на результаты измерений. После добавления 50 пг/мл или 100 пг/мл эндогенного CNTF в пробы неразведенной СЖ, подвергнутой кислотной обработке, полученные результаты измерений были близки к ожидаемым величинам и составили 91% и 96% соответственно. После добавления 50 пг/мл и 100 пг/мл эндогенного CNTF в пробы СЖ после кислотной обработки, разведенной в 4 раза, эти показатели были 96% и 99% соответственно. Полученные результаты свидетельствовали об отсутствии существенных помех со стороны СЖ и разбавителя PBS с 1% BSA на результаты измерений CNTF в используемой тест-системе ИФА. Оценка погрешности измерений Случайную погрешность результатов измерений оценивали по SD и CV, рассчитывая внутрисерийную и межсерийную воспроизводимость данных, полученных при измерении концентрации CNTF в образцах сливной СЖ после кислотной обработки, разведенной в 4 раза, и контроля QC20 P176824 первого уровня без разведения, а так же разведенного в 10 и в 100 раз. Результаты измерений оценивали по калибровочному графику в диапазоне концентраций от 0 до 250 пг/мл. В качестве разбавителя использовали PBS с 1% BSA. Показатели внутрисерийной и межсерийной воспроизводимости результатов измерений концентрации CNTF, полученные в установочных сериях контрольных материалов на разных уровнях в диапазоне концентраций от 2.5 пг/мл до 250 пг/мл соответствовали критериям приемлемости для используемого метода определения (табл. 3).
Оценку систематической погрешности результатов измерений (по смещению средних показателей полученных измерений от истинной величины) не проводили, поскольку в исследовании были использованы неаттестованные контрольные материалы (сливная СЖ и контроль QC20 P176824, аттестованный только для сыворотки и супернатантов клеточных культур)(«R&D Systems»). Оценка аналитической чувствительности тест-системы В результате проведенных измерений по схеме, указанной в разделе «Материалы и методы», предел обнаружения бланка (LOB) составил 0.33 пг/мл, предел чувствительности метода определения (LOD) оказался равным 1.01 пг/мл. Доверительный интервал при заданном доверительном уровне 95% и n = 50 составил для бланка – 0.00 ± 0.06 пг/мл, для контрольного материала с низкими значениями CNTF – 2.66 ± 0.11 пг/мл, для первого стандарта CNTF – 4.07 ± 0.14 пг/мл. ЗАКЛЮЧЕНИЕ Впервые показано, что предварительная кислотная обработка проб СЖ достоверно повышает уровень выявления CNTF, определяемого методом ИФА. Были подобраны условия для определения CNTF в СЖ указанным методом на основе набора Human CNTF Quantikine ELISA Kit. Рабочие характеристики полученной тест-системы ИФА (линейность метода, предел обнаружения, воспроизводимость, интерференция матрицы) в указанном ниже диапазоне концентраций калибровочного графика соответствовали критериям приемлемости для используемого метода определения и свидетельствовали о приемлемой точности и стабильности результатов измерений в области низких концентраций CNTF. Предварительное разведение образцов СЖ в 4 раза, совмещенное с их кислотной обработкой, оказалось оптимальным для получения стабильных результатов при проведении анализа. Таким образом, оптимизированная тест-система ИФА с приведенными ниже рабочими характеристиками может быть использована для определения CNTF в СЖ человека. Рабочие характеристики полученной тест-системы ИФА Проба: СЖ после кислотной обработки в разведении 1:3. Метод определения: твердофазный метод ИФА. Рабочая область калибровочного графика: 0 – 250 пг/мл. Разбавитель для стандарта CNTF, контроля и проб СЖ: PBS с 1% BSA. Процедура: согласно инструкции производителя. Считывание: основной фильтр 450 нм, отсекающий – 630 нм. Метод расчета по калибровочному графику: линейная регрессия y = 0.0044x + 0.0107, R2 = 0.9983. Предел аналитической чувствительности: 1.01 пг/мл. Внутрисерийная воспроизводимость для пробы: 5.4%. Межсерийная воспроизводимость для пробы: 5.2%. Близость измерения к ожидаемой величине при разведении пробы: 104%. Восстановление для пробы: 95.9 - 99%. Анализатор: Cherwell® 2910 Combi («Awareness Technology Inc.», США). БЛАГОДАРНОСТИ Работа выполнена при финансовой поддержке РФФИ, грант № 18-015-00355. ЛИТЕРАТУРА
|