|
Особенности пробоподготовки лизатов для повышения эффективности выделения белковых партнеров целевых белков, кодируемых генами 18-ой хромосомы человека
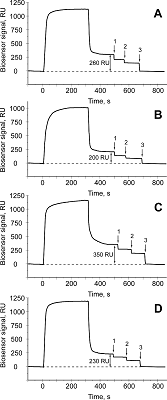
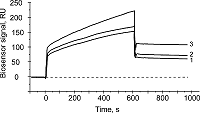
1Научно-исследовательский институт биомедицинской химии имени В.Н.Ореховича, Ключевые слова: поверхностный плазмонный резонанс; лизат HepG2; пробоподготовка лизата; закисление-нейтрализация; белковые комплексы DOI: 10.18097/BMCRM00090 ВВЕДЕНИЕ В живом организме наиболее распространенным типом макромолекул являются одиночные белковые молекулы, а также их стабильные белковые комплексы, участвующие в многочисленных биологических процессах. Протеомная идентификация и количественная характеризация белок-белковых взаимодействий являются фактически одним из главных движущих факторов в формировании целостных представлений о молекулярном узнавании. SPR (Surface Plasmon Resonance) биосенсоры получили широкое распространение в протеомных исследованиях не только в качестве независимого инструмента для прямого подтверждения белок-белковых взаимодействий, но и в различных сочетаниях с другими технологиями, такими как гель-фильтрация, аффинная хроматография, парамагнитные наночастицы и масс-спектрометрия [1-4]. Исследование субинтерактома отдельного целевого белка (белка-наживки) часто выполняют путем аффинного выделения белков-партнеров из тканевых и клеточных лизатов и последующей масс-спектрометрической идентификацией (LC/MS-MS). В такой схеме SPR анализ востребован как на финальном этапе, когда валидируют взаимодействия идентифицированных потенциальных белков-партнеров с белком-наживкой, так и перед аффинным выделением для предварительной оценки лизатов на наличие белков-партнеров, моделирования и оптимизации многих процедур аффинного выделения [5]. Фактически, эксперименты по молекулярной “рыбалке” или фишингу (от англ. molecular fishing) выполняются следующим образом. Белок-наживку ковалентно иммобилизуют на инертном сорбенте (например, BrCN-сефароза 4В) или носителе (парамагнитные наночастицы). Затем интактный тканевой (клеточный) лизат инкубируют с аффинным носителем или пропускают через хроматографическую колонку с аффинным сорбентом. Белки-партнеры из лизата, аффинно связавшиеся с белком-наживкой, элюируют, а белковый состав элюатов идентифицируют с помощью LC/MS-MS [1-4]. Тем не менее, несмотря на простоту и предсказуемость данного метода, имеются, по крайней мере, две проблемы, такие как избыточность масс-спектрометрической идентификации фоновых белков в элюатах и низкая обогащенность элюатов белками-партнерами целевой группы. Так, появление первого обусловлено выделением мультибелковых комплексов, «меченых» прямым белком-партнером, который связывается с белком-наживкой на сорбенте, что, в конечном итоге, ожидаемо приводит к снижению специфичности молекулярного фишинга вследствие контаминации элюатов фоновыми белками. Второе, напротив, вызвано тем, что в интактном лизате та или иная часть прямых белков-партнеров находится в составе стабильных комплексов «дикого типа» с самим белком-наживкой (присутствующем в лизате), а следовательно, данная группа белков-партнеров не будет в достаточной степени выделена из лизата, что отражается на снижении эффективности молекулярного фишинга. Поэтому становится очевидным, что выбор тактики пробоподготовки лизатов для аффинного выделения белков-партнеров влияет на количество и качественный состав идентифицированных LC/MS-MS белков. В настоящей работе на примере лизата клеточной культуры гепатокарциномы человека HepG2 (клетки HepG2) и ряда рекомбинантных белков, кодируемых генами 18-ой хромосомы человека, продемонстрированы модельные эксперименты под контролем SPR биосенсора, которые легли в основу модификации традиционного подхода к пробоподготовке лизатов для аффинного выделения из них белков-партнеров для целевого белка. Данный подход заключается в предварительной диссоциации стабильных белковых комплексов интактного лизата путем его кратковременного закисления и последующей нейтрализации. MАТЕРИАЛЫ И МЕТОДЫ Химические реактивы Химические реактивы были получены от «GE Healthcare» (США): 10Х HBS-N буфер (100 мМ HEPES, 1500 мМ NaCl, pH 7.4); 10Х HBS-EP+ буфер (100 мМ HEPES, 1500 мМ NaCl, 30 мМ ЭДТА, 0.5% детергента P20, pH 7.4); EDC (1-этил-3-(3-диметиламинопропил) карбодиимид гидрохлорид), NHS (N-гидроксисукцинимид), 1 М этаноламин-HCl (pH 8.5), 10 мМ глицин-HCl (рН 2.0). CHAPS был получен от «Sigma» (США). Раствор 100 мМ НСl был приготовлен из фиксанала («Реахим», Россия). Другие химические реактивы были аналитической чистоты и закупались от локальных компаний. Белковые препараты Препараты рекомбинантных белков, кодируемых генами 18-ой хромосомы человека с чистотой > 95%, по гель-электрофорезу в денатурирующих условиях были получены в ИБОХ НАН Беларуси [6–8]: NADPН-зависимая адренодоксин редуктаза (ADR); декапентаплегический гомолог 4 (SMAD4); микросомальный цитохром b5 (CYB5A); феррохелатаза (FECH); фактор транскрипции с доменом «цинковые пальцы» (CXXC1); мРНК-кэп-гуанин-N7-метилтрансфераза (RNMT). Белковые препараты транстиретина (TTR) и бычьего панкреатического трипсина (BPT) были получены от фирмы «Sigma». Белковый ингибитор VG (InhVG) (длиной 57 аминокислотных остатков) был получен от ТИБОХ ДВО РАН. Биоматериалы Культивирование клеток HepG2 проводили согласно описанному [9]. Лизат из клеток культуры HepG2 получали путем гомогенизации клеточной массы (примерно 200 млн. клеток) в ручном гомогенизаторе Sample griding kit («GE Healthcare»), содержащем специальный абразивный материал, с 1 мл лизирующего буфера CellLytic Mammalian Tissue Lysis/Extraction Reagent (Sigma, США) и 10 мкл коктейля ингибиторов протеаз («Sigma»). Содержание общего белка в образцах лизата клеток HepG2 определяли по методу Брэдфорд. Протокол пробоподготовки лизата клеток HepG2 К образцу, содержащему 90 мкл 2Х HBS-N буфера, добавляли 10 мкл лизата клеток HepG2 (3 мг/мл общего белка) и 100 мкл 100 мМ HСl для резкого сдвига рН с 7.4 до 2.0 (финальная концентрация HСl составляла 50 мМ). Смесь инкубировали на льду в течение 1 мин. Затем сразу добавили 30 мкл титрованного раствора NaOH для нейтрализации кислоты и сдвига рН с 2.0 до 7.4, а затем еще 170 мкл 2Х буфера HBS-EP+, содержащего коктейль ингибиторов протеаз, до финального объема 400 мкл. В качестве контроля использовали образец лизата клеток HepG2 без добавления HСl, то есть 10 мкл лизата (3 мг/мл) и 190 мкл 1Х HBS-N буфера инкубировали на льду в течение 1 мин, а затем доводили 200 мкл 2Х HBS-EP+ буфера до финального объема 400 мкл. Далее контрольный и опытные образцы инжектировали по чипу с иммобилизованным белком CYB5A в течение 10 мин при скорости потока 5 мкл/мин. Поверхностный плазмонный резонанс (SPR) Ковалентная иммобилизация белков на оптическом чипе СМ5. Все SPR измерения выполняли при 25°C в 4-х канальном оптическом биосенсоре Biacore 3000 («GE Healthcare»). Белки, кодируемые генами 18-ой хромосомы человека иммобилизовали за аминогруппы по стандартному протоколу. Сначала поверхность оптического чипа в рабочем канале биосенсора, покрытую карбоксиметилдекстраном, активировали путем инжекции смеси NHS/EDC в течение 7 мин при скорости потока 5 мкл/мин. Далее раствор белка (25 мкг/мл) инжектировали в течение 10 мин при скорости потока 10 мкл/мин. Первый канал (без иммобилизации белков) использовали в качестве контрольного канала для коррекции эффектов неспецифического связывания белкового материала к поверхности чипа. Таким образом, используя один четерехканальный чип CM5, можно иммобилизовать 3 разных белка. Регистрация белок-белковых взаимодействий на оптическом биосенсоре. В качестве рабочего буфера использовали 1Х HBS-EP+ буфер. Белки-аналиты, разведенные 1Х HBS-EP+ буфером до концентраций в диапазоне (1 – 10 мкМ), инжектировали в течение 5 или 10 мин при скорости потока 10 мкл/мин при 25°C. Регенерацию поверхности оптического чипа после каждой инжекции выполняли разными растворами с целью достижения максимальной степени очистки для выхода базовой линии сигнала биосенсора на уровень начала цикла. В качестве регенерационных растворов использовали 2M MgCl2, 1% CHAPS, 10 мМ глицин-HCl (рН 2.0). Разведенные в 10 раз рабочим буфером образцы лизата клеток HepG2 инжектировали по чипу с иммобилизованными белками СYB5A, RNMT, CXXC1, TTR в течение 5 мин при скорости потока 5 мкл/мин. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ SPR эксперименты для оценки эффективности химических реактивов вызывающих диссоциацию белковых комплексов Образцы лизата клеток HepG2 инжектировали по каналам биосенсора с ковалентно иммобилизованными белками СYB5A, RNMT, CXXC1, TTR (рис. 1). Прочно связанный материал лизата с белками на чипе отмывали разными химическими реактивами: 2M MgCl2, 1% CHAPS, 10 мМ глицин HCl (pH 2.0). На рисунке 1 это схематично показано в виде ступенчатого падения сигнала биосенсора.
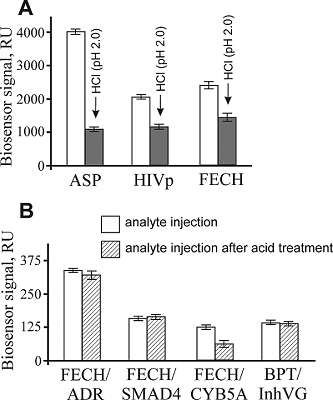
В целом, можно отметить слабую регенерационную эффективность при однократных инжекциях растворов 2M MgCl2 и 1% CHAPS, так эти реактивы по совокупности отмывали не более 50% связавшегося белкового материала. Напротив, использование 10 мМ глицин-HCl (рН 2.0) приводила к фактически полному удалению связавшегося белкового материала. В дополнительных SPR экспериментах нами было показано, что для некоторых гомоолигомерных белков [10-12], иммобилизованных на оптическом чипе при слабо кислых или нейтральных значениях рН, обработка 10 мМ глицин-HCl (рН 2.0) вызывала кратное падение сигнала биосенсора, что было обусловлено диссоциацией до мономеров (рис. 2А). Таким образом, фактор низких значений рН вносил решающий вклад в эффективную диссоциацию белковых комплексов.
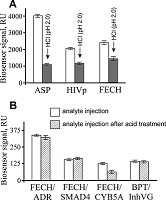
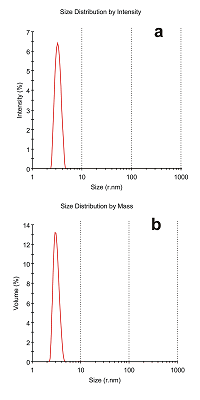
SPR оценка кислотного «шока» на стабильность и связывающую Модельные эксперименты проводили на следующих белковых парах: FECH/ADR, FECH/SMAD4, FECH/CYB5A. В работе [13] было показано, что данные белки способны образовывать гетеродимерные комплексы с Kd порядка 1 – 15 мкМ. Белок FECH был иммобилизован за аминогруппы на поверхности оптического чипа СМ5 по стандартному протоколу. Образцы белков-аналитов ADR, SMAD4 и CYB5A, предварительно обработанные 50 мМ HCl с последующей нейтрализацией, в конечной концентрации 5 мкМ (объемом 400 мкл) инжектировали в канал биосенсора с иммобилизованной FECH. В качестве контроля инжектировали образцы вышеуказанных белков без предварительной обработки 50 мМ HCl. Уровни связывания белков ADR, SMAD4 и CYB5A с феррохелатазой показаны на рисунке 2В. Можно отметить, что не все белки после кислотной обработки сохраняли исходную связывающую способность. Так, для цитохрома b5 (CYB5A) отмечалось падение связывания с FECH по сравнению с контролем (рис. 2В), что могло быть следствием частичной денатурации или потери гема. Мы выполняли также вспомогательные анализы образцов двух белков-аналитов (ADR и SMAD4) как до, так и после кислотной обработки и нейтрализации. Они были охарактеризованы по размеру частиц с использованием дзета сайзера МикроV (ZetaSizer microV, Malvern) с целью избежать артефактов в SPR измерениях белкового комплексообразования, которые могут сопровождаться агрегацией белковых молекул. Исходные растворы тестовых белков, разведенные 1X HBS-EP+ до конечной концентрации общего белка около 0.5 мкг/мл, помещали в кварцевую кювету, рекомендуемую фирмой-производителем измерительного оборудования, объемом 45 мкл и анализировали в среднем по 15 циклов, каждый из которых проходил в течение 10 с. Пример анализа белкового препарата ADR показан на рисунке 3. Установлено, что белковые препараты ADR и SMAD4 были представлены в растворе в виде мономеров, и после кислотной обработки этих белковых препаратов не наблюдалось появления пиков интенсивности высокомолекулярных агрегатов.
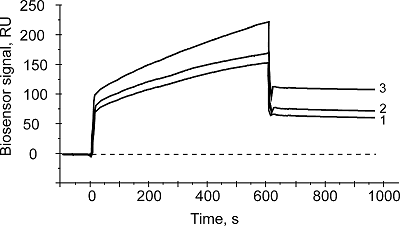
SPR оценка эффективности диссоциации белковых комплексов «дикого типа» в лизате при кислотной обработке и нейтрализации В работе [14] кислотный «шок» применяли для диссоциации комплексов белок-пептид «дикого типа». Образцы с белковым материалом титровали 0.1 M лимонной кислотой с pH 2.5 и затем инкубировали 2 мин на льду с последующей нейтрализацией кислоты, а высвобождаемые пептиды захватывали на хроматографической колонке. В нашей работе необходимо было диссоциировать стабильные белок-белковые комплексы лизата путем кислотной обработки так, чтобы, с одной стороны, это сопровождалось максимальной эффективностью диссоциации, а с другой стороны, оказывало минимальный денатурирующий эффект на чувствительные белки. Поэтому нами были использованы многократно разбавленные рабочим буфером исходные препараты лизата, короткое время экспозиции белков/белковых комплексов лизата с химическим фактором (фактор низкого рН) и резкие сдвиги рН. Так, сравнительный SPR анализ образцов лизата после обработки 50 мМ HCl показал, что сигналы связывания белкового материала с иммобилизованным на чипе цитохромом b5 (CYB5A) значительно отличались от контроля (рис. 4, сенсограмма 1) и имел место двукратный прирост сигнала (рис. 4, сенсограмма 3), что обусловлено взаимодействием тех белков-партнеров лизата, которые находились в составе белковых комплексов высшего порядка, а значит, были недоступны для взаимодействия. Далее мы показали, что присутствие избытка экзогенного CYB5A (из расчета 2 мкг CYB5A на 1 мкг общего белка лизата) в образце лизата, подвергнутого кислотной обработке, на 80% гасило прирост сигнала биосенсора (рис. 4, сенсограмма 2), что можно объяснить «обратным титрованием» высвобожденных из комплексов «дикого типа» белков-партнеров экзогенным цитохромом b5. При этом надо отметить, что в контрольных SPR экспериментах не было обнаружена олигомеризация СYB5A с самим собой, а значит, полученные результаты не являются артефактом олигомеризации.
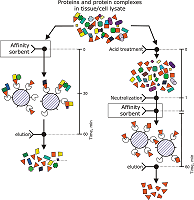
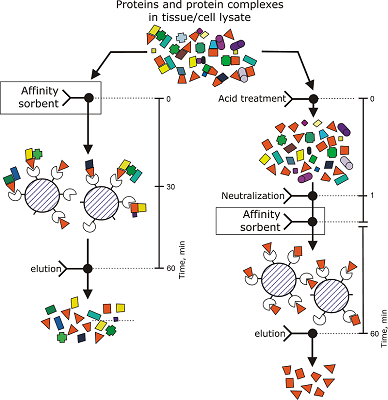
Таким образом, предлагаемая модификация пробоподготовки клеточных/тканевых лизатов с применением кислотной обработки и последующей нейтрализации должны повысить эффективность и специфичность аффинного выделения прямых партнеров (для целевых белков-наживок), высвобождаемых из комплексов «дикого типа», а также снизить контаминацию элюатов с аффинного сорбента фоновыми белками при выполнении процедуры молекулярного фишинга (рис. 5).
ФИНАНСИРОВАНИЕ Работа выполнена при финансовой поддержке Российского Фонда Фундаментальных Исследований (грант РФФИ № 18-04-00071). SPR измерения выполнены на оборудовании ЦКП «Протеом человека» при ИБМХ, поддержанном Минобрнауки РФ в рамках соглашения №14.621.21.0017 (идентификатор RFMEFI62117X0017). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ЛИТЕРАТУРА
|