|
Функционализация кальцийфосфатных материалов биологически активными соединениями белковой природы
1Московский научно-исследовательский онкологический институт им. П.А. Герцена - филиал «Национального медицинского исследовательского центра радиологии», Ключевые слова: функционализация; биомиметическое осаждение; биологически активные соединения; октакальциевый фосфат; β-трикальциевый фосфат DOI: 10.18097/BMCRM00096 ВВЕДЕНИЕ
При восстановлении дефектов костной ткани для активации процессов регенерации в остеопластической хирургии используется широкий круг материалов естественного и искусственного происхождения. Особую роль среди них играют кальцийфосфатные (КФ) материалы, которые обладают химическим составом, близким к составу минерального компонента нативной кости, что определяет их остеокондуктивные свойства. Кроме того, большинство из них биорезорбируемы и замещаются новообразованной костной тканью в течение постоперационной реабилитации. Однако использование этих материалов не предотвращает появление осложнений, связанных с недостаточной консолидацией имплантируемого материала с окружающими тканями и, в ряде случаев, с инфицированием костной раны. Кроме того, в онкологии после удаления злокачественных образований в костной ткани зачастую приходится прибегать к повторным операциям, связанным с продолженным опухолевым процессом. Для устранения негативных последствий хирургического вмешательств используется системное введение лекарственных препаратов в высоких дозах (вследствие низкой биодоступности для них костной ткани), которое часто обладает токсичным действием и недостаточной эффективностью. Альтернативный способ – это использование имплантируемых материалов в качестве платформы для адресной доставки лекарственных препаратов непосредственно в область костного дефекта. В последнее время активно разрабатываются подходы к функционализации КФ материалов лекарственными препаратами и биологически активными соединениями. Ведется поиск способов, позволяющих получить материал с заданными биоактивными свойствами и с контролируемой скоростью высвобождения депонируемого соединения [1-4]. Разрабатываемые подходы можно разделить на два основных направления. Первое – это внедрение препарата в состав материала в процессе его изготовления. Например, введение лекарственного соединения в раствор при синтезе фосфатов кальция [5, 6], растворение лиофилизированного антибиотика при затворении КФ цементов [7, 8]. Второе – функционализация материала с помощью адсорбции препарата на его поверхности [9, 10] или ковалентного связывания лекарственного соединения с поверхностными структурами [11, 12]. Однако существующие технологии характеризуются низкой эффективностью инкорпорации и неудовлетворительной скоростью высвобождения препаратов из материалов, не обеспечивающей постоянный и длительный терапевтический эффект в области дефекта [13, 14]. Целью данной работы была разработка эффективного способа инкорпорации биологически активных соединений на поверхность КФ материалов. В качестве модельного соединения был выбран бычий сывороточный альбумин ( BSA), который представляет собой глобулярный белок плазмы крови с молекулярной массой 69 кДа. В качестве платформы для функционализации были выбраны КФ материалы: октакальциевый фосфат (ОКФ) и β-трикальций фосфат (β-ТКФ). Известно, что ОКФ является возможным предшественником биологического апатита кости и обладает ярко выраженными остеокондуктивными свойствами [15, 16]; β-ТКФ – хорошо изученный, наиболее простой в получении и часто используемый в клинической практике биокерамический материал [17, 18]. С целью изучения влияния структуры поверхности β-ТКФ на процесс инкорпорации модельных соединений была произведена ее модификация. Для этого на поверхности β-ТКФ методом биомиметического осаждения был сформирован дополнительный слой фосфатов кальция [19]. Ранее было показано, что с помощью этого метода возможно сформировать на поверхности различных материалов (титановых, полимерных, керамических) КФ слой, что значительно изменяет архитектонику поверхности и усиливает их остеокондуктивные свойства [20-23]. Таким образом, задачей данного исследования стал подбор условий для успешной инкорпорации модельного соединения на поверхность КФ материалов, а также изучение динамики его высвобождения. МАТЕРИАЛЫ И МЕТОДЫ В работе были использованы биоматериалы на основе ОКФ (Ca/P = 1.33) и β-ТКФ (Ca/P = 1.5) в виде пористых гранул размером 500-1000 мкм. В качестве исходного материала для получения гранул двух составов был использован порошок трикальцийфосфата гексагональной модификации (β-ТКФ) со средним размером частиц 0.2 – 0.5 мкм. Синтез β-ТКФ проводили классическим методом осаждения из водных растворов нитрата кальция (Ca(NO3)2), гидрофосфата аммония ((NH4)2HPO4) и водного 25%-ного раствора аммония (NH4OH) при pH = 7.0 – 7.3 [24, 25]. Из полученного порошка готовили суспензию на основе водного раствора полиакриламида концентрацией 1 г/мл с соотношением порошок:раствор = 1:1. Формование керамики проводили суспензионным методом реплики полимерной высокопористой ячеистой губки необходимой архитектуры (полиуретан (ПУ), плотность 19 кг/м3); заготовки сушили и обжигали при температуре 1200°С – для получения фазы β-ТКФ, при 1350°С – для α-ТКФ [26]. Полученную после обжига керамику дробили и рассеивали по фракциям. Для получения фазы ОКФ производили двухэтапную химическую обработку α-ТКФ путем выдерживания гранул в буферных растворах для трансформации в промежуточную фазу дикальцийфосфата дигидрата (ДКФД), и затем окончательно в фазу ОКФ, согласно [27]. В результате химических реакций формируется ОКФ, при этом размер и основная структура полученных керамических гранул подобны исходным. В качестве модельного соединения использовали BSA («PAA», Австрия). Поверхность КФ материалов исследовали методом сканирующей электронной микроскопии (СЭМ, Tescan Vega II SBU) совместно со спектральным анализом (ЭДА, INCA Energy). Фазовый состав материалов изучали путем рентгенофазового анализа (РФА, Rigaku/Shimadzu), наличие функциональных групп в структуре – с помощью ИК-Фурье спектрального анализа (ИК, Avatar-330, Thermo Nicolet) методом прессования таблеток точно взвешенной навески пробы с KBr. Площадь удельной поверхности (Sуд.) гранул измеряли методом низкотемпературной адсорбции азота Брунауэра-Эммета-Теллера (БЭТ, TriStar 3000, Micromeritics). Для гранул β-ТКФ производили модификацию поверхности, используя метод биомиметического осаждения фосфатов кальция из двукратно концентрированного раствора, моделирующего внутреннюю среду организма (2хSBF, табл. 1) [19]. Для этого 50.1 ± 0.03nbsp;мг материала помещали в 1.0 мл 2хSBF и инкубировали в течение 24nbsp;ч при 37°С и постоянном перемешивании. Взвешивание производили на аналитических весах Mettler AT200 (d = 0.1 мг). Полученный материал обозначили как β-ТКФмод. Таким образом, инкорпорацию модельных соединений осуществляли для 3-х видов биокерамики: ОКФ, β-ТКФ и β-ТКФмод.. Инкорпорацию BSA на поверхность керамики производили путем выдерживания материала в различных буферных растворах: Дюльбекко модифицированном фосфатно-солевом буфере (DPBS), в перенасыщенном КФ растворе (SCS), в модифицированном растворе SBF (SBFмод.) и буфере на основе трис-(гидроксиметил)аминометана (TRIS) (табл.nbsp;1), содержащих инкорпорируемое соединение. Исходная концентрация BSA в инкорпорационных растворах составляла 3.0 мг/мл и 6.0 мг/мл. Гранулированный материал (50.3 ± 0.08 мг) помещали в пластиковые пробирки с инкорпорационными растворами (объем 1.0 мл) и инкубировали при 37°С и постоянном перемешивании в течение 48 ч.
Эффективность инкорпорации BSA оценивали с использованием BCA Protein Assay Kit («ThermoFisher Scientific», США) путем измерения концентрации белка в инкорпорационных растворах до и после инкубации с материалами. Спектрофотометрические измерения осуществляли на спектрофотометре Multiscan FC («ThermoFisher Scientific»). Динамику выхода BSA из материалов исследовали в течение 6 суток. Для этого функционализированный материал помещали в пробирки с 1.0 мл DPBS, в заданные сроки полностью отбирали весь буферный раствор для оценки содержания в нем белка, после чего заливали материал таким же объемом свежего раствора. Выход альбумина оценивали в сроки РЕЗУЛЬТАТЫ Характеристика биокерамических материалов Гранулы ОКФ и β-ТКФ, использованные в работе, имели неправильную форму, размер от 500 мкм до 1000 мкм и пористость порядка 40 – 60% (рис. 1). Поверхность гранул ОКФ была сложена крупными кристаллами пластинчатой формы, образующими скопления в виде «цветков» (рис. 1 a,b). Форма пластин приближалась к гексагональной с длиной диагонали до 20 мкм и поперечным сечением 100 – 200 нм. Керамические гранулы на основе β-ТКФ были представлены округлыми по форме и однородными по размеру кристаллами, величиной 1 – 2 мкм. Кристаллы формировали сетку с порами разных размеров: крупными протяженными порами порядка – 150 – 250 мкм в поперечном сечении, средними – 10 – 20 мкм, и мелкими межкристаллическими – до 0.1 – 0.5 мкм (рис. 1 c,d). Sуд. исследуемых материалов составляла 5.9 м2/г для ОКФ и 0.5 м2/г для β-ТКФ.
На рисунке 2 представлены микрофотографии поверхности исходных гранул β-ТКФ и β-ТКФмод. В результате модифицирования на поверхности кристаллов наблюдалось неравномерное покрытие новообразованным слоем материала в виде рыхлых аморфных частиц размером 50 - 100 нм (некоторые такие области выделены для примера на рис. 2 b).
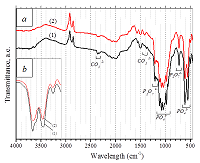
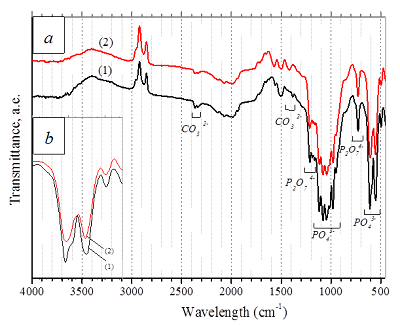
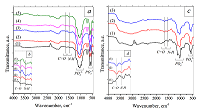
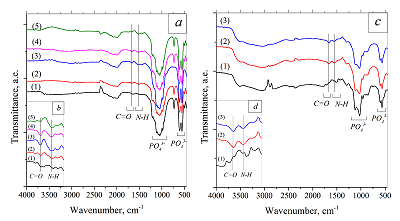
На ИК-спектрах исходного β-ТКФ и β-ТКФмод. присутствовали наборы полос поглощения, характерные для β-ТКФ (рис. 3 a). Однако у β-ТКФмод. наблюдалось уменьшение интенсивности линий групп (PO4)3-, что продемонстрировано на рисунке 3 b. При наложении спектров в интервале волновых чисел 550-600 см-1; также снижалась полуширина пиков. Это свидетельствует о снижении общего содержания основной фазы ТКФ [28], вероятно, вследствие осаждения аморфного фосфата кальция (АФК) из солевого раствора на поверхность гранул. Sуд. β-ТКФмод. составила 0.8 м2/г.
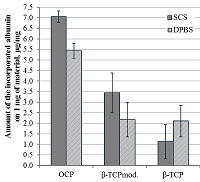
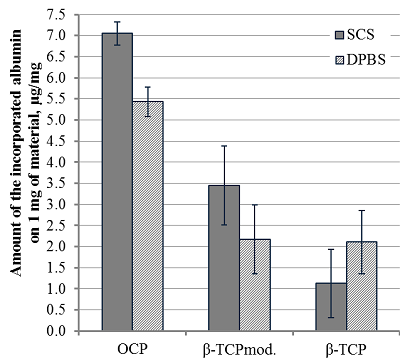
Инкорпорация BSA на поверхность биокерамики Исследование инкорпорации BSA на поверхность 3-х видов материалов (ОКФ, β-ТКФ и β-ТКФмод.) в растворах SCS и DPBS выявило различия в их адсорбционной способности. Наибольшее количество BSA встроилось на поверхность ОКФ (7.05 мкг/мг – в растворе SCS, 5.4 мкг/мг – в растворе DPBS), меньше - на поверхность β-ТКФмод. (3.5 мкг/мг – в растворе SCS, 2.2 мкг/мг – в растворе DPBS) и наименьшее – на β-ТКФ (1.1 мкг/мг – в растворе SCS, 2.1 мкг/мг – в растворе DPBS) (рис. 4).
Эти данные были подтверждены ИК-исследованиями (рис. 5). Так, на спектрах всех исследуемых образцов после инкорпорации BSA присутствовали полосы поглощения при 1660 см-1 и 1540 см-1, соответствующие валентным колебаниям C=O и N-H в пептидной связи, что отражало наличие BSA на поверхности материалов [29, 30]. Однако незначительные различия в интенсивностях указанных полос не позволяли оценить по ИК-спектрам количество встроенного в материалы альбумина.
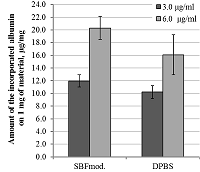
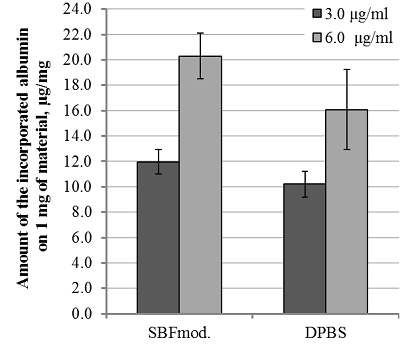
В целом, несмотря на увеличение удельной поверхности β-ТКФ, наиболее результативной оказалась инкорпорация BSA на поверхность ОКФ с использованием раствора SCS. Поэтому в дальнейших экспериментах по функционализации использовали только ОКФ. Далее мы исследовали зависимость эффективности инкорпорации BSA на поверхность ОКФ от его концентрации в исходных растворах. При исходной концентрации BSA, составляющей 3.0 мг/мл в растворах SBFмод. и DPBS, на поверхность ОКФ адсорбировалось приблизительно равное количество альбумина (11.9 ± 0.97 мкг и 10.2 ± 1.03 мкг на 1 мг материала соответственно). Увеличение концентрации BSA до 6.0 мг/мл в исходных растворах привело к возрастанию количества инкорпорированного белка менее чем вдвое: при использовании SBFмод. – на 69.7%, DPBS - на 57.4% (рис. 6). Таким образом, использование концентрации BSA 3.0 - 6.0 мг/мл в исходных растворах не привело к насыщению поверхности ОКФ. Кроме того, в данных условиях SBFмод. в качестве исходного раствора имел некоторое преимущество в сравнении с DPBS.
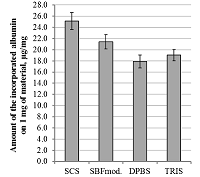
Представленные выше данные свидетельствуют о влиянии состава буферного раствора на процесс инкорпорации BSA. Для определения роли отдельных ионов в процессе инкорпорации белковых молекул была выполнена серия экспериментов по функционализации ОКФ с использованием буферных растворов разного состава. Были выбраны буферные системы с различным содержанием ионов кальция, фосфора и других ионов, ранее использовавшихся в работах по функционализации: SCS [31, 32], модифицированный SBF [33] и DPBS [34]. Для сравнения был взят TRIS-буфер, не содержащий неорганических солей (табл. 1). В соответствии с полученными данными по результативности инкорпорации BSA на поверхности ОКФ, эти растворы можно расположить в следующий ряд: SCS > SBFмод. > DPBS = TRIS (рис. 7).
На последнем этапе исследования была изучена динамика высвобождения BSA из ОКФ, функционализированного с помощью растворов SCS и DPBS. Показано, что в течение первых суток с поверхности ОКФ высвободилось 32.4% и 40.7% BSA (при использовании SCS и DPBS соответственно), за последующие 5 суток дополнительно вышло 12.7% и 13.0% BSA (для SCS и DPBS соответственно). В целом, в обоих случаях за 6 суток наблюдения высвободилось около половины встроенного альбумина (табл. 2).
ОБСУЖДЕНИЕ В настоящей работе представлены результаты исследования функционализации керамических биоматериалов путем инкорпорации на их поверхность модельного соединения BSA. Для функционализации было выбрано два остеопластических материала - ОКФ и β-ТКФ, различающихся фазовым составом и микроструктурой. Показано, что поверхность материала ОКФ существенно более развита, чем поверхность β-ТКФ, а именно, Sуд. ОКФ почти в 12 раз больше Sуд. β-ТКФ. Биомиметическое осаждения КФ слоя на поверхность β-ТКФ привело к увеличению Sуд. в 1.6 раз. Результаты физико-химических исследований свидетельствуют о формировании слоя АФК в процессе модификации. Слабая выраженность этого слоя, вероятно, связана с тем, что в процессе биомиметического осаждения одновременно происходит как растворение поверхностности β-ТКФ, так и осаждение фосфатов кальция из раствора на границе раздела фаз. При этом скорость гетерогенного зародышеобразования на поверхности минеральной фазы зависит от многих факторов, в том числе, от состояния поверхности, концентрации и других параметров солевого раствора [35, 36]. Образовавшийся АФК является одной из стадий кристаллизации гидроксиапатита (ГА), которая происходит через образование ОКФ и нестехиометрического ГА [37] Таким образом, при увеличении концентрации солевого раствора, а также времени выдержки материала в растворе можно добиться формирования ОКФ и ГА на его поверхности. Исследование эффективности инкорпорации BSA на поверхность ОКФ, β-ТКФ и β-ТКФмод. в растворе SCS показало, что модификация поверхности материала увеличивает количество встроенного на нее белка в 3 раза, тогда как Sуд. возрастает только в 1.6 раза. Учитывая тот факт, что раствор SCS является пересыщенным КФ раствором, а инкорпорация альбумина в этом растворе происходила совместно с биомиметическим осаждением, мы предположили, что решающую роль в этом процессе сыграли новообразованные в процессе модификации фосфаты кальция. При этом увеличение эффективности инкорпорации происходило не столько за счет увеличения площади поверхности материала, сколько за счет образования дополнительных центров кристаллизации для последующего КФ слоя и совместной копреципитации молекул BSA из раствора SCS. Действительно, согласно литературным данным, структура осажденной фазы является не упорядоченной [38]. Поэтому новообразованный КФ слой обладает множеством неоднородностей и дефектов поверхности, которые можно рассматривать как скопление активных центров для взаимодействия с растворенными ионами и молекулами, содержащими заряженные группы (в том числе белковыми). Результаты сравнительного исследования эффективности инкорпорации BSA в различных буферных растворах (табл. 1) подтвердили это предположение. Было показано, что в растворах с увеличенным содержание кальция (SCS и SBFмод.) встроилось достоверно большее количество альбумина, чем в растворе с его минимальным содержанием (DPBS) и в растворе, не содержащим этот ион (TRIS) (табл. 3). В то же время SBFмод., содержащий максимальное количество кальция, находился на втором месте по эффективности инкорпорации. Мы объясняем это наличием в растворе ионов Mg2+ и НСО3-, которые, как показал F. Berrere с соавторами [39, 40], являются ингибиторами кристаллизации, и отрицательно влияют на формирование КФ фазы в процессе биомиметического осаждения. Напротив, увеличение содержания фосфат-ионов в инкорпорационном растворе снижает эффективность инкорпорации BSA на поверхность ОКФ (табл. 3). Вероятно, это связано с конкуренцией между этими ионами и активными группами белковой молекулы за взаимодействие с ионами кальция на поверхности материала [5]. Таким образом, совместная преципитация BSA и фосфатов кальция на поверхность ОКФ в процессе биомиметического осаждения оказалась эффективнее его адсорбции без использования концентрированных солевых растворов. Причем наилучший результат получен при инкорпорации в растворе SCS, обладающем оптимальным соотношением содержащихся в нем ионов кальция и фосфат-ионов и отсутствием ингибирующих кристаллизацию агентов.
В целом, была продемонстрирована принципиальная возможность функционализации поверхности керамических материалов белковыми соединениями (на модели BSA) путем их инкорпорации в процессе биомиметического осаждения в новообразованный КФ слой. Инкорпорационная способность ОКФ оказалась значительно выше способности β-ТКФ и β-ТКФмод. Поэтому использование ОКФ для адресной доставки лекарственных соединений в зону костного дефекта представляется наиболее перспективным. Низкая скорость высвобождения инкорпорированного BSA обосновывает дальнейшее использование разработанного метода для создания функционализированных материалов с длительным терапевтическим воздействием. ФИНАНСИРОВАНИЕ Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-29-11052 ЛИТЕРАТУРА
|