|
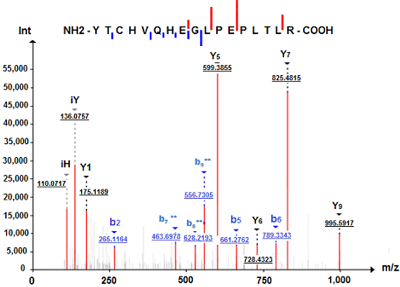
Сравнительный анализ протеомного профиля кератиноцитов HaCaT с использованием 1DE-гель концентрирования Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, Погодинская ул., 10, e-mail: * juliaks@bk.ru Ключевые слова: кератиноциты человека линии НаСаТ; додецилсульфат натрия;1DE-гель концентрирование; SearchGUI; X!Tandem; MS-GF+; белки кодируемые 18 хромосомой, LC-MS/MS DOI: 10.18097/BMCRM00180 ВВЕДЕНИЕ Кератиноциты являются основными клетками эпидермиса кожи человека. Они образуют защитный барьер против повреждений кожи. Клетки линии HaCaT кератиноцитов человека – это спонтанно иммортализованные in vitro кератиноциты из гистологически нормального эпителия человека. Они способны неограниченно делиться, что определяет целесообразность их использования в качестве клеточной модели кожи in vitro для исследования цитотоксичности [1]. Для оценки цитотоксического действия на кожу поверхностно-активных веществ (ПАВ) в качестве эталонного соединения для проведения испытаний токсичности на клеточных моделях кожных покровов используют додецилсульфат натрия (SDS) [2, 3]. Для клеток линии НаСаТ характерно дозозависимое снижение жизнеспособности при воздействии SDS, пропорциональное длительности воздействия [4]. При контакте с кожей SDS может вызывать раздражение, гиперплазию, изменение липидного состава и снижение пролиферативной активности клеток [5-7]. Ранее мы показали, что воздействие SDS приводит к увеличению содержания белков, связанных с окислительным стрессом [8]. Некоторые из этих белков могут быть информативны для прогнозирования побочных эффектов, например, развития кожного канцерогенеза. Кроме того, SDS используют как для лизиса клеток (высвобождение растворимых белков), так и для солюбилизации мембранных белков. Однако SDS несовместим с протеазной активностью и масс-спектрометрией (МС), поэтому его использование для протеомного анализа ограничено [9]. Удаление детергента является обязательным в рабочем процессе подготовки образцов. Первым этапом процедуры трипсинолиза белков в геле является удаление SDS, например, смесью бикарбоната аммония/ацетонитрила [10, 11]. Об эффективности процедуры снижения концентрации детергента в пробе судят по увеличению количества идентификаций белков/пептидов [12] или по отсутствию характерных пиков SDS в масс-спектрах [13]. Недавно был предложен протеомный протокол пробоподготовки SDS-содержащих образцов ткани человека с помощью укороченного классического SDS-PAGE – так называемое 1DE-гель концентрирование, при котором процедура SDS-PAGE заключалась только в этапе концентрирования белков образца в 4% геле без последующего разделения белков по массам [14]. В результате единственная образующаяся белковая полоса полностью подвергалась процедуре триптического гидролиза белков в геле по стандартной методике Shevchenko и соавт. [10]. Данный подход показал воспроизводимую и чувствительную идентификацию белков ворсин хориона. Его использование приводило к заметному увеличению как общего количества идентификаций, так и идентификаций тканеспецифичных белков. Целью данного исследования было показать на примере белков, кодируемых генами хромосомы 18, что применение процедуры пробоподготовки, основанной на SDS-экстракции, 1DE-гель концентрировании с последующим расщеплением трипсином в геле, подходит для углубленной характеристики протеома клеточной культуры HaCaT. Белки, кодируемые генами хромосомы 18, представляют интерес, поскольку, согласно базе данных UniProtKB [15], они связаны с целым рядом заболеваний, в том числе со злокачественными новообразованиями. Список белков, кодируемых генами хромосомы 18, полученный с помощью метода 1DE-гель концентрирования, сравнивали с ранее полученными нами результатами идентификации белков после суспендирования клеток HaCaT в воде с тройным замораживанием-оттаиванием и расщеплением трипсином в растворе [16]. Дифференциально экспрессируемые в ответ на воздействие SDS белки были рассмотрены в контексте специфичности кожного канцерогенеза. МЕТОДИКА В работе использованы следующие реактивы: додецилсульфат натрия (SDS), бычий сывороточный альбумин (БСА; “Merck”, Германия); трипсин из поджелудочной железы свиньи, модифицированный лиофилизированный (“Promega”, США); трифторуксусная кислота (ТФУ; “Fluka”, Германия); ацетонитрил, дитиотреитол (ДТТ), деионизованная вода (“Acros”, США); метанол, 2,2-бицинхониновая кислота (“Pierce”, США), раствор трипсина-ЭДТА 0.25% («ПанЭко», Россия) а также реактивы отечественного производства квалификации х.ч. Культивирование и обработка клеток Объектом исследования были кератиноциты иммортализованной линии НаСаТ до (контроль, 3 биологических повтора/культуральных флакона) и после воздействия SDS (в концентрации 25 мкг/мл, группа сравнения, 3 биологических повтора/культуральных флакона) в течение 48 ч. Культивирование клеток и обработку проводили в соответствии с методикой OECD [2]. Клетки с поверхности культуральных флаконов снимали 0.25% раствором трипсин-ЭДТА (3 мл; инкубация 3-5 мин при 37°С), отмывали фосфатным буфером (2-3 раза) и объединяли клетки трех культуральных флаконов для каждой группы в одну пробирку. В результате получали 2 образца/пробирки с контрольными (Control-HaCaT) и обработанными SDS (SDS-HaCaT) клетками. К осадку кератиноцитов добавляли лизирующий буфер: 500 мкл 0.2% SDS в 100 мМ трис-HCl (pH 7.4), 120 мМ NaCl, 5 мМ ЭДТА и 1% PMSF. Лизаты клеток инкубировали на орбитальном шейкере ELMI (“ELMI”, Латвия) при комнатной температуре 20 мин с последующей инкубацией в течение 5 мин при 95°C и гомогенизировали вручную в стеклянном гомогенизаторе. Обработка ультразвуком (Sonopuls HD2070, “BANDELIN”, Германия) включала два цикла по 50 с с интервалом 25 с на ледяной бане для уменьшения перегрева. Образцы инкубировали в течение 30 мин при 4° C на орбитальном шейкере ELMI с вращением платформы 1000 g. После нагревания при 95°С в течение 4 мин и центрифугирования (Hettich Mikro 12–24 Zentrifuge, “Tuttlingen”, Германия) при 14000 g в течение 20 мин при 4°C отбирали супернатант. Содержание белка в гомогенатах определяли при помощи 2,2-бицинхониновой кислоты при длине волны 562 нм с использованием БСА в качестве стандарта [17]. Процедура 1DE-гель концентрирования с последующим расщеплением трипсином в геле Образцы смешивали с двумя объемами буфера для загрузки образцов (0.5 M трис-HCl, pH 6.8, 2% SDS, 25% глицерин, 5% 2-меркаптоэтанол, 0.05% бромфеноловый синий) и инкубировали при 95°C в течение 4 мин. Каждый образец лизата клеток наносили на три параллельные дорожки геля в количестве 50 мкг белка на дорожку. Электродный буфер содержал: 0.3% трис основной, 1.44% глицин и 0.1% SDS. Процедуру 1DE-гель концентрирования без фракционирования в разделяющем 12% геле проводили в концентрирующем 4% полиакриламидном геле (2.5 см) при 50 В на приборе Mini-Protean III Cell (7х11 см) (“Bio-Rad”, США). Электрофорез прекращали до миграции бромфенолового синего в разделяющий 12% гель (до границы фаз, 20 мин). Гель окрашивали 0.1% кумасси Brilliant Blue R-250, затем вырезали единственную белковую полосу (кусочек геля шириной около 2 мм) ручным микротомом или скальпелем, переносили в эппендорф и проводили триптический гидролиз в геле, как описано Shevchenko и соавт. [10]. Вкратце, каждую полосу геля инкубировали в 100 мкл обесцвечивающего буфера (50% ацетонитрил (объём/объём) в 100 мМ бикарбонате аммония, рН 8.9) в течение 45–60 мин при 50°С на термостатируемом шейкере. После инкубации отбирали надгелевый раствор и повторяли обесцвечивание геля дважды. Затем каждую пробу восстанавливали 45 мМ ДТТ при 56°С в течение 60 мин, алкилировали 100 мМ йодацетамидом в течение 15 мин при комнатной температуре в темноте. После дегидратации (100% ацетонитрил, 20 мин) каждую пробу подвергали протеолизу в геле трипсином. Для этого 6.3±2.0 мкл раствора трипсина (25 нг/мкл модифицированного трипсина в 50 мМ бикарбонате аммония) добавляли и смесь инкубировали при 37°С в течение ночи. Реакцию останавливали добавлением 15 мкл 0.7% ТФУ и образцы инкубировали в течение 2 ч при комнатной температуре. Надгелевый раствор смеси протеолитических пептидов из полосы геля использовали для проведения жидкостной хроматографии с тандемной масс-спектрометрией (LC-MS/MS). LC-MS/MS протеомное профилирование Смесь пептидов анализировали с использованием хроматографической системы Ultimate 3000 nano-flow HPLC (“Dionex”, США), интегрированной с масс-спектрометром Orbitrap Q Exactive HF (“Thermo Scientific”, США) с источником электростатической ионизации Nanospray Flex ion source (“Thermo Scientific”). Разделение пептидов проводили на аналитической колонке Zorbax 300SB-C18 (“Agilent Technologies”, США), носитель C18 (размер частиц 3.5 мкм, внутренний диаметр 75 мкм, длина 150 мм, размер пор 300 Å) в линейном градиенте подвижных фаз от 95% растворителя A (вода, 0.1% муравьиная кислота) и 5% растворителя В (вода, 0.1% муравьиная кислота и 80% ацетонитрил) до 60% растворителя B в течение 95 мин при скорости потока 0.3 мкл/мин. Спектры регистрировали в режиме детекции положительно заряженных ионов с разрешением R=70 К (нормировано для m/z 400) для фронтального сканирования и R=15 К (нормировано для m/z 400) для тандемного сканирования. Для регистрации тандемных спектров использовали высокоэнергетическую диссоциацию, индуцированную столкновением (HCD); энергию активации соударений устанавливали 35 эВ; разрешение – 70000 (m/z 400) для МС и 15000 (m/z 400) для МС/МС сканирования. Масс-спектры контрольных и обработанных SDS кератиноцитов в формате “.raw” конвертировали в соответствующие mgf-файлы с помощью программы ProteoWizard MS Convert v. 3.0.6867 [18]. Для идентификации белков проводили анализ масс-спектров с использованием поисковых алгоритмов X!Tandem и MS-GF+, интегрированных в платформу SearchGUI (v.4.0.22) [19]. Входящий в состав платформы интерпретатор PeptideShaker (2.0.16) [20] использован для визуализации и интерпретации результатов идентификации. Параметры поиска: база данных “Swiss_Prot” (SP, версия 1.4.2019, “.fasta” формат) для вида Homo sapiens; расщепляющий фермент — трипсин; точность измерения теоретической и экспериментальной массы пептида — ±5 ppm; точность измерения теоретической и экспериментальной массы фрагментарных ионов — ±0.01 Да; значение зарядового состояния ионов пептида — “2+, 3+ and 4+”; количество возможных пропущенных участков расщепления трипсином — 1; фиксированная модификация — карбамидометилирование цистеина; вариабельная модификация — окисленный метионин. Поиск проводили по базе данных инвертированных и случайных последовательностей аминокислот (decoy), процент ложноположительных результатов (FDR) ≤1%. Протеомный анализ проводили в трёх технических повторах. Набор данных доступен в ProteomeXchange/PRIDE (PXD026544). Для сравнительной полуколичественной оценки относительной представленности белков и установления соотношений дифференциально присутствующих белков в контрольных и экспериментальных образцах без определения абсолютной концентрации белка использовали нормированный спектральный количественный фактор (NSAF) интегрированный в PeptideShaker. NSAF зависит от количества идентифицированных спектров пептидов для каждого белка, позволяет сравнивать содержание отдельных белков в нескольких независимых образцах и широко используется в полуколичественной протеомике [21]. Дифференциально присутствующие белки были картированы в соответствии с правилами GO по домену биологический процесс. Для идентификации и анализа биологических путей использовали базу данных Gene Ontology Database [22] и инструмент PANTHER [23] для работы с базой (вид – Homo sapiens, test type – binomial, онтология – GO-Slim Biological Process, p-value < 0.05). Достоверность различий представленности белков (значений NSAF) до и после воздействия SDS оценивали с помощью точного теста Фишера (таблицы 2х2), достоверность различий параметров идентификации – по t-критерию Стьюдента. Уровень значимости a=0.05. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Сравнительный анализ протеома HaCaT до и после воздействия SDS Эффективной стратегией изучения изменений протеома клеток является сравнительная протеомика – быстрый и информативный метод для относительной количественной оценки без метки белкового состава биологических образцов [24]. Важным этапом протеомного исследования является этап пробоподготовки биологических образцов, который включает несколько этапов, в том числе этап экстракции белков. Для наиболее полного извлечения белков из клеток кератиноцитов НаСаТ был применен протокол, состоящий из 2 этапов. Первый этап включал солюбилизацию белков с помощью 0.2% SDS, который обеспечивает эффективную солюбилизацию и диссоциацию большинства липид-белковых и белок-белковых взаимодействий. В результате солюбилизации контрольные образцы содержали 4.6 ± 0.3 мг/мл общего белка и SDS-HaCaT образцы - 6.8 ± 0.5 мг/мл белка. На втором этапе для удаления SDS проводили процедуру классического SDS-PAGE электрофореза в денатурирующих условиях, но в усеченном/укороченном виде, который назван 1DE-гель концентрирование [14]. Для этого каждый экстракт кератиноцитов HaCaT (Control-HaCaT и SDS-HaCaT) наносили на три параллельные дорожки геля в количестве 50 мкг белка на полосу. После 1DE-гель концентрирования в 4% полиакриламидном геле на каждой дорожке геля, в отличие от классического SDS-PAGE, получали по одной полосе белка, содержащей практически все белки исследуемого образца кератиноцитов НаСаТ. Эффективность этого способа пробоподготовки была ранее показана при анализе белков в SDS-экстрактах ворсин хориона человека [14]. Об отсутствии SDS после отмывки геля судили по отсутствию характерных пиков SDS в масс-спектрах. Помимо сокращения времени и трудоемкости всей процедуры пробоподготовки, солюбилизация белков с помощью SDS в комбинации с 1DE-гель концентрированием приводила к увеличению количества идентификаций по сравнению с использованием протокола пробоподготовки, основанного на экстракции белков с помощью мочевины/тиомочевины и трипсинолиза в растворе [14]. Поиск пептидов/белков в двух группах исследуемых клеток (Control-HaCaT и SDS-HaCaT) осуществляли на базе платформы SearchGUI (поисковые алгоритмы X!Tandem и MS-GF+), объединив технические повторы для каждого набора данных. В результате в клетках HaCaT было выявлено 2418 белков, что составило почти 22% всех белков кератиноцитов человека по данным The Human Protein Atlas [25]. Из них в Control-HaCaT было идентифицировано 14949 пептидов, соответствующих 2021 белкам, а в SDS-HaCaT –2065 белков и 15399 пептидов. Мы зарегистрировали в клетках HaCaT обогащение белков, кодируемых всеми хромосомами. Полные списки идентифицированных белков клеточной линии HaCaT представлены в дополнительных материалах (табл. S1, S2). Таким образом, количество белков, идентифицированных в кератиноцитах НаСаТ до и после обработки SDS с применением пробоподготовки на основе солюбилизации с помощью ионного детергента и 1DE-гель концентрирования, заметно превышает количество идентификаций, полученных при экстракции белков с помощью осмотического шока (990 и 1223 белка соответственно до и после воздействия SDS) [16]. Для определения относительного содержания белков, идентифицированных в клетках HaCaT, использовали нормированный спектральный количественный фактор NSAF, обладающий высокой воспроизводимостью [26]. Значения NSAF для идентифицированных белков Control-HaCaT находились в диапазоне от 1.00 до 1.86х10-4. После воздействия SDS диапазон значений NSAF составил 1 – 4.25х10-5. Белки с более чем 2-кратными изменениями (fold change ≥2) значений NSAF расценивались как дифференциально измененные в ответ на воздействие SDS. Относительная количественная оценка протеомов (контрольного и обработанного SDS) показала увеличение содержания 79 белков и снижение содержания 59 белков в SDS-HaCaT по сравнению с контрольными образцами. При этом для тех белков, которые были идентифицированы по крайней мере в 2/3 технических повторах (например, P54577, Q9BR76, P12004), кратность изменений ≥ 2 была достоверной (p£4.87e-5; a=0.05). Обычно представленность белков нормируют по значениям NSAF «белков домашнего хозяйства», которые стабильно экспрессируются в клетках при различных условиях [27]. Мы детектировали в кератиноцитах HaCaT 42 «белка домашнего хозяйства» по базе данных HRT Atlas v1.0 [28]; диапазон значений NSAF составил от 1.9х10-1 до 5.83х10-3 как в контрольных кератиноцитах, так и в SDS-HaCaT (дополнительные материалы, табл. S3). Для определения белков с низкой представленностью, значения NSAF белков «домашнего хозяйства» для каждого набора данных были расположены в порядке убывания и разбиты на квартили (категории “ high”, “medium” и “low”). В четвертый квартиль (категория “low”) вошли белки со значениями NSAF от 0.029 до 0.006. Оказалось, что диапазон значений NSAF категории “low” специфичных для кератиноцитов белков, обнаруженных в контрольных клетках HaCaT, был сопоставим со значениями NSAF «белков домашнего хозяйства» кератиноцитов. Белки, кодируемые генами хромосомы 18 человека, относящиеся к категории “low”, имели диапазон значений NSAF от 0.01 до 0.002, что укладывается в down диапазон значений NSAF «белков домашнего хозяйства» кератиноцитов. Таким образом, белки со значениями NSAF ниже 0.029 можно отнести к категории низкопредставленных для данной выборки. Например, в клетках HaCaT мы идентифицировали митохондриальный «белок домашнего хозяйства» MRPL21_ HUMAN (митохондриальный рибосомный белок L21) в диапазоне NSAF от 0.0225 (Control-HaCaT) до 0.056 (SDS-HaCaT). Согласно neXtProt [29] этот белок был определен в кератиноцитах иммуногистохимически с низким уровнем представленности. Компонент протеасомы PSDE_HUMAN, идентифицированный нами в диапазоне NSAF от 0.0284 (Control-HaCaT) до 0.0142 (SDS-HaCaT), согласно neXtProt, был определен иммуногистохимически с низким уровнем представленности в кератиноцитах. Одной из основных целей проекта C-HPP (Chromosome Centric Human Proteome Project или “Протеом человека”) является обнаружение «недостающих белков» («missing», PE2-PE4) и белков, имеющих спорные доказательства или их отсутствие («uncertain», РЕ5). Нам удалось зарегистрировать ранее не обнаруженный масс-спектрометрией в кератиноцитах, согласно The Human Protein Atlas, белок Putative HLA class I histocompatibility antigen, alpha chain H (P01893, HLAH_HUMAN), расположенный на коротком плече хромосомы 6 человека (6p22.1). Как в контрольных, так и в опытных образцах клеток НаСаТ, HLAH_HUMAN был идентифицирован по 6-7 пептидам, из которых один пептид – 281YTCHVQHEGLPEPLTLR – уникальный (достоверность 100%, рис. 1). В The Human Protein Atlas HLAH_HUMAN не аннотирован и входит в состав записей PE5, согласно платформе neXtProt.
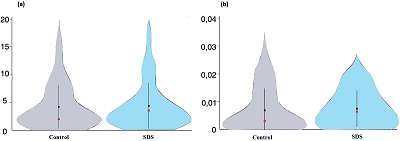
Белки, кодируемые генами хромосомы 18 Нами идентифицированы 38 белков, кодируемых генами хромосомы 18 человека. Количество уникальных пептидов на белок для контрольных и обработанных SDS образцов составляло 4.2 ± 3.9 (среднее значение ± стандартное отклонение, n=35) и 4.4 ± 4.1 (n=30) соответственно, т.е. практически не отличалось (T=1.9996, P=0.87, a=0.05). Распределение уникальных пептидов было так же сходно для белков, кодируемых генами хромосомы 18 человека, как контрольных, так и обработанных SDS образцов кератиноцитов HaCaT (рис. 2а). Из скрипичных графиков (violin plots) следует, что в обоих случаях больше всего белков идентифицируется по двум уникальным пептидам. На рисунке 1б представлены скрипичные графики распределения значений NSAF, средние значения которых составляют 0.070±0.076 (n=35) и 0.078±0.064 (n=30) в клетках до и после обработки SDS; что также статистически не значимо (T=1.9983, P=0.74, a=0.05). При этом, в отличие от графиков распределения уникальных пептидов, форма распределения значений NSAF (рис. 2b) белков в контрольных клетках HaCaT отличается от формы распределения значений NSAF белков в кератиноцитах, обработанных SDS. Тем не менее, и в том, и другом случае больше всего белков имели значения NSAF в диапазоне от 0.005 до 0.015. Таким образом, воздействие SDS на кератиноциты клеточной линии НаСаТ практически не влияло на данные параметры идентификации белков, кодируемых генами хромосомы 18 человека.
В таблице 1 приведен список белков, кодируемых генами хромосомы 18 человека, идентифицированных с помощью платформы SearchGUI в контрольных и обработанных SDS образцах клеток HaCaT. Среди них 27 белков были общими для Control-HaCaT и SDS-HaCaT. Белки SPB3, SPB13, THOC1 идентифицированы только в кератиноцитах SDS-HaCaT. Только в Control-HaCaT были определены восемь белков, кодируемых генами хромосомы 18: SPB12, IR3IP, DSC1, DSC3, F210A, RAB31, DSG1, SC11C. Также мы идентифицировали в контрольных кератиноцитах 8 белков, участвующих во внутриклеточном транспорте, регуляции апоптоза и структуре десмосом, которые не были обнаружены нами при использовании метода замораживания-оттаивания [16]. Связанный с Ras белок Rab-31 (RAB31_HUMAN), определяемый только в контрольных клетках, был идентифицирован по одному уникальному пептиду. RAB31 играет онкогенную роль в нескольких распространенных типах рака человека. Известно, что подавление экспрессии RAB31 значительно ингибирует пролиферацию клеток остеосаркомы, прогрессию клеточного цикла, миграцию и инвазию, а также значительно увеличивает скорость клеточного апоптоза [30]. Мы не обнаружили этот белок в клетках SDS-HaCaT, что может свидетельствовать об увеличении скорости апоптоза клеток. В настоящем исследовании мы зарегистрировали митохондриальный белок F210A_HUMAN только в контрольных кератиноцитах HaCaT. Снижение экспрессии F210A в образцах HaCaT, обработанных SDS, может свидетельствовать о подавлении факторов, участвующих в процессах дифференцировки и деградации клеток [31]. Зарегистрированный в SDS-HaCaT 10-кратный по сравнению с контролем дефицит феррохелатазы (HEMH_HUMAN) может свидетельствовать о том, что воздействие SDS на клетки привело к дефектам в поглощении железа митохондриями. В контрольных кератиноцитах мы идентифицировали белок эндоплазматического ретикулума (ЭР) IR3IP_HUMAN, потенциальная клеточная функция которого связана с процессами дифференцировки и гибели клеток. Кроме того, считается, что IR3IP участвует в стрессовой реакции ЭР [32]. Отсутствие этого белка в клетках, обработанных SDS, может указывать на возможное участие гена IER3IP1 в раннем ответе клеток кератиноцитов на детергент. Сигнальная пептидаза типа I (SC11C_HUMAN) обнаружена нами в клетках контрольных кератиноцитов по 1 уникальному пептиду и не обнаружена в клетках SDS-HaCaT. Дисфункция этой системы приводит к стрессу ЭР. В эпителиальных клетках стресс ЭР может вызывать апоптоз, воспалительную передачу сигналов и эпителиально-мезенхимальный переход.
Aнализ обогащения GO Мы провели анализ обогащения GO дифференциально экспрессируемых белков (DEPs) в кератиноцитах НаСаТ с использованием ресурса Gene Ontology Resource и The PANTHER. Анализ обогащения GO (рис. 3) показал, что белки с повышенной регуляцией (2-4-кратное увеличение содержания в SDS-HaCaT по сравнению с контрольными кератиноцитами) связаны GO терминами: “фосфорилирование пептидил-тирозина” (GO: 0018108 – peptidyl-tyrosine phosphorylation), “модификация пептидил-тирозина” (GO: 0018212 – peptidyl-tyrosine modification), “метилирование оснований рРНК” (GO: 0070475 – rRNA base methylation), “цитоскелет-зависимый цитокинез” (GO: 0061640 – cytoskeleton-dependent cytokinesis), “сборка нуклеосом” (GO: 0006334 – nucleosome assembly), “клеточное деление” (GO: 0051301 – cell division), “цитокинез” (GO: 0000910 – cytokinesis), “трансмембранный транспорт ионов кальция” (GO: 0070588 – calcium ion transmembrane transport), “стабилизация белка” (GO:0050821 – protein stabilization).
Анализ GO выявил в клетках SDS-HaCaT увеличение профиля экспрессии септинов 8, 9, 10 и 11 (GO: 0000910 – cytokinesis), которые являются регуляторами стабильности кожных структур и связаны со многими типами рака. Септины представляют собой большое семейство GTP-связывающих белков, которые аномально экспрессируются во многих солидных опухолях. Известно, что септин 9 (SEPT9) сверхэкспрессируется в различных опухолях человека, включая рак молочной железы, головы и шеи, яичников, эндометрия, почки, поджелудочной железы и кожи (плоскоклеточный рак, меланома). [33-35]. Он, в частности, связан с молекулярными механизмами пролиферации, ангиогенеза, клеточной инвазии и устойчивости к противоопухолевым препаратам. Описана уникальная роль SEPT9 в инвазии и метастазировании меланомы [36]. С помощью базы данных Metascape [37] был проведен анализ обогащения терминами GO категории Biological Process одновременно двух списков белков хромосомы 18 кератиноцитов НаСаТ до и после воздействия SDS. Результаты для наиболее обогащенных кластеров GO Biological Process представлены в виде кластеризованной тепловой карты (рис. 4). Из рисунка следует, что в кератиноцитах НаСаТ после воздействия SDS наблюдалось незначительное обогащение GO термина “ответ на стимул” (GO:0050896 – response to stimulus). Ответной реакцией на стимул (т.е. любое воздействие разной природы) может быть любой процесс, который приводит к изменению состояния или активности клетки и/или организма (с точки зрения движения, секреции, продукции ферментов, экспрессии генов и т. д.). При этом могут наблюдаться два типа ответной реакции клетки – активация биологических процессов или запуск процессов, приводящих к остановке или снижению скорости реакций/путей, с помощью которых клетки реагируют на различные раздражители. Из тепловой карты видно, что в ответ на воздействие SDS происходит обогащение GO термина “негативная регуляция биологических процессов” (GO:0048519 - negative regulation of biological process) – синтеза, накопления и активации комплекса факторов, блокирующих и/или снижающих скорость или степень реакции на раздражитель. Термин GO:0048519 связан с термином GO:0050896.
В клетках SDS-HaCaT были детектированы белки, кодируемые генами хромосомы 18 THOC1_HUMAN и SPB3_HUMAN, которые ассоциированы с GO термином “ответ на стимул” (GO:0050896– response to stimulus). Белок THOC1 в клетках SDS-НаСаТ был идентифицирован по 1 уникальному пептиду, в контрольных кератиноцитах он находился в концентрациях ниже предела детекции (так называемые не валидированные белки). Кроме того, согласно базе данных neXtProt, THOC1 также не был обнаружен иммуногистохимическими методами в кератиноцитах человека, не подвергнутых какому-либо воздействию. Таким образом, можно предположить повышение экспрессии THOC1 в ответ на воздействие субтоксической дозы SDS на кератиноциты НаСаТ. THOC1 регулирует экспрессию широкого спектра генов, необходимых для важных биологических процессов, таких как эмбриогенез, органогенез и клеточная дифференцировка [38]. THOC1 сверхэкспрессируется при различных раковых заболеваниях [39] и может принимать участие в процессах неопластической трансформации. В нашем раннем исследовании протеома кератиноцитов НаСаТ с использованием пробоподготовки на основе осмотического шока и трипсинолиза в растворе белок THOC1 не был зарегистрирован [16]. В настоящей работе THOC1 определен с низким значением NSAF (0.0019), таким образом, наш метод позволил зарегистрировать низкопредставленные белки, кодируемые генами хромосомы 18 человека. Экспрессия THOC1 в клетках HaCaT, обработанных SDS, представляет интерес с точки зрения ответной реакции клеток на повреждение. Серпин В3 (SPB3_HUMAN) в клетках SDS-HaCaT был идентифицирован по 13 пептидам, из которых один пептид 215QYTSFHFASLEDVQAK (достоверность 100%), согласно базе данных neXtProt, является уникальным. SPB3_HUMAN обладает способностью защищать от апоптоза, опосредованного фактором некроза опухоли [40], и активации кальпаина [41]. Известно, что он играет роль в уменьшении воспаления, влияя на дисбаланс эпителиальной пролиферации/апоптоза в пользу фиброгенеза. SPB3_HUMAN также называют антигеном плоскоклеточной карциномы (SCCA1). Сравнение нормированного спектрального количественного фактора NSAF, отражающего содержание белков, показало, что содержание 45% всех идентифицированных белков, кодируемых генами хромосомы 18 человека, в кератиноцитах НаСаТ либо было снижено, либо эти белки не определялись при воздействии SDS (табл. 1). Анализ обогащения терминами GO категории «биологические процессы» (biological process) в группе белков, кодируемых генами хромосомы 18, с пониженной регуляцией с использованием базы данных Metascape выявил кожеспецифические мембранные белки, относящиеся к межклеточной адгезии (GO: 0098609 - cell-cell adhesion), такие как DSC1, DSC3, DSG1. Основная функция кератиноцитов — структурная, а десмосомы связывают кератиноциты вместе. DSG1 и DSC3 являются основными молекулами Са2+-зависимых трансмембранных гликопротеинов, которые прикрепляют соседние эпителиальные клетки друг к другу. Наши данные показали, что десмосомные белки DSG1, DSC1 и DSC3 были идентифицированы 1-2 уникальными пептидами в контрольных кератиноцитах и не определялись в обработанных SDS клетках HaCaT (табл. 1). Известна прямая и косвенная роль десмосомальных компонентов в развитии злокачественных новообразований. Снижение экспрессии десмосомальных кадгеринов наблюдали при различных эпителиальных злокачественных новообразованиях, в том числе кожи [42]. Можно предположить, что десмосомальные кадгерины могут быть потенциальными маркерами аномальной дифференцировки кератиноцитов в ответ на SDS. Мануальное аннотирование списков белков, кодируемых генами хромосомы 18, показало, что в клетках SDS-НаСаТ помимо SPB3_HUMAN был идентифицирован серпин B13, в то время как в контрольных кератиноцитах был обнаружен серпин B12. Члены семейства серпинов человека регулируют широкий набор сериновых и цистеиновых протеиназ, связанных с такими биологическими процессами, как фибринолиз, коагуляция, воспаление, подвижность клеток, дифференцировка клеток и апоптоз. Известно, что серпин В13 функционирует во внеклеточном матриксе, подавляя ангиогенез [43]. Согласно базе данных neXtProt, серпин В13 не обнаружен в кератиноцитах человека иммуногистохимическими методами. Мы также не обнаружили этот белок в контрольных кератиноцитах. Это может указывать на то, что серпин В13 может высвобождаться при определенных условиях (в нашем случае при обработке клеток SDS). Ингибиторы внутриклеточных сериновых протеаз (серпины) представляют собой важное семейство белков, которые защищают клетки от повреждений, опосредованных протеиназами. Серпин B12 является ингибитором трипсиноподобных сериновых протеиназ [44]. Известно, что этот серпин обнаружен во многих типах клеток в отдельных тканях, но прежде всего в эпителии. Мы выявили только в контрольных кератиноцитах низкое содержание серпина B12 по трем уникальным пептидам. Возможно, серпин B12 может играть важную роль в барьерной функции, обеспечивая защиту эпителиальных клеток. В отличие от нашего более раннего исследования, исследованием протеома HaCaT, использование в данной работе метода подготовки образцов, основанного на солюбилизации белков в присутствии 0.2% SDS, и процедуре 1DE-гель концентрирования с последующим LC-MS/MS анализом, позволило дополнительно идентифицировать 18 белков, кодируемых генами хромосомы 18: SEH1, TIM21, SPB4, RB27B, AFG32, THOC1, MAOM, MBD2, UBP14, SPB12, IR3IP, DSC3, F210A, RAB31, DSG1, PTGR3, SC11C, DSC1. В образцах клеток, подвергнутых осмотическому шоку (замораживанию-оттаиванию) и расщеплению трипсином в растворе, были идентифицированы такие белки, как ROCK1, RHG28, DSC2, MTCL1, а также TBB6, MARE2, CTIF [16]. В настоящей работе в контрольных клетках идентифицированы белки NDUV2, LMAN1 и KSDR , которые не были обнаружены в предыдущем исследовании. Возможно, объединение результатов, полученных разными методами подготовки образцов, позволит увеличить глубину охвата протеома кератиноцитов. Так, например, белок vacuolar protein sorting-associated protein 4B (VPS4B_HUMAN), не был идентифицирован в контрольных клетках в предыдущем исследовании, но был зарегистрирован в этом исследовании с 10-кратно меньшим содержанием в контрольных кератиноцитах по сравнению с SDS-HaCaT (табл.1). Повышение экспрессии белка VPS4B в SDS-НаСаТ кератиноцитах свидетельствует о неспецифической активации пролиферативной активности клеток линии HaCaT в ответ на повреждение. VPS4B играет ключевую роль во внутриклеточном транспорте белков от эндосомы к лизосоме, транспорте холестерина, участвует в пролиферации клеток, в регуляции сборки митотического веретена на разных стадиях клеточного деления. Согласно данным информационного ресурса “The Human Protein Atlas”, VPS4B экспрессируется в кератиноцитах, обнаруживается при раке кожи и является прогностическим маркером рака почек. ЗАКЛЮЧЕНИЕ Наши результаты показали, что сочетание солюбилизации белков клеточной культуры кератиноцитов в присутствии 0.2 % SDS и 1DE-гель концентрирования с расщеплением трипсином в геле для масс-спектрометрической идентификации белков обеспечивает углубленный анализ протеома HaCaT в одной белковой полосе, включая идентификацию и относительную количественную оценку белков с низким содержанием. Использование этого подхода позволило выявить 2-кратное увеличение количества белков, по сравнению с образцами, подвергнутыми осмотическому шоку и расщеплению трипсином в растворе (2418 против 1284). Объединение результатов, полученных разными методами пробоподготовки, позволит увеличить глубину охвата протеома кератиноцитов. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая работа не содержит описания исследований, проведенных с использованием людей и животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№122030100168-2). БЛАГОДАРНОСТИ Масс-спектрометрические измерения выполняли на оборудовании ЦКП «Протеом человека» Института биомедицинской химии (Россия). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов Дополнительные материалы доступны на сайте журнала (https://doi.org/10.18097/BMCRM00180). ЛИТЕРАТУРА
|