|
Влияние присоединения сRGD пептида к фосфолипидным наночастицам с включенным доксорубицином на апоптоз в клетках глиобластомы in vitro
Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: глиобластома; фосфолипидные наночастицы; cRGD; интегрин αvβ3; доксорубицин; апоптоз DOI: 10.18097/BMCRM00204 ВВЕДЕНИЕ Глиобластома (ГБМ) – одна из распространенных и смертельно опасных первичных опухолей головного мозга. В настоящее время основным лечением ГБМ является хирургическая резекция в сочетании с лучевой терапией и химиотерапией [1]. Гетерогенность опухоли, гематоэнцефалический барьер (ГЭБ), стволовые клетки глиомы и механизмы восстановления повреждений ДНК препятствуют эффективному лечению ГБМ [2]. Кроме того, клетки опухоли головного мозга также экспрессируют транспортный белок для оттока лекарств. Из-за этих барьеров в опухолях головного мозга свободным лекарствам, как правило, трудно обеспечить необходимое нацеливание и подходящую доставку для проникновения в паренхиму глиомы. Все это приводит к плохой терапевтической реакции на опухоль и серьезному побочному действию на здоровые ткани [3]. Другой проблемой терапии глиом является ограниченный набор высокоэффективных и малотоксичных химиотерапевтических препаратов, а также их резистентность к опухоли [4]. Доксорубицин (Dox) является антибиотиком антрациклинового ряда, широко применяемым химиотерапевтическим препаратом для лечения различных опухолей (острый лейкоз, ГБМ, рак молочной железы, болезнь Ходжкина, саркома и т.д) [5-9]. Его противоопухолевая активность связана с ингибированием топоизомеразы II, предотвращающей разворачивание и разделение цепи при репликации ДНК, а также ее репарацию. Данный процесс приводит к гибели клеток, называемой апоптозом. Другими механизмами, которые могут быть задействованы при проявлении терапевтического действия Dox, являются интеркалирование в ДНК и/или образование цитотоксических свободных радикалов кислорода с последующим ингибированием синтеза и функции ДНК [10]. Терапия рака с использованием Dox имеет значительные ограничения, связанные с его токсичностью по отношению к здоровым тканям. Это приводит к поражению сердца, мозга, печени и почек, и последствия этой токсичности могут проявляться через большой промежуток времени [11]. Появление диагностических и терапевтических подходов в онкологической медицине на основе нанотехнологий предоставляет новые и многообещающие инструменты, которые позволят повысить эффективность лекарств, в частности химиопрепаратов, за счет разработки систем их адресной доставки в ткани-мишени. Адресную доставку к ГБМ можно обеспечить, используя лиганды к белкам, сверхэкспрессируемым в самой опухоли или окружающих ее сосудах (например, интегринам альфа-v) [12]. Эти адресные агенты за счет высокого сродства к своим мишеням доставляют конъюгированные с ними лекарственные вещества конкретно к опухолевым клеткам и сосудистой сети опухолей [13]. В качестве адресных фрагментов используют различные группы: пептиды, антитела, аптамеры и малые молекулы [14, 15]. Снабжение транспортных систем (наночастиц, липосом, везикул) такими адресными лигандами представляет большой интерес [16]. За счет нацеливания циклического cRGD-пептида на интегрин αvβ3, уровень которого существенно повышен на поверхности клеток различных типов злокачественных опухолей, таких как меланома, ГБМ, рак мочевого пузыря и поджелудочной железы, данный пептид можно считать уникальным молекулярным лигандом для таргетной химиотерапии рака [17-19]. В экспериментах in vitro и in vivo обнаружено усиление противоопухолевого действия наночастиц, модифицированных cRGD-пептидом, по сравнению с нецелевым аналогом [20-24]. Ранее нами была разработана фосфолипидная композиция Dox с адресным сRGD пептидом (NPh-Dox-cRGD) и показана ее эффективность по интернализации и общему накоплению Dox на клеточной линии ГБМ человека U-87 MG [25]. Целью настоящего исследования была оценка цитотоксического действия и пути гибели опухолевых клеток после инкубирования с разработанной фосфолипидной Dox-содержащей композицией с сRGD-пептидом. МАТЕРИАЛЫ И МЕТОДЫ Получение композиций Получение фосфолипидной композиции Dox с адресным циклическим пептидом (cRGD) (NPh-Dox-cRGD) и без него (NPh-Dox) проводили согласно методике [25], используя соевый фосфатидилхолин Lipoid S100 (“Lipoid”, Германия), доксорубицина гидрохлорид (“Омутнинская научная опытно-промышленная база”, Россия), а также пептид cRGDfC (“Синтон-Лаб”, Россия), DSPE-Peg2000-Mal (“Avanti”, США). Массовое соотношение основных компонентов Lipoid S100:cRGD:Dox составляло 20:1:1. Клеточные линии Клеточные линии ГБМ U-87 MG и рака шейки матки HeLa были получены из Американской коллекции типовых культур (ATCC) и поддерживались в коллекции клеточных культур Института биомедицинской химии. Клетки U-87 MG культивировали в среде DMEM/F12 (“ПанЭко”) с добавлением 10% эмбриональной телячьей сыворотки крови (“Capricorn Scientific”, Германия). Клетки HeLa культивировали в среде DMEM (“ПанЭко”) с добавлением 10% эмбриональной телячьей сыворотки крови. Клетки U-87 MG и HeLa культивировали при 37°С в атмосфере с относительной влажностью 95 % и содержанием 5% СО2 (СО2-инкубатор “Sanyo”, Япония). В работе использовали клеточные линии от 3 до 10 пассажей. Цитотоксическое действие in vitro Оценку цитотоксического действия разработанной фосфолипидной композиции Dox с пептидом (NPh-Dox-cRGD) проводили на линиях клеток U-87 MG и HeLa. В качестве препаратов сравнения использовали свободную субстанцию Dox и Dox, встроенный в фосфолипидные наночестицы (НЧ) (NPh-Dox). Клетки U-87 MG и HeLa (15*103 клеток на лунку) рассеивали в стерильные 96-луночные культуральные планшеты (“Biologix”, Китай) и инкубировали при 37ºС в атмосфере 5% CO2 в течение 24-26 ч. После этого вносили исследуемые вещества с различными концентрациями Dox: 0.025 мкг/мл, 0.05 мкг/мл, 2.5 мкг/мл, 5 мкг/мл, 15 мкг/мл, 30 мкг/мл и инкубировали клетки в течение 24 ч и 48 ч. После инкубации осторожно добавляли по 100 мкл МТТ (1 мг/мл) в каждую лунку и инкубировали при 37°С в течение 4 ч. Затем осторожно удаляли среду, добавляли 100 мкл DMSO (“ПанЭко”) и инкубировали еще 15 мин на орбитальном шейкере ELMI S-3.02M.А20 (“ELMI Ltd.”, Латвия). Поглощение регистрировали при 550 нм (Multiscan FC, “ThermoSpectronic”, США) и нормировали на необработанный контроль (без Dox). Жизнеспособность клеток рассчитывали по следующему уравнению (1):
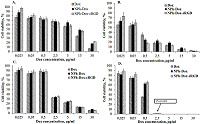
Расчет IC50 проводили онлайн с помощь сайта AAT Bioquest [26]. Анализ клеточного апоптоза Апоптоз клеток, опосредованный Dox, NPh-Dox и NPh-Dox-NGR, оценивали с помощью метода проточной цитометрии и специального набора для определения апоптотических клеток с помощью аннексина V-AF488 (“Lumiprobe”, Россия). Кратко, клетки U-87 MG высевали в 6-луночные планшеты (106 клеток/лунка) и культивировали в течение 24 ч. После клетки инкубировали со свежей средой, содержащей Dox, NPh-Dox и NPh-Dox-NGR (0.5 мкг/мл и 5 мкг/мл по Dox) в течение 24 ч (37°C, 5% CO2). Далее клетки дважды отмывали от среды и разводили раствором Версена с последующим суспендированием путем пипетирования. Далее клетки центрифугировали при 1200 об/мин на Centrifuge 5810R (“Eppendorf”, Германия) в течение 5 мин. Полученный осадок ресуспендировали в 100 мкл буфера для связывания аннексина V, 1х (“Lumiprobe”). Клетки инкубировали с 5 мкл аннексина V-AF488 15 мин в темноте при комнатной температуре. Добавляли 400 мкл буфера для связывания в каждую пробирку. После добавляли 5 мкл пропидий йодида (PI), аккуратно перемешивали содержимое пробирки и инкубировали в течение 5 мин при комнатной температуре в темноте. Окрашивание клеток анализировали с помощью проточного цитометра FACSAria III (“BD Biosciences”, США), оснащенного синим (488 нм) и желто-зеленым (561 нм) лазерами. Результаты обрабатывали с помощью программного обеспечения BD FACSDiva версии 7. Графическое представление данных было произведено с использованием FlowJo версии 10. Статистическая обработка Для оценки достоверности различий измеряемых параметров по трём-четырём повторностям использовали критерий Стьюдента. Различия считали статистически значимыми при p≤0.05. На рисунках данные представлены как среднее ± стандартная ошибка среднего. РЕЗУЛЬТАТЫ В работе исследовали разработанную ранее композицию NPh-Dox-cRGD [25], содержащую аффинный к интегрину αvβ3 адресный циклический пептид cRGD [27]. На поверхности опухолевых клеток ГБМ выявлен достаточно высокий уровень интегрина αvβ3, позволяющий обеспечить повышенный захват зондов для доставки лекарств [18]. Ранее на клетках ГБМ U-87 MG нами было показано, что использование адресного пептида (сRGD) в составе фосфолипидной Dox-содержащей композиции повышало как общее накопление лекарства, так и его проникновение внутрь клетки [25]. Результаты сравнительной оценки цитотоксического действия Dox, встроенного в НЧ с адресным фрагментом (NPh-Dox-cRGD), свободной субстанции Dox и фосфолипидной композиции Dox без адресного пептида представлены на рисунке 1. В качестве контрольной линии использовали линию клеток HeLa, для которой указанный рецептор не характерен [28].
Во всех вариантах исследуемый показатель процента жизнеспособности клеток зависел от используемой дозы и от времени инкубации с веществами. После 24 ч инкубации клеток линии U-87 MG с исследуемыми веществами разница была отмечена при минимальной концентрации (0.025 мкг/мл). В варианте с адресным фрагментом процент живых клеток составлял 97%, с образцом фосфолипидной композиции – 88%, для свободной субстанции Dox – около 77%. Повышение концентрации Dox во всех образцах приводило к практически равному снижению процента живых клеток (разница между образцами была в пределах ошибки). При концентрации 5 мкг/мл (по Dox) данный показатель для фосфолипидной композиции был выше остальных образцов на 7-8%. При 15 мкг/мл наблюдалось снижение процента живых клеток в образце с Dox на 11% и 14% по сравнению с фосфолипидными образцами с адресным компонентом и без соответственно. В максимальной концентрации 30 мкг/мл (в пересчете на Dox) отмечено большее влияние фосфолипидных образцов независимо от наличия адресного пептида (для субстанции – 6%, для NPh-Dox-cRGD – 21%, для NPh-Dox – 17%), т.е. при встраивании Dox в фосфолипидные НЧ отмечено проявление его цитотоксического действия в меньшей степени. На линии клеток HeLa, аналогично линии U-87 MG, с увеличением концентрации процент живых клеток уменьшался. При этом между образцами в каждой рассматриваемой концентрации (по Dox) достоверного различия отмечено не было. При сравнении двух указанных клеточных линий в максимальной концентрации действующего вещества получены одинаковые значения процента живых клеток, соответственно данная концентрация является наиболее токсичной для клеток, в том числе для фосфолипидных композиций не зависимо от наличия cRGD. Через 48 ч инкубации клеток U-87 MG с исследуемыми веществами был отмечен аналогичный дозозависимый эффект (рис. 1В). При минимальной концентрации (0.025мкг/мл) была показана большая разница в значениях между образцами. Максимальное значение процента живых клеток отмечено в варианте с cRGD-пептидом (73%), что на 9% и 17% выше фосфолипидного образца и свободной субстанции соответственно. В максимальной концентрации (по Dox) различий для исследуемых образцов в цитотоксическом действии зафиксировано не было. Через 48 ч инкубирования клеток HeLa с исследуемыми веществами (рис. 1Г) было показано, что концентрация по Dox, равная 2.5 мкг/мл и выше, приводила к полной гибели клеток. Достоверная разница получена для образцов фосфолипидных композиций с адресным пептидом и без (64% и 66% соответственно) по сравнению со свободной субстанцией, где значения процента живых клеток были практически в два раза ниже. При 0.025 и 0.05 мкг/мл жизнеспособность клеток была выше, однако, без достоверной разницы между образцами. В таблице 1 приведены результаты по расчету IC50, полученные для клеток U-87 MG через 24 ч инкубации с исследуемыми веществами.
Расчетные значения IC50 показали, что для фосфолипидной композиции данная концентрация была максимальна (20.78 мкг/мл) и превышала значения для свободной субстанции практически на 37%, а для композиции с адресным пептидом – на 19%. Таким образом, можно предположить, что фосфолипидная композиция Dox с адресным фрагментом обладает меньшей токсичностью по сравнению со свободной субстанцией, однако несколько большей, чем фосфолипидная композиция (NPh-Dox). Согласно литературным данным, цитотоксическое действие свободного Dox обусловлено его способностью быстро диффундировать в цитоплазму, а затем в ядро клеток U87-MG [29]. Также Dox интеркалирует ДНК, тем самым предотвращая ее репликацию, однако свободный Dox не обладает способностью избирательно воздействовать на опухоль in vivo, что может приводить к серьезным побочным эффектам [29]. В работе [30] было проведено аналогичное нашему исследование цитоксичности Dox на клеточной линии U-87 MG при инкубации с образцом H40-Dox-cRGD, представляющего собой cRGD-конъюгированный пептид с Dox в мицеллах, где было показано меньшее цитотоксическое действие образца, содержащего Dox и cRGD пептид.. В другом исследовании [31] на линии клеток B16, экспрессирующей на своей поверхности интегрин αvβ3, схожий эффект был отмечен при оценке цитотоксического действия композиции с RGD пептидом, при этом противоопухолевый эффект в группе с RGD пептидом был выше в сравнение с группой, получавшей физиологический раствор.
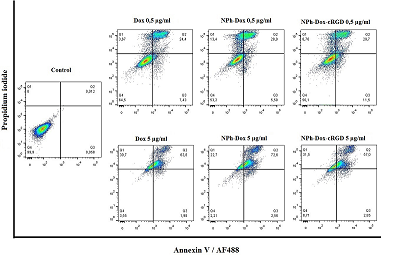
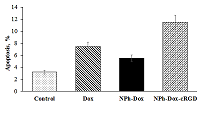
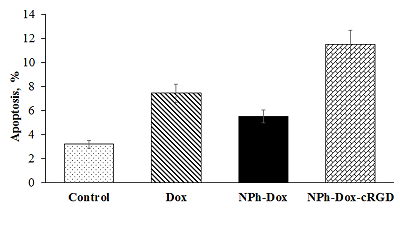
В литературе описаны различные механизмы действия Dox на гибель клетки, в том числе, и апоптоза [32]. При встраивании лекарств в различные транспортные системы возможны изменения в их механизме цитотоксического действия, в том числе путей гибели клетки, поэтому с помощью метода проточной цитометрии исследовали возможные пути гибели опухолевых клеток на клеточной линии глиобластомы U-87 MG (рис.2). Из представленных на рисунке 2 данных видно, что для образца с минимальной концентрацией Dox происходит отделение популяции, четко переходящей в область позднего апоптоза. При этом процент клеток, подверженных позднему апоптозу, в варианте фосфолипидной Dox-содержащей композицией увеличивался. При инкубации с композицией Dox, содержащей адресный пептид, данный показатель составлял 29.7%, для свободной формы Dox – 24.4%. При минимальной концентрации по Dox (0.5 мкг/мл) больший процент клеток, подверженных раннему апоптозу, был отмечен при инкубации клеток с композицией, содержащей адресный пептид (NPh-Dox-cRGD) (рис.3).
При увеличении концентрации по Dox (5 мг/мл) основная популяция клеток подвергалась гибели посредством позднего апоптоза. Также процент клеток, подверженный гибели путем раннего апоптоза, был выше при инкубации с композицией, содержащей адресный пептид (NPh-Dox-cRGD). Однако при инкубации с данной композицией (NPh-Dox-cRGD) наблюдалось большее количество живых клеток (Q4), и меньший процент клеток, подверженных позднему апоптозу (Q2), процент клеток был не на много ниже, чем в варианте с клетками, инкубированными со свободным Dox (рис. 2). Для более детального понимания процесса гибели клеток необходимы дополнительные исследования механизма действия исследуемой композиции. Таким образом, полученные результаты свидетельствуют о том, что использование адресного пептида не приводило к снижению/изменению цитотоксического действия Dox. Проведенное нами ранее исследование показало большее накопление Dox при инкубации экспрессирующих на своей поверхности интегрин αvβ3 опухолевых клеток с композицией, содержащей cRGD [25]. Полученные данные по оценке цитотоксичности и пути гибели опухолевых клеток in vitro также показывают перспективность NPh-Dox-cRGD. ЗАКЛЮЧЕНИЕ Лечение онкологических заболеваний, в частности ГБМ, связано с рядом сложностей. После хирургического вмешательства одним из методов последующего лечения является химиотерапия. Ряд недостатков при использовании химиопрепаратов связан с неспецифическим их распределением в организме [33]. Эффективность химиотерапии ограничена в основном из-за недостаточной доставки большинства терапевтических препаратов в мозг, связанной с прохождением ГЭБ [34]. Для решения указанных недостатков проводится много исследований в области разработки различных наночастиц для встраивания лекарственных соединений, в частности, большинство работ направлено на разработку адресных систем доставки. В нашей предыдущей работе [25] была получена фосфолипидная композиция Dox с сRGD-пептидом в качестве адресного фрагмента с размером частиц 50 нм. В экспериментах in vitro по оценке накопления в клетках глиобластомы U-87 MG через 3 ч инкубации с веществами было показано повышение проникновения Dox внутрь клетки (интернализация) при инкубации с образцом NPh-Dox-cRGD практически в 1.4 раза по сравнению со свободным Dox. Дальнейшие исследования оценки цитотоксичности, выполненные в данной работе, показали при инкубации клеток U-87 MG с исследуемыми веществами наличие дозозависимого эффекта. В максимальной концентрации 30 мкг/мл (в пересчете на Dox) отмечено большее влияние фосфолипидных образцов независимо от наличия адресного пептида (для субстанции – 6%, для NPh-Dox-cRGD – 21%, для NPh-Dox – 17%), т.е. при встраивании Dox в фосфолипидные НЧ отмечено его меньшее цитотоксическое действие. Расчетные значения IC50 для фосфолипидной композиции были максимальны (20.78 мкг/мл) и превышали значения для свободной субстанции практически на 37%, а для композиции с адресным пептидом - на 19%. Исследование пути гибели опухолевых клеток показало, что основной процент клеток был подвержен апоптотической гибели; следовательно, встраивание Dox в фосфолипидные НЧ и снабжение их адресным пептидом не влияло на механизм гибели клеток под действием Dox, усиливая его действие. Полученные результаты свидетельствуют о перспективности разработанной композиции (NPh-Dox-cRGD) и целесообразности проведения дальнейших исследований для прояснения дополнительных механизмов в проявлении цитотоксического действия разработанной композиции. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. Использование биологического материала осуществлялось в соответствии с методическими рекомендациями и на основании предусмотренных документов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№ 122030100170-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|