|
Сравнительный SPR анализ межмолекулярных взаимодействий с использованием оригинального чипа BIACORE CM5 и его аналога CMD500M
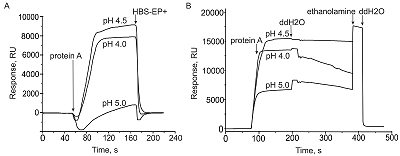
Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, Ключевые слова: поверхностный плазмонный резонанс (SPR); карбоксиметилированный декстран; взаимодействие антиген-антитело; кинетические константы (kon, koff); равновесная константа диссоциации (Kd); чипы CM5 и их аналоги CMD500M DOI: 10.18097/BMCRM00220 ВВЕДЕНИЕ С момента появления первых оптических биосенсоров, работающих на эффекте поверхностного плазмонного резонанса (SPR, от английского Surface Plasmon Resonance), прошло более 30 лет и в настоящее время они являются основной технологией для регистрации межмолекулярных взаимодействий. Принцип SPR анализа основан на прямой регистрации в реальном времени взаимодействия свободно плавающего в жидкости молекулярного партнера (аналита) с иммобилизованным на поверхности оптического чипа вторым партнером (лигандом) по изменению коэффициента преломления у поверхности чипа [1-5]. В течение трех десятилетий несомненным лидером в области SPR были шведские биосенсоры типа Biacore (в настоящее время бренд принадлежит фирме “Cytiva”, США). Данные биосенсоры широко используются для решения разнообразных фундаментальных задач в области биомедицины [6-10], а также прикладных работ в области фармакологии для идентификации биологически активных соединений как кандидатов для создания мишень-специфичных лекарств [11, 12], биотерапевтических препаратов [13, 14] и ингибиторов целевых белок-белковых взаимодействий [15]. Работа SPR биосенсоров типа Biacore основана на использовании сменных одноразовых оптических чипов, стоимость которых составляет значимую часть бюджета лабораторий, имеющих данные биосенсоры. В настоящее время, в связи с санкционными ограничениями, в РФ отсутствует возможность закупки расходных материалов для имеющегося оборудования производства “Cytiva” (США). Поэтому для пользователей биосенсоров Biacore крайне актуален вопрос обеспечения их дальнейшей работы с использованием совместимых аналогов расходных материалов и в первую очередь оптических чипов. Существуют два варианта решения данного вопроса: 1) использование совместимых с биосенсорами Biacore чипов-аналогов, выпускаемых фирмой “XanTec bioanalytics GmbH” (Германия) (далее “XanTec”); 2) замена пользователем старого оптического элемента в использованном оригинальном чипе на новый, выпускаемый фирмой “Sofchip” (США). В данной работе нами рассмотрен первый вариант - использование чипов-аналогов фирмы “XanTec”. Реализация второго варианта с заменой оптического элемента в чипе Biacore - это отдельная и непростая задача. Демонтаж старого оптического элемента из корпуса чипа и вклеивание на его места нового требует практически ювелирных навыков ручной работы и особой чистоты рабочего места, так как оптический элемент представляет собой очень тонкую стеклянную пластинку (размеры 9x9x0.3 мм) с напыленным слоем золота и функциональным покрытием (в случае чипов СМ5 - это слой карбоксиметилированного декстрана). Фирма “XanTec” выпускает чипы-аналоги для оптических биосенсоров разных производителей. В научной литературе есть немало работ, выполненных с использованием таких чипов на биосенсорах Reichert [16], Carterra LSA [17], Biacore 3000 [18–20], Biacore T200 [21, 22], Biacore 8K [17], Biacore X100 [23]. Наиболее часто пользователи биосенсоров Biacore используют оптический чип СМ5, который является стандартом для большинства исследований. Фирма “XanTec” выпускает аналог данного чипа с маркировкой CMD500M, который ряд исследователей успешно использует в своих работах вместо стандартного СМ5 [18, 19, 21]. Однако вопрос о сходимости результатов экспериментальных измерений одних и тех же молекулярных взаимодействий, полученных с использованием оригинальных чипов СМ5 и их аналогов CMD500M, оставался не ясен. На сайте “XanTec” имеется очень краткая и неполная информация в виде информационного бюллетеня [23] о результатах сравнительных испытаний чипов СМ5 и CMD500M, выполненных в исследовательском центре канадской фирмы GFB Biopharmaceuticals на биосенсоре Biacore 8K. Однако документ «Test report “XanTec sensor chips”, 2008», на который ссылается фирма “XanTec”, в Интернете отсутствует. Вместе с тем, в научной литературе нами была найдена только одна независимая публикация [24], в которой было выполнено сравнение результатов измерений взаимодействия одной и той же пары белков, бета2-микроглобулина (b2m) и антитела к этому белку (анти-b2m антитело), с использованием чипов Biacore СМ5 и XanTec CMD500M. Авторы показали, что при полной технической совместимости чипов двух производителей наблюдаются явные различия в точности получаемых данных. Неоднозначность информации о совместимости чипов двух производителей побудила нас выполнить собственный сравнительный SPR анализ сходимости результатов, получаемых с использованием оригинального чипа Biacore CM5 и чипа-аналога XanTec CMD500M. В качестве тестовой белковой пары были использованы белок А и антитело класса иммуноглобулинов G. Данная пара была выбрана как оптимальная по устойчивости к физико-химическим воздействиям, хорошей растворимости в воде и стехиометрии взаимодействия 1:1, что значительно упрощает математический анализ полученных сенсограмм. МАТЕРИАЛЫ И МЕТОДЫ Для анализа взаимодействий антител с иммобилизованным на оптическом чипе белком А был использован оптический биосенсор Biacore X100 (“Cytiva”, США), работающий на эффекте поверхностного плазмонного резонанса (SPR). Сигнал биосенсора регистрировали в реальном времени в резонансных единицах RU (1 RU = 1 пг белка на поверхности оптического чипа) в виде сенсограмм. Все измерения проводили при температуре 25°С. В работе использовали оригинальные чипы Biacore CM5 (“Cytiva”, США) и их аналоги CMD500M (“Xantec”, Германия), покрытые карбоксиметилированным декстраном. В соответствии с руководствами фирм-производителей чипы СМ5 и CMD500M хранили при температуре +4°С и -20°С, соответственно. В работе были использованы следующие реактивы фирмы “Cytiva” (США): рабочий буфер HBS-EP+ (150 мМ NaCl, 3 мМ ЭДТА, 0.05% детергент P20, 10 мМ HEPES, pH 7.4), набор для ковалентной иммобилизации белков за первичные аминогруппы (1-этил-3-(3-диметиламинопропил)-карбодиимид-HCl (EDC), N-гидроксисукцинимид (NHS), 1 М этаноламин-HCl (pH 8.5), набор 10 мМ ацетатных буферов (рН 4.0, 4.5, 5.0), 10 мМ глициновый буфер (рН 2.5). Белок А был получен от фирмы “Имтек” (Россия). Моноклональные антитела мыши к иммуноглобулинам G человека, изотип IgG2a (кат. № 1G1cc клон 5А9сс) были получены от фирмы “Хайтест” (Россия). Процедура рН-скаутинга Для оптимизации протокола иммобилизации белка А в качестве белка-лиганда была выполнена процедура рН-скаутинга на чипах СМ5 и CMD500M (рис. 1). Для этого через измерительную ячейку биосенсора последовательно инжектировали растворы белка А (100 мкг/мл) в 10 мМ ацетатном буфере с pH 4.0, 4.5, 5.0 в течение 2 мин при скорости потока 10 мкл/мин. В соответствии с инструкциями к чипам от фирм-производителей, в качестве рабочего буфера для чипа СМ5 был использован буфер HBS-EP+, а в случае СМD500M - бидистиллированная вода (ddH2O). В случае чипа СМ5 после каждой инжекции раствора белка А поверхность чипа регенерировали промывкой рабочим буфером в течение 30 с при скорости потока 10 мкл/мин (рис. 1 А). В случае чипа СМD500M после каждой инжекции раствора белка А поверхность чипа регенерировали инжекциями 1 М раствора этаноламин-HCl (pH 8.5) в течение 30 с при скорости потока 30 мкл/мин (рис. 1 B). Выполнение протокола рН-скаутинга позволило оценить уровень преконцентрации белка A у поверхности чипов и в обоих случаях выбрать оптимальное значение pH 4.5, при котором наблюдался максимальный рост сигнала биосенсора.
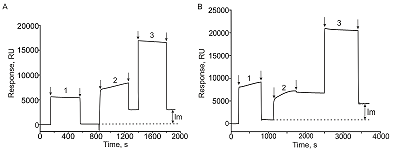
Иммобилизация белка А на чипе CM5 Иммобилизацию белка А осуществляли за счет формирования ковалентных связей между карбоксильными группами на поверхности оптического чипа СМ5 и аминогруппами белка А. Для этого карбоксильные группы чипа активировали инжекцией смеси 0.2 М EDC/0.05 М NHS в течение 7 мин при скорости потока 10 мкл/мин. Инжекцию раствора белка А (100 мкг/мл) в 10 мМ ацетатном буфере (рН 4.5) выполняли со скоростью 5 мкл/мин в течение 7 мин. Остаточные непрореагировавшие активные группы на поверхности чипа блокировали инжекцией раствора 1 M этаноламин-HCl (pH 8.5) в течение 7 мин при скорости потока 10 мкл/мин. В качестве рабочего буфера использовали HBS-EP+ (рН 7.4). В результате на поверхности чипа было иммобилизовано примерно 3.0 нг белка А (3000 RU). Сенсограмма иммобилизации представлена на рис. 2A.
Иммобилизация белка А на чип CMD500M Карбоксильные группы чипа CMD500M активировали инжекцией смеси 0.2 М EDC /0.05 М NHS в течение 10 мин при скорости потока 5 мкл/мин. Инжекцию раствора белка А (100 мкг/мл) в 10 мМ ацетатном буфере (рН 4.5) выполняли со скоростью 5 мкл/мин в течение 10 мин. Непрореагировавшие активные группы чипа блокировали инжекцией раствора 1M этаноламин-HCl (pH 8.5) в течение 15 мин при скорости потока 5 мкл/мин. В качестве рабочего буфера была использована бидистиллированная вода. В результате на поверхности чипа было иммобилизовано примерно 3.4 нг белка А (3400 RU) (рис. 2B). Протоколы иммобилизации белка А на обоих вариантах чипов представлены в табл. 1. Различия протоколов минимальны - в случае чипов CMD500M - более длительные инжекции и использование ddH2O вместо буфера HBS-EP+. Количество иммобилизованного белка А на чипах двух типов отличается незначительно (не более 12 %).
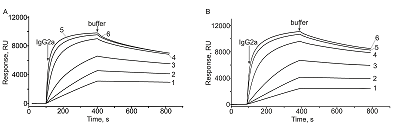
Исследование взаимодействия IgG2а с иммобилизованным белком А Регистрацию взаимодействий антител (IgG2а) с иммобилизованным белком А выполняли в режиме реального времени путём последовательных инжекций растворов IgG2а (в диапазоне концентраций от 10 нМ до 1 мкМ) через рабочий (с белком А) и контрольный (без белка) каналы биосенсора в течение 5 мин при скорости потока 10 мкл/мин. После каждого измерения поверхность оптического чипа регенерировали инжекцией 10 мМ глицинового буфера (pH 2.5) в течение 30 с при скорости потока 30 мкл/мин. В качестве рабочего буфера использовали HBS-EP+. Серии полученных сенсограмм анализировали с помощью программы Biaevaluation 4.1.1 с использованием модели взаимодействия 1:1 (Langmuir) binding. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ В результате выполненного SPR-анализа были получены наборы сенсограмм взаимодействий антител IgG2а (в диапазоне концентраций от 10 нМ до 1 мкМ) с иммобилизованным на двух типах чипов белком А. Типичные сенсограммы представлены на рис. 3. Величины кинетических констант и равновесной константы диссоциации комплексов, рассчитанные из экспериментальных кривых согласно модели 1:1 (Langmuir) binding представлены в табл. 2. Можно видеть, что отличия в значениях констант, полученных на чипах от разных производителей, незначительны: значения константы скорости ассоциации (kon) различаются на 18%, значения константы скорости диссоциации (koff) - на 10%, а значения равновесной константы диссоциации (Kd) - на 9%.
В публикации [23] авторы в сравнительном исследовании чипов CM5 и CMD500M обнаружили значительные различия как в уровнях иммобилизации белка-лиганда, так и в величинах кинетических констант и равновесной константы диссоциации. Различие в уровнях иммобилизации приводит также к различию в значениях Rmax (максимально возможного сигнала биосенсора при насыщении лиганда), определенных из экспериментальных кривых. Rmax был выше в случае чипа CMD500М по сравнению с чипом СМ5. В нашем исследовании мы также наблюдали более высокий Rmax (на 11%) в случае чипа CMD500М от “XanTec” по сравнению с СМ5 (11000 RU против 9800 RU). Значения кинетических констант и равновесной константы диссоциации комплексов PD-1/анти-PD-1 (рецептор программируемой гибели клеток 1/моноклональные антитела к нему), измеренные на Biacore 8K с использованием чипа CMD200M (“XanTec”), практически накладываются на значения, измеренные на сенсорном чипе CM5 (“Cytiva”) [17]. Полученные нами результаты сходны с этим и показывают небольшую разницу между одинаковыми типами чипов от разных поставщиков. Наши данные свидетельствуют о том, что чипы CM5 и CMD500M взаимозаменяемые, так как позволяют выполнять исследования на одном и том же приборе с отличиями от 9 % до 18 % в уровнях ковалентной иммобилизации белка и в параметрах белок-белковых взаимодействий. ЗАКЛЮЧЕНИЕ Нами было выполнено сравнительное исследование межмолекулярных взаимодействий с использованием оригинального оптического чипа CM5 (“Cytiva”) и его аналога CMD500M (“XanTec bioanalytics GmbH”). Это исследование будет полезно пользователям биосенсоров Biacore, работающим в условиях санкций. Полученные результаты позволяют сделать вывод, что чипы CMD500M “Xantec” можно использовать для работы на SPR биосенсорах типа Biacore. Результаты анализа одних и тех же белок-белковых взаимодействий в этом случае могут отличаться не более чем на 18%. Таким образом, данное исследование подтвердило практически полную взаимозаменяемость оригинальных SPR чипов CM5 (“Cytiva”) и их аналогов CMD500M (“XanTec bioanalytics GmbH”). СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит каких-либо исследований с участием людей или с использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа была выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021 - 2030 годы) (№122030100168 2). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|