|
СОДЕРЖАНИЕ 1. АНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ЦИТОХРОМОВ Р450 ЭЛЕКТРОХИМИЧЕСКИМИМ МЕТОДАМИ 2. ЭЛЕКТРОХИМИЧЕСКИЙ АНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA 4. ЭЛЕКТРОАНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ β-ЛАКТАМАЗЫ СТХ-М-116 5. МЕТОДЫ ЭЛЕКТРОАНАЛИЗА АКТИВНОСТИ РЕСТРИКТАЗ И НУКЛЕАЗ СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Рисунок 4Методы повышения каталитической активности цитохромов Р450 в электрохимических системах. Таблица 1Определение активности цитохромов Р450 методом электрохимического анализа метаболитов. |
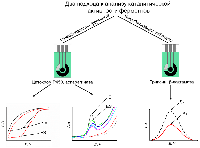
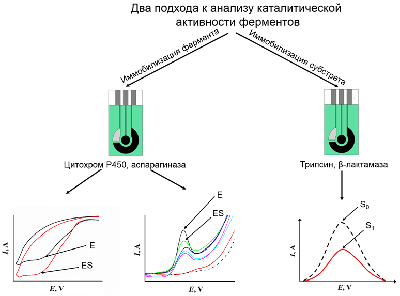
Новые высокочувствительные методы электроанализа каталитической активности ферментов, имеющих медицинскую значимость 1Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича, 119121, Москва, ул. Погодинская, 10; *e-mail: viktoria.shumyantseva@ibmc.msk.ru 2Российский национальный исследовательский медицинский университет имени Н.И. Пирогова, Москва Ключевые слова: ферменты; субстраты; ингибиторы; ферментативный катализ; электрохимический анализ DOI: 10.18097/BMCRM00225 ВВЕДЕНИЕ Ферменты широко используются в качестве катализаторов в промышленности, при утилизации отходов в полезные конечные продукты или экологически чистые заменители, улучшении сырья, а также как катализаторы биосинтетических реакций, для получения различных соединений, включая стереоспецифическую биоконверсию [1, 2]. Ферменты используются в клинико-диагностических лабораториях для диагностики заболеваний [3, 4]. В связи с этим, анализ каталитических и кинетических параметров ферментативных реакций, изучение механизма межлекарственных взаимодействий, выявление новых субстратов и ингибиторов, является актуальной и быстроразвивающейся областью биомедицины. В данном обзоре представлены разработанные авторами две платформы для электрохимического анализа каталитической активности ферментов, имеющих медицинскую значимость. Для исследования каталитической активности ферменты (цитохромы P450 и аспарагиназа) были иммобилизованы на рабочей поверхности электродов. Иммобилизация субстратов на электроде была использована для регистрации каталитических свойств трипсина, бета-лактамазы, а также нуклеаз и рестриктаз (рис. 1).
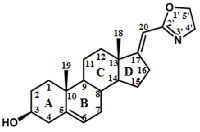
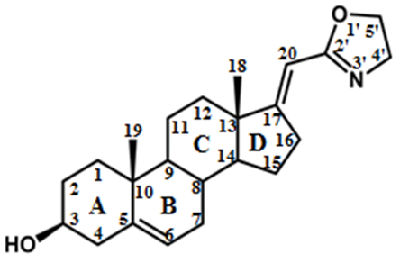
1. АНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ЦИТОХРОМОВ Р450 ЭЛЕКТРОХИМИЧЕСКИМИМ МЕТОДАМИ Так как цитохромы Р450 метаболизируют многочисленные эндогенные соединения и ксенобиотики, анализ каталитической активности этого класса гемопротеинов имеет диагностическое значение [6-11]. Для исследования каталитической активности цитохромов Р450 разработаны методы электрохимического анализа этих гемопротеинов. При иммобилизации ферментов на электроде происходит перенос электронов от электрода к простетической группе фермента (гему). Электрохимическое восстановление цитохромов Р450 может служить заменой природным донорам электронов NADPH или NADH [12-16]. Электрохимические системы на основе цитохромов Р450 являются эффективными неинвазивными моделями для исследования субстратной специфичности этого класса гемопротеинов, при поиске новых лекарственных препаратов, анализе межлекарственных взаимодействий, регуляции активности полиморфных модификаций цитохромов Р450 с помощью препаратов-корректоров. 1.1. Поиск ингибиторов цитохромов Р450 среди новых химических соединений Цитохром P450 17А1 (CYP17A1) катализирует реакцию 17α-гидроксилирования прегненолона и прогестерона с образованием соответствующих производных (являющихся предшественниками как половых, так и кортикостероидных гормонов) и последующую 17,20-лиазную реакцию, приводящую к образованию андрогенов – дегидроэпиандростерона и андростендиона. Одной из стратегий фармакотерапии рака предстательной железы является снижение уровня андрогенов за счёт использования ингибиторов CYP17A1 – ключевого фермента биосинтеза андрогенов. С помощью разработанной электрохимической системы на основе CYP17А1, был проведён скрининг ингибиторной активности новых оксазолиновых производных [17(20)E]-прегнена (получены в лаборатории синтеза физиологически активных соединений ИБМХ), различающихся структурой оксазолинового и стероидного фрагментов. Среди оксазолиновых производных [17(20)E]-прегнена выявлены эффективные ингибиторы электрокаталитической активности CYP17A1 (рис. 2), перспективные в качестве потенциальных лекарственных препаратов для лечения рака предстательной железы [17, 18]. Показано, что эффективность ингибирования электрокаталитической активности CYP17A1 зависит как от структуры, так и от относительной гидрофобности молекулы ингибитора.
1.2. Влияние метаболических антиоксидантных препаратов на каталитическую активность цитохромов Р450 Разработанные электрохимические системы на основе цитохрома P450 3A4 (CYP3А4) и цитохрома P450 2C9 (CYP2С9) были использованы для исследования влияния антиоксидантных метаболических препаратов, применяемых в клинической практике (аскорбиновая кислота, восстановленный глутатион (GSH), таурин, цитохром с (cyt c), этилметилгидроксипиридина малат (этоксидол)), на каталитическую активность этих изоферментов. Полученные с помощью разработанных электрохимических систем на основе CYP3A4 и CYP2C9 экспериментальные данные о влиянии исследуемых соединений на каталитическую активность изоферментов цитохрома Р450 свидетельствуют, что антиоксидантные препараты стимулируют электрохимическое восстановление и стабилизируют изоферменты цитохрома Р450 путём уменьшения скорости накопления пероксида водорода, образующегося при разобщении каталитического цикла и при электрохимическом восстановлении кислорода [19-21]. Таким образом, антиоксидантные метаболические препараты могут использоваться в комплексной фармакотерапии с целью регуляции скорости метаболизма лекарственных препаратов, особенно при персонализированном подходе к лечению пациентов с полиморфизмом генов изоферментов цитохрома Р450. Проведены исследования с участием добровольцев по анализу каталитической активности CYP3А4 на основе экспериментальной оценки соотношения 6β-гидроксикортизол/кортизол и влияния антиоксидантов на активность этого фермента, которые выявили влияние таурина на метаболизм кортизола, но отсутствие такового влияния у L-карнитина [22-24]. 1.3. Межлекарственные взаимодействия (МЛВ) Межлекарственные взаимодействия (МЛВ) – серьёзная проблема современной медицины. МЛВ проявляются при одновременном приёме нескольких препаратов и связаны с взаимным влиянием как самих препаратов, так и их метаболитов на биотрансформацию. Это может привести к нарушению фармакологического действия, проявлению негативных побочных эффектов и изменению их свойств, а также к изменению диапазона эффективных концентраций (смещение «терапевтических окон»). Значительная часть побочных эффектов фармакотерапии обусловлена ингибированием цитохромов P450. В связи с этим, актуальны и востребованы адекватные модельные системы на основе цитохромов Р450, метаболизирующих лекарственные средства, для исследования потенциальных МЛВ. В наших исследованиях с помощью разработанных электрохимических систем на основе клинически значимых цитохромов P450 был выявлен ряд МЛВ [25-28]. Было исследовано взаимодействие ингибитора протонного насоса омепразола и макролидного бактериостатического антибиотика эритромицина, метаболизируемых CYP3А4. Взаимное влияние этих лекарственных средств на CYP3А4 выражается в снижении скорости реакции N-деметилирования эритромицина в присутствии омепразола, но в отсутствии влияния эритромицина на метаболические превращения омепразола [25]. Субстрат CYP3А4 – противоопухолевый препарат абиратерон – одновременно является конкурентным ингибитором эритромицин N-деметилазной активности этого фермента (Ki = 8.1±1.2 мкМ), при этом эритромицин не ингибировал активность CYP3A4 по отношению к абиратерону [27]. С помощью электрохимической системы были выявлены ингибирующие свойства абиратерона по отношению к (S)-напроксен O-деметилазной активности CYP2С9; при этом фармакологически активный 3-кето-Δ4-метаболит абиратерона (D4A), перспективный в качестве нового противоопухолевого агента, проявлял менее выраженные ингибиторные свойства по отношению к ферменту по сравнению с абиратероном [28]. 1.4. Электроанализ полиморфных модификаций CYP2С9, 2С9*2 и 2С9*3 и исследование их каталитических свойств в присутствии антиоксидантных метаболических препаратов Изменения каталитических свойств цитохромов P450 вследствие полиморфизма их генов являются причиной многих нежелательных побочных проявлений лекарственных препаратов. В связи с этим исследование особенностей каталитической активности полиморфных вариантов цитохромов Р450 является актуальным. Исследованы электрохимические свойства CYP2С9 и полиморфных форм CYP2С9*2 (замена аргинина в 144 положении на цистеин) и CYP2С9*3 (замена изолейцина в 359 положении на лейцин). Для целенаправленной регуляции биотрансформации лекарств in vivo может быть реализован подход с помощью коррекции собственной активности фермента. В связи с этим актуальным и важным подходом является регуляция ферментативной активности с помощью соединений, не являющихся субстратами этого гемопротеина, но оказывающих влияние на отдельные стадии катализа. Ранее были исследованы антиоксидантные метаболические препараты и витамины-антиоксиданты в качестве корректоров каталитических процессов цитохромов Р450. Такие препараты стимулируют процесс электрохимического восстановления иона железа гема CYP3A4, CYP2C9 и цитохрома P450 2D6 (CYP2D6), регистрируемый по возрастанию амплитуды катодного тока при соответствующем потенциале. Препараты, обладающие антиоксидантными свойствами, мексидол (этилметилгидроксипиридина сукцинат) и таурин стимулировали не только стадию восстановления цитохромов Р450 2С9, Р450 2С9*2 и Р450 2С9*3, но и проявили активирующее действие на каталитическую активность цитохромов Р450 2С9, 2С9*2 и 2С9*3 по отношению к субстрату диклофенаку [29]. В присутствии мексидола, метаболического антиоксидантного препарата, регистрируется повышение каталитической активности CYP2С9 по отношению к диклофенаку в 1.7 раза. Таурин, витаминоподобное соединение с антиоксидантными свойствами, также стимулирует метаболизм диклофенака в 1.5 раза.
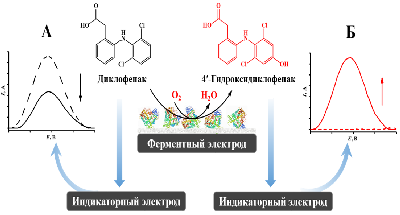
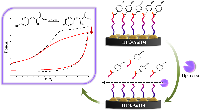
Основываясь на различии электрохимических свойств ряда субстратов и продуктов реакций, мы предложили концептуально новый подход для определения каталитической активности цитохромов P450, основанный на использовании биэлектродных электрохимических систем. Один из электродов биэлектродной системы (ферментный) используется для иммобилизации рекомбинантных или мембраносвязанных изоформ цитохрома P450, при этом другой электрод (индикаторный) служит для регистрации уменьшения количества субстрата или прироста продукта реакции за счёт прямого электрохимического окисления этих соединений. Основным достоинством такого подхода для определения кинетических параметров фермента является отсутствие необходимости использования NADPH как источника электронов и NADPH-регенерирующей системы, поскольку реакции инициируются электронами с электрода, а также разделения реакционной смеси после проведения ферментативной реакции в случае неперекрывающихся потенциалов окисления субстрата и продукта. Использование взаимозаменяемых электродов, получаемых методом трафаретной печати (печатных электродов, ПГЭ), с диаметром графитового рабочего электрода 2-4 мм как для иммобилизации ферментов, так и для определения образующихся продуктов позволяет миниатюризировать процесс определения активности цитохромов Р450. На рисунке 3 представлен принцип биэлектродных электрохимических систем для определения активности цитохромов P450. Использование двух диапазонов потенциалов позволяет регистрировать как электрокаталитическую активность цитохромов Р450, так и электроокисление лекарства. Метод востребован для анализа и сравнительной оценки каталитических свойств цитохромов Р450 при выделении экспрессированных ферментов, модифицированных ферментов, для анализа межлекарственных взаимодействий, для исследования особенностей генетического полиморфизма.
Разработаны биэлектродные электрохимические системы для определения гидроксилазной активности CYP3A4 и CYP2C9 по отношению к диклофенаку, основанные на электрохимической регистрации убыли субстрата [30], а также системы, основанные на регистрации прироста продукта, для определения активностей CYP2C9 по отношению к (S)-варфарину [31], диклофенаку [32] и (S)-напроксену [33], CYP2C19 по отношению к фенитоину [34], CYP2E1 по отношению к хлорзоксазону [35], CYP19A1 по отношению к его природным субстратам – андростендиону и тестостерону [36]. Для разработанных систем были определены пределы определяемых концентраций продуктов реакций, а также параметры стационарной кинетики иммобилизованных на электроде ферментов (табл. 1). Возможность успешного применения разработанных систем для ингибиторного анализа цитохромов P450 была показана нами на примере сульфафеназола, являющегося известным ингибитором CYP2C9, флуконазола, ингибирующего активность CYP2C19, а также на примере механизм-активируемого ингибирования CYP19A1 экземестаном. Важно отметить, что использование in vitro систем, в том числе электрохимических, позволяет смоделировать цитохром P450-зависимый метаболизм лекарственных препаратов. Корреляция между клиренсами in vitro и in vivo позволяет спрогнозировать фармакокинетику и оценить дозировку препарата [37].
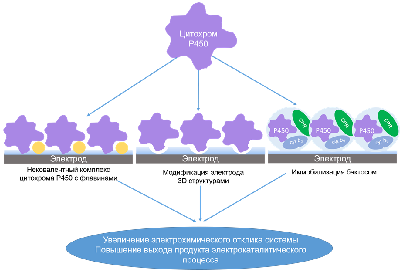
Одним из основных направлений современного биосенсорного электрохимического анализа является улучшение аналитических свойств электродов, использующихся для количественного определения аналитов, в том числе за счёт использования углеродных наноматериалов [38]. В наших исследованиях на примере электрохимической системы для определения активности CYP2C9 по отношению к диклофенаку мы показали, что использование одностенных углеродных нанотрубок (ОУНТ) для модификации индикаторных электродов для количественного определения продукта реакции 4¢-гидроксидиклофенака за счёт его электрохимического окисления позволяет снизить предел определяемых концентраций в 1.4 раза и увеличить чувствительность почти в 37 раз по сравнению с немодифицированными электродами [32]. Таким образом, разработанные нами биэлектродные электрохимические системы могут успешно использоваться для решения задач фармакологии, связанных с выявлением межлекарственных взаимодействий, обусловленных ингибированием индивидуальных изоформ цитохрома P450. 1.6. Методы повышения каталитической активности цитохромов Р450 в электрохимических системах Повышение эффективности электрокатализа имеет значение для скрининга субстрат/ингибиторного потенциала цитохромов Р450, так как позволит регистрировать каталитические процессы с большей чувствительностью. Кроме того, производительные электрокаталитические системы востребованы для создания биореакторов, а также для детоксикации токсичных органических соединений – субстратов этого класса гемопротеинов. Для повышения эффективности электрокатализа цитохромов Р450 разработаны подходы, в основе которых лежит механизм каталитического действия этого класса гемопротеинов и моделирование электрон-транспортной цепи монооксигеназной системы [40-43]: образование продуктивного фермент-субстратного комплекса, оптимизация электрон-транспортной цепи при включении флавиновых нуклеотидов в качестве участников цепи переноса электронов на электроде, модификация поверхности электродов трёхмерными неорганическими структурами для перехода от 2Д к 3Д режиму с использованием пористых мембран на основе анодного оксида алюминия, содержащих сонаправленные поры диаметром 0.1 мкм и 0.2 мкм. Ферментативные реакции в «замкнутых» пространствах (нанопорах, наноканалах, мицеллах, обращённых мицеллах) моделируют природные системы, в которых ферменты заключены в ограниченный объём и микроокружение, подобное клеточному (эффект молекулярного краудинга) (рис. 4).
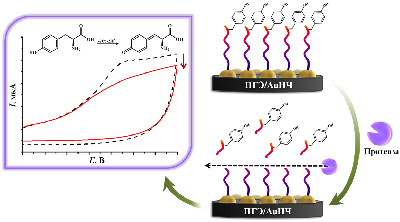
Наряду с созданием электрохимических систем на основе рекомбинантных цитохромов P450, интенсивное развитие получили электрохимические системы на основе иммобилизованных на электродах микросом человека либо микросом, полученных из трансгенных организмов, например, из клеток насекомых, трансфицированных бакуловирусом, несущим гены индивидуальных изоферментов цитохрома P450 человека и цитохром P450-редуктазы (Baculosomes™, Supersomes™) или мембранных фракций, полученных из Escherichia coli, продуцирующих индивидуальные изоферменты цитохрома P450 и компоненты монооксигеназной системы человека (Bactosomes®). Преимуществом таких систем является отсутствие необходимости выделения цитохрома P450 из мембранного микроокружения, что позволяет избежать инактивации фермента. В отличие от рекомбинантных форм ферментов, которые при адсорбции на немодифицированных электродах могут терять стабильность и активность, иммобилизация мембраносвязанных форм цитохромов P450 может препятствовать потере каталитической активности [35, 37, 44, 45]. Электрокаталитическая активность CYP2E1 в составе бактосом по отношению к хлорзоксазону была определена с помощью биэлектродной системы для определения продукта ферментативной реакции 6-гидроксихлорзоксазона [35]. Один из электродов системы был использован для иммобилизации коммерчески доступных бактосом, представляющих собой мембранную фракцию, полученную из E. coli, продуцирующей CYP2E1 человека, цитохром P450 редуктазу (CPR) и обогащённую цитохромом b5 (cyt b5). Второй электрод системы был использован для количественного определения методом квадратно-волновой вольтамперометрии 6-гидроксихлорзоксазона за счёт его прямого электрохимического окисления. Чувствительность метода определения 6-гидроксихлорзоксазона составила 0.016 мкА/мкМ, предел определяемых концентраций 6-гидроксихлорзоксазона – 0.11 мкМ. С помощью разработанной системы рассчитаны параметры стационарной кинетики реакции гидроксилирования хлорзоксазона при участии CYP2E1 в составе бактосом, иммобилизованных на электроде: максимальная скорость реакции (Vmax) 1.64±0.08 М/мин/(М фермента) и значение константы Михаэлиса KM 78±9 мкМ. Мы также детально исследовали электрохимические свойства бактосом, иммобилизованных на электроде, и показали, что перенос электронов с электрода происходит как на флавиновые простетические группы CPR, так и на ион железа гема CYP2E1 и cyt b5. Кроме того, мы показали, что CPR может активировать электрокаталитическую активность CYP2E1 по отношению к хлорзоксазону, по-видимому, за счёт межмолекулярного переноса электронов от электрохимически восстановленной формы CPR к иону железа гема CYP2E1. Разработанная биэлектродная система может использоваться при решении задач фармакологии, связанных с определением активности CYP2E1. Был проведён сравнительный анализ каталитической активности CYP3А4 и CYP3А4 в составе бактосом по отношению к субстрату диклофенаку. Для анализа процесса гидроксилирования диклофенака был использован подход, основанный на регистрации уменьшения концентрации субстрата в ходе каталитической реакции [30]. Значение каталитической константы (kcat) для фермента в составе бактосом, иммобилизованных на электроде, было примерно в 3.5 раза выше (17.59±2.73 мин-1), чем для иммобилизованного рекомбинантного фермента (4.98±0.48 мин-1). 2. ЭЛЕКТРОХИМИЧЕСКИЙ АНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA L-аспарагиназы (амидогидролазы) – это ферменты, которые катализируют реакцию гидролиза L-аспарагина (L-Asn) с образованием L-аспарагиновой кислоты (L-Asp) и аммиака. Истощение пула аспарагина приводит к ингибированию биосинтеза белка и апоптозу лимфобластных клеток, которым требуется Asn из внешних источников [46]. L-аспарагиназы используются при лечении острого лимфобластного лейкоза. [47]. L-аспарагиназы могут быть использованы не только в терапии лейкемии, но и при лечении других типов опухолей [48]. Электрохимический анализ L-аспарагиназы Erwinia carotovora был проведён при иммобилизации фермента на поверхности электрода, модифицированного ОУНТ [49]. При взаимодействии с субстратом L-аспарагином регистрируется снижение максимальной амплитуды тока электрохимического окисления аминокислотных остатков, входящих в активный центр фермента при потенциале 0.593±0.007 В (отн. Ag/AgCl). Tyr29 является важнейшей аминокислотой в активном центре бактериальных L-аспарагиназ, участвует в связывании субстрата и высвобождении продукта реакции [47]. Концентрационно-зависимое снижение амплитуды тока, соответствующего электрохимическому окислению аминокислот фермента при взаимодействии с L-аспарагином, позволило рассчитать электрохимическую константу Михаэлиса КМ как 600±70 мкМ [49]. В аналогичных условиях в присутствии глицина не было зарегистрировано снижение амплитуды тока, соответствующей электроокислению аспарагиназы, что подтверждает специфичность разработанного метода анализа каталитической активности L-аспарагиназы E. carotovora. 3. ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ ДЛЯ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПРОТЕАЗ, ОСНОВАННЫЕ НА ЭЛЕКТРООКИСЛЕНИИ ОСТАТКОВ АМИНОКИСЛОТ МОДЕЛЬНЫХ ПЕПТИДОВ Изучение протеаз является актуальным направлением в медицине и биотехнологии. Протеазы участвуют во многих физиологических процессах в организме человека в норме, а также в развитии различных патологических состояний, таких как онкологические, сердечно-сосудистые, нейродегенативные, воспалительные заболевания [50, 51]. В связи с этим данная группа ферментов рассматривается в качестве фармакологических мишеней, диагностических маркеров или лекарственных препаратов [50-52]. Бактериальные и вирусные протеазы являются мишенями для разрабатываемых антибиотиков и противовирусных препаратов, позволяющих избежать резистентности к препаратам при терапии бактериальных и вирусных инфекций [52-54]. В связи с функциональной значимостью протеаз разработано большое количество систем для определения их активности, основанных на оптических, иммунологических, калориметрических, масс-спектрометрических и электрохимических методах [55]. Ряд аминокислот (тирозин, триптофан, цистеин, гистидин, метионин) может подвергаться необратимому электрохимическому окислению, регистрируемому электрохимическими методами [56-60]. Введение остатков электроактивных аминокислот в состав пептидного субстрата может быть использовано для определения протеазной активности. На основе предложенного подхода разработана электрохимическая система для определения протеазной активности трипсина, основанная на регистрации снижения площади пика электроокисления остатка тирозина вследствие протеазного расщепления модельных пептидов, иммобилизованных на поверхности печатных графитовых электродов, модифицированных наночастицами золота (ПГЭ/AuНЧ) [61]. Принцип работы предложенной электрохимической системы представлен на рисунке 5.
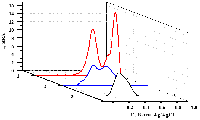
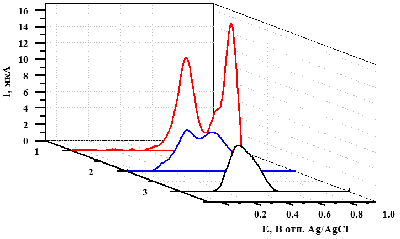
Аминокислотная последовательность пептида CGGGRYR содержала N-концевой остаток цистеина для иммобилизации на поверхности ПГЭ за счёт образования стабильной химической связи с AuНЧ, три остатка глицина, выполняющие роль спейсера, сайт специфического расщепления трипсином, представленный остатком аргинина, а также остаток тирозина, необходимый для регистрации активности трипсина. После инкубации пептида CGGGRYR в присутствии различных концентраций трипсина наблюдалось зависимое от времени расщепление модельного пептида с образованием связанного с ПГЭ/AuНЧ пентапептида (CGGGR) и свободного дипептида (YR), что регистрировалось по снижению значения площади пика электрохимического окисления остатка тирозина методом циклической вольтамперометрии. Из экспериментальных данных были получены параметры стационарной кинетики трипсина по отношению к пептиду CGGGRYR – kcat, KM и эффективность катализа (kcat/KM), которые были рассчитаны как 0.33±0.01 мин-1, 198±24 нМ и 0.0016 мин-1/нМ соответственно. При этом значения kcat и KM оказались сопоставимы с таковыми, полученными с помощью других электрохимических систем [62, 63]. Значение предела определяемых концентраций для трипсина было определено как 22 нМ. Предложенный нами подход является универсальным и может быть использован для изучения свойств других протеаз. 4. ЭЛЕКТРОАНАЛИЗ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ β-ЛАКТАМАЗЫ СТХ-М-116 Анализ каталитической активности β-лактамаз необходим для поиска новых антибиотиков – субстратов этого фермента, а также для поиска новых ингибиторов данных ферментов для подавления антибиотикорезистентности бактериальных патогенов и повышения эффективности существующих β-лактамных антибиотиков [64]. Предложен новый подход, основанный на использовании электродов, модифицированных углеродными наноматериалами, для определения ферментативной активности и скрининга ингибиторов сериновых β-лактамаз – ферментов, ответственных за развитие антибиотикорезистентности патогенных бактерий к бета-лактамным антибиотикам. Антибиотик цефалоспоринового ряда цефотаксим эффективно регистрируется при потенциале 0.596÷0.625 В (отн. Ag/AgCl). Это позволяет определять изменение его концентрации в растворе в результате гидролиза, катализируемого сериновой β-лактамазой. С помощью анализа электрохимических характеристик реакции окисления цефотаксима определены кинетические параметры его гидролиза, катализируемого сериновой β-лактамазой СТХ-М-116, относящейся к β-лактамазам расширенного спектра (БЛРС). KM составила 50 мкМ, максимальная скорость каталитической реакции 1.67´10-6 M/мин. При ингибировании β-лактамазы сульбактамом (IC50 = 2.5 мкМ) каталитическая реакция гидролиза цефотаксима не регистрируется. Предложенный подход перспективен для скрининга новых субстратов и ингибиторов β-лактамаз. 5.МЕТОДЫ ЭЛЕКТРОАНАЛИЗА АКТИВНОСТИ РЕСТРИКТАЗ И НУКЛЕАЗ/em> Нуклеазы – ферменты класса гидролаз, способные расщеплять ДНК на моно- или олигонуклеотидные фрагменты. Расщепление ДНК эндонуклеазами или экзонуклеазами играет фундаментальную роль в репликации, рекомбинации, репарации ДНК, молекулярном клонировании и генотипировании [65-67]. Эндонуклеазы рестрикции (рестриктазы) способны находить участки ДНК, в которых может быть локализована мутация, и расщеплять их. По количеству и длине фрагментов ДНК, полученных после действия рестриктаз, можно судить о наличии или отсутствии мутаций в исследуемом гене. Поэтому разработка новых высокочувствительных методов оценки активности ферментов рестрикции является первостепенной задачей. Традиционные методы, такие как гель-электрофорез, радиоактивное мечение, высокоэффективная жидкостная хроматография и иммуноферментный анализ (ИФА), используются для определения активности нуклеаз, но имеют ряд ограничений (необходимость применения дополнительных реагентов, введение радиоактивной метки). Потенциометрический метод измерения активности нуклеаз и окислительного повреждения ДНК в гомогенном растворе основан на взаимодействии ДНК как полианиона с модифицированным поликатионом протамином мембранного электрода. Пределы обнаружения составили 2.7×10-4 Ед/мкл для нуклеазы S1 и 3.9×10-4 Ед/мкл для ДНКазы I [67]. Однако потенциометрический метод не позволяет зарегистрировать основания ДНК и сделать вывод о специфике взаимодействия. Нами был разработан электрохимический метод оценки активности эндонуклеаз и фрагментации ДНК с использованием электродов, модифицированных углеродными нанотрубками [68]. Сравнительный анализ электрохимических профилей кольцевой плазмиды pTagGFP2-N в её нативном сверхспиральном состоянии и плазмид, расщепленных специфическими и неспецифическими эндонуклеазами рестрикции на 4 части и на низкомолекулярные фрагменты длиной 3-70 пар нуклеотидов, выявил существенные различия в их электрохимическом поведении. Были использованы неспецифическая эндонуклеаза I SE-E323 и рестриктазы BstMC I (SE-E071), AluB I (SE-E549). При использовании метода дифференциально-импульсной вольтампрометрии показано, что с увеличением степени фрагментации ДНК увеличивается количество регистрируемых пиков, соответствующих электроокислению гетероциклических оснований, и растет интенсивность максимальной амплитуды тока сигналов электроокисления (рис. 6).
В случае кольцевой плазмидной ДНК гетероциклические основания были встроены в более компактную кольцевую структуру и в меньшей степени соприкасались с поверхностью электрода, поэтому наблюдался один широкий пик при 0.50±0.01 В (отн. Ag/AgCl) по сравнению с ДНК, фрагментированной на 4 части. Электрохимический профиль фрагментированной на 4 части ДНК имел два пика при потенциалах 0.50±0.01 В (отн. Ag/AgCl) и 0.70±0.01 В (отн. Ag/AgCl) соответственно. Профиль расщеплённой неспецифической эндонуклеазой ДНК также содержал два смещённых по потенциалам пика электроокисления при 0.50±0.01 В (отн. Ag/AgCl) и 0.70±0.01 В (отн. Ag/AgCl) гетероциклических оснований с большей интенсивностью максимальной амплитуды токов. При частичной или полной фрагментации или деградации ДНК, индуцированной специфическими и неспецифическими эндонуклеазами рестрикции, возрастает количество олигонуклеотидных фрагментов. Это приводит к возрастанию как интенсивности сигналов, так и количеству пиков, соответствующих регистрируемым гетероциклическим основаниям за счёт повышения доступности повреждённой ДНК для электронов, что косвенно отражает активность ферментов рестрикции. Разработанный подход эффективен для высокопроизводительного скрининга ДНК-гидролаз и для регистрации эффективности процессов целевой фрагментации ДНК с чувствительностью до 10 нг/мкл. Были проанализированы образцы ДНК, выделенной из клеток линии K562 на ранних и поздних стадиях апоптоза. Результаты анализа показали, что на более поздних стадиях апоптоза возрастает интенсивность сигналов ДНК, свидетельствующая о процессе фрагментации как маркера клеточной гибели. Использование фрагментации ДНК в качестве маркера программируемой клеточной гибели позволяет регистрировать ранний и поздний апоптоз в клетках млекопитающих. ЗАКЛЮЧЕНИЕ Арсенал методов регистрации каталитической активности ферментов весьма широк. Однако в связи с функциональной активностью ферментов как биокатализаторов, терапевтических средств заместительной терапии, диагностических компонентов и маркеров заболеваний, разрабатываются новые более чувствительные и более технологичные методы анализа биомолекул с каталитической активностью и имеющих медицинскую значимость, таких как цитохромы Р450, трипсин, аспарагиназа, бета-лактамаза, рестриктазы, неспецифические нуклеазы. Электрохимические методы для регистрации каталитической активности отвечают современным требованиям анализа, таким как высокая чувствительность, экспрессность, а также возможность прямой регистрации биохимического события (собственно каталитической реакции). Разработанные методы не требуют дополнительных реагентов или субстратов, меченных флуоресцентными или радиоактивными метками, а также использования электроактивных электролитов и медиаторов электронного транспорта (например, феррицианид калия, ферроценкарбоновая кислота, координационные соединения кобальта), которые могут повлиять на каталитическую активность биокатализатора. Разработаны две электрохимические платформы, позволяющие количественно измерять каталитическую активность на основе электрохимических свойств фермента (цитохромы Р450, бактосомы, аспарагиназа) или субстрата (трипсин, нуклеазы, рестриктазы, бета-лактамаза). Для ферментов, имеющих в составе простетическую электроактивную группу (гемопротеины цитохромы Р450) анализ основан на регистрации именно изменений электрохимических параметров гема при взаимодействии с субстратами. Если фермент не содержит электроактивную простетическую группу, метод регистрации основан на способности аминокислот полипептидной цепи электрохимически окисляться при положительных значениях потенциалов. В случае электроактивных субстратов или продуктов реакций (пептиды, лекарственные препараты) регистрации активности фермента возможна за счёт количественного определения убыли субстрата или прироста продукта под воздействием биокатализатора. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит описания выполненных авторами исследований с участием людей или использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период 2021-2030 годы (№122030100168-2). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|