|
Конъюгаты L-аспарагиназы Rhodospirillum Rubrum с полимерами различной структуры с улучшенными биокаталитическими свойствами 1Московский государственный университет им. М.В. Ломоносова, Ключевые слова: L-аспарагиназа, Rhodospirillum rubrum, ковалентные конъюгаты, КД спектрометрия, ИК спектрометрия, полимеры DOI: 10.18097/BMCRM00229 ВВЕДЕНИЕ В настоящее время в химиотерапии лейкозов используют препараты L-аспарагиназы из Esherichia coli (EcA) и её ПЭГилированной формы, а также Erwinia chrysanthemi (ErA) [1–3]. Основной механизм действия ферментов связан с их способностью гидролизовать L-аспарагин, что приводит к снижению его концентрации в кровотоке. Опухолевые клетки более чувствительны к недостатку L-аспарагина, чем здоровые клетки, и при снижении концентрации данной аминокислоты опухолевая клетка гибнет. Основной проблемой использования L-аспарагиназ в химиотерапии является гиперчувствительность, которая развивается у пациентов, получающих EcA или ErA. В связи с упомянутыми проблемами актуален поиск новых источников L-аспарагиназ с более подходящими свойствами. Один из перспективных ферментов – L-аспарагиназа из бактерии Rhodospirillum rubrum (RrA). Данный фермент имеет низкую гомологию с EcA и ErA и более короткую аминокислотную последовательность (172 аминокислотных остатка, 18 кДа), что делает его потенциально менее иммуногенным. RrA имеет выраженную противоопухолевую активность на ряде клеточных линий лейкозных клеток in vitro, а также in vivo [4]. Важным преимуществом является также то, что она обладает меньшей L-глутаминазной активностью, которая составляет менее 0.1% от L-аспарагиназной активности. Недостатком RrA являются сдвинутый в щелочную область рН оптимум и высокая константа Михаэлиса (KM). Из-за этого активность L-аспарагиназы в физиологических условиях может снижаться. Для оптимизации функциональных свойств RrA в настоящей работе предложено исследовать влияние полиэлектролитов природного и синтетического происхождения, а именно хитозана и полиэтиленимина, на каталитические характеристики. МЕТОДИКА Синтез конъюгатов L-аспарагиназы с сополимерами на основе хитозана Синтез конъюгатов L-аспарагиназы с сополимерами хитозан-гликоль, хитозан-ПЭГ осуществляли по реакции восстановительного аминирования с аминогруппами фермента [5]. Сополимер хитозана с активированным ПЭГ был синтезирован по методике, разработанной ранее в нашей лаборатории [6, 7]. Для осуществления реакции к 4 мг/мл раствора RrA в 10 мМ буфере PBS pH 7.5 («Эко-Сервис», РФ) добавляли растворы вышеперечисленных полимеров в мольном отношении фермент:полимер от 1:3 до 1:5. Полученные смеси инкубировали при постоянном перемешивании в течение 40 мин при 16°С. Затем к растворам добавляли пятикратный избыток цианборгидрида натрия и инкубировали ещё 40 мин при той же температуре. Чтобы очистить полученные продукты от непрореагировавшего сополимера использовали диафильтрацию на фильтрах Amicon («Merck-Millipore», США) с пропускной способностью частиц менее 50 кДа. Синтез конъюгатов L-аспарагиназы с полиэтиленимином Для синтеза брали линейный полиэтиленимин 2 кДа (ПЭИ, «Sigma-Aldrich», США). В ходе реакции происходило образование амидных связей между аминогруппами полиаминов и карбоксильных групп фермента в присутствии реактива Вудварда K («Sigma-Aldrich»). Препарат RrA растворяли в 100 мМ фосфатном буфере рН 6.0 до конечной концентрации фермента 5 мг/мл. Полиамин также растворяли в фосфатном буфере до мольных соотношений фермент:полиамин = 1:10. При необходимости pH растворов полиаминов доводили до pH 6. Затем к ферменту в фосфатном буфере добавляли раствор полиамина (ПЭИ). К конечной смеси с концентрацией фермента 1 мг/мл добавляли 10 мкл 5 мг/мл раствора реактива Вудварда. Итоговую смесь инкубировали при комнатной температуре при перемешивании в течение 2-3 ч. Полученные растворы конъюгатов очищали на фильтрах Amicon («Merck-Millipore») с пропускной способностью частиц 3-50 кДа с заменой фосфатного буфера на 10 мМ PBS pH 7.5. Полученные конъюгаты лиофилизировали и хранили при -20°С. Регистрация спектров кругового дихроизма КД спектры растворов L-аспарагиназы, а также очищенные растворы конъюгатов регистрировали с помощью КД-спектрометра J-815 («Jasco», Япония), оснащённого термостатируемой ячейкой. Измерения проводили в диапазоне длин волн 200-260 нм при температуре 37°С в кварцевой кювете с длиной оптического пути l = 1 мм. Спектры получали 3-кратным сканированием с шагом 1 нм. В кювету добавляли 300 мкл образцов фермента и конъюгатов в 10 мМ PBS рН 7.5. Конечная концентрация белка в системе составляла 0.5-1 мг/мл. Регистрация и анализ инфракрасных спектров ИК спектры L-аспарагиназы и её конъюгатов получали методом ИК-спектроскопии на ИК-спектрометре Фурье Tensor 27 («Bruker» Германия), оснащённом MCT-детектором, охлаждаемым жидким азотом, а также с использованием ИК-Фурье микроскопа MICRAN-3 («Симекс», Россия). Измерения проводили в термостатируемой ячейке нарушенного полного внутреннего отражения (НПВО) BioATR-II, с ZnSe-кристаллом («Bruker»). В типичном эксперименте в ячейку НПВО ИК спектрометра помещали 35 мкл раствора образца в 0.01 М натрий-фосфатном буфере с концентрацией 0.5-1.5 мг/мл. Спектры измеряли при 22 °С в интервале частот 4000-950 cм-1 со спектральным разрешением 2 cм-1. Для каждого спектра производили 100-кратное сканирование и усреднение. Регистрацию фона проводили в аналогичных условиях. Результирующие спектры по необходимости спрямляли методом Савицкого-Голлая до спектрального разрешения 4 cм-1. Анализ спектров проводили с помощью программы Opus 7.0. Определение дзета-потенциалов препаратов L-аспарагиназы Определение дзета-потенциалов препаратов L-аспарагиназы проводили с помощью прибора Zetasizer Nano ZS («Malvern Panalytical», Великобритания) в очищенных водных растворах Milli-Q, содержащих 1 мг/мл белка. Измерения проводили в полипропиленовой кювете при комнатной температуре. Для получения каждого значения дзета-потенциала выполняли от 10 до 15 сканирований и усредняли данные. Определение каталитических параметров препаратов L-аспарагиназы Каталитическую активность нативной L-аспарагиназы, её ковалентных конъюгатов измеряли с помощью КД-спектрометра Jasco J-815 по методике, разработанной ранее [7]. В эксперименте смешивали растворы L-аспарагина и фермента в 10 мМ PBS до конечных концентраций 20 мМ и 0.03-0.035 мг/мл соответственно. Регистрировали изменение эллиптичности на длине волны 210 нм во времени. Реакцию проводили в кварцевой кювете объёмом 300 мкл с длиной оптического пути l = 1 мм в термостатируемой ячейке при 37°С. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Для оптимизации каталитических параметров RrA в работе было изучено влияние на фермент полиэлектролитов различной природы (табл. 1).
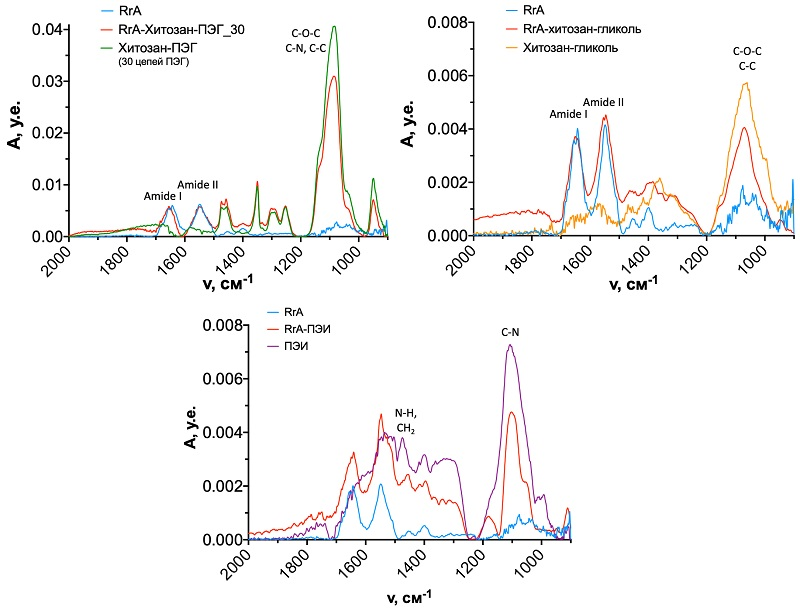
Влияние модификации на структуру фермента и состав полученных конъюгатов после очистки оценивали с помощью ИК и КД спектрометрии. На рисунке 1 показаны ИК спектры очищенных растворов конъюгатов RrA-хитозан-ПЭГ, RrA-хитозан-гликоль, RrA-ПЭИ. На спектрах как нативного фермента, так и ковалентных конъюгатов чётко видны характеристические пики амида I (вал. C=O) на 1600-1700 см-1 и амида II (деф. N-H) на 1500-1600 см-1, соответствующие поглощению амидных связей в белках. У первых двух конъюгатов с хитозан-ПЭГ и хитозан-гликолем и у свободных полимеров был отмечен пик в районе 1000-1150 см-1, соответствующий колебаниям C-O-C связей в пиранозном цикле хитозана [8]. У конъюгатов с полиэтиленимином имеются полосы поглощения на 1460 см-1 (колебания N-H вторичных аминогрупп и CH2 связей). У RrA-ПЭИ имеется интенсивная широкая полоса при 1050-1150 см-1, соответствующая колебаниям C-N связей в молекуле полиамина (вал. C-N). Кроме того, некоторый вклад в интенсивность пика амид I может вносить полоса на 1620 см-1, соответствующая колебаниям N-H связей аминов. Также можно выделить и в полимере, и в конъюгате полосу при 1450-1640 см-1 (N-H, CH2). Исходя из полученных ИК спектров можно предположить, что модификация RrA с использованием двух методов модификации для всех образцов прошла успешно.
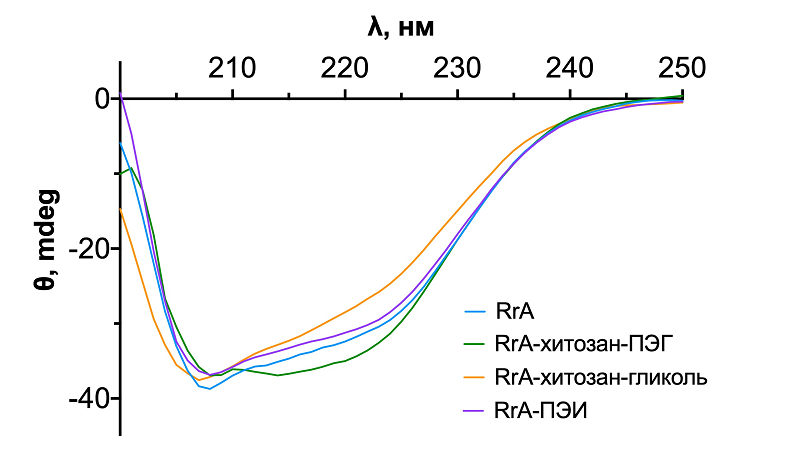
С помощью КД спектрометрии полученные конъюгаты были проанализированы на содержание вторичных структур в сравнении с нативным ферментом. На рисунке 2 представлены КД спектры нативного фермента и конъюгатов. Из рисунка 2 видно, что форма спектра, характерная для нативного фермента, сохраняется и для всех конъюгатов. Содержание вторичных структур практически не меняется. Можно заметить, что у конъюгатов немного снижается содержание α-спиралей и увеличивается процент неупорядоченных структур (табл. 2). Увеличивается также процент антипараллельных b-структур, которые отвечают за агрегацию [9]. Наиболее сильные изменения были отмечены для RrA-ПЭИ: количество a-спиралей снижалось на 6% в сравнении с нативным ферментом.
Чтобы охарактеризовать полученные конъюгаты и найти корреляции между поверхностным зарядом и активностью фермента измерили заряд поверхности частиц и каталитические параметры (табл. 3). Удельная активность у всех конъюгатов была выше, по сравнению с нативным ферментом. Сродство к субстрату (KM) оставалось практически неизменным для всех конъюгатов. Для RrA-ПЭИ KM снижалась в 1.5 раза, что может быть связано с небольшим размером поликатиона (2 кДа), который не препятствует связыванию субстрата. Наибольшая удельная активность наблюдалась для конъюгата RrA-хитозан-ПЭГ (прирост на 35% в сравнении с нативной RrA), имеющего значения дзета-потенциала -5.7. Наименьший прирост активности обнаружен для RrA-хитозан-гликоль (на 13%) и RrA-ПЭИ (на 6%). В целом, для всех конъюгатов было выявлено увеличение величины дзета-потенциалов за счёт аминогрупп в хитозане или ПЭИ. При этом в ПЭГ-хитозане часть аминогрупп прореагировала с ПЭГ и не вносила вклад в положительный заряд. Также цепи ПЭГ могут экранировать часть свободных аминогрупп. Это может способствовать тому, что молекула L-аспарагина свободно диффундирует к активному центру фермента. Также положительный заряд может влиять на локальный pH вблизи активного центра, сдвигая его pH оптимум в сторону более кислых значений и увеличивая тем самым активность фермента [5]. Положительный заряд аминогрупп может способствовать более длительному удержанию продукта в микроокружении фермента и снижать скорость катализа. Так, вероятно, могло происходить с RrA-ПЭИ. Кроме того, исходя из результатов КД спектрометрии, ПЭИ может дестабилизировать структуру фермента и влиять тем самым на его активность.
В данном случае стоит учитывать не только заряд частиц, но также и структуру поликатионов. Вероятно, ПЭГ за счёт экранирования сильно положительных зарядов аминов оказывает более мягкое воздействие на фермент и способствует большему увеличению его активности. В ранней нашей работе с EwA и её конъюгатами с хитозан-ПЭГ разной молекулярной массы было также показано, что с помощью ПЭГ можно регулировать физико-химические свойства фермента [10]. ПЭГилирование хитозана увеличивало активность в 3-4 раза. Хотя в случае RrA мы не наблюдаем такого сильного изменения активности, тем не менее полученные результаты позволяют подтвердить эффективность применения ПЭГилированных поликатионов. Кроме того, данная модификация практически не нарушала структуру фермента и не снижала его активность, что наблюдалось, например в случае ПЭГилирования L-аспарагиназ [11, 12]. ЗАКЛЮЧЕНИЕ Было оценено влияние поликатионов различной природы на L-аспарагиназу R. rubrum, которая может стать новым альтернативным противоопухолевым препаратом. Методами ИК и КД спектроскопии подтвердили прошедшую модификацию RrA, а также оценили влияние поликатионов на вторичную структуру фермента. Все конъюгаты отличались от нативного фермента повышенной активностью и неизменным сродством к L-аспарагину. Данные результаты показывают перспективность применения поликатионов различной природы для модификации RrA и улучшения её биокаталитических свойств. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Настоящая статья не содержит описания каких-либо исследований с участием людей или использованием животных в качестве объектов. БЛАГОДАРНОСТИ Работа выполнена с использованием оборудования программы развития МГУ им. М.В. Ломоносова (ИК-Фурье спектрометр Tensor 27, ИК-Фурье микроскоп MICRAN-3, спектрометр кругового дихроизма Jasco J-815). ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№ 122022800499-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|