|
Иммобилизация на окисленной бактериальной целлюлозе L-аспарагиназы для улучшения термостабильности фермента
1Научно-исследовательский институт биомедицинской химии им. В.Н. Ореховича, Ключевые слова: L-аспарагиназа; бактериальная целлюлоза; иммобилизация; термостабильность DOI: 10.18097/BMCRM00234 Принятые сокращения: L-ASNase – L-аспарагиназа; EwA – L-ASNase из Erwinia carotovora, БЦ – бактериальная целлюлоза, ОБЦ – окисленная бактериальная целлюлоза. ВВЕДЕНИЕ L-аспарагиназа (L-ASNase) – фермент класса гидролаз, применяемый для лечения острого лимфобластного лейкоза [1-3]. Фермент катализирует расщепление аспарагина с образованием аспарагиновой кислоты и аммиака. Поскольку лейкозные клетки не способны синтезировать аспарагин, истощение его пула в микрокружении приводит к активации апоптоза и клеточной гибели. Escherichia coli и Erwinia chrysanthemi – основные продуценты L-ASNase, которые используют в настоящее время в клинической практике. Как и большинство терапевтических ферментов, L-ASNase имеют короткий период полужизни и они иммуногенны. Их применение вызывает гиперчувствительность и нейротоксичность [4]. Одним из способов решения перечисленных ограничений является повышение стабильности фермента, отражением которой является термостабильность. Повышение термостабильности способствует увеличению времени циркуляции L-ASNase в организме и минимизирует побочные эффекты за счёт снижения терапевтической дозы. Также термостабильность обеспечивает стабильность при длительном хранении [5]. Ранее была установлена корреляция между термодинамической стабильностью L-ASNase из Erwinia carotovora (EwA) и её цитотоксичностью [6]. Улучшение термостабильности имеет решающее значение для применения L-ASNase при предварительной обработке пищевых продуктов [7] для снижения количества акриламида [8]. Для улучшения термостабильности L-ASNase в основном используют генно-инженерные подходы. C помощью гетерологичной экспрессии и рационального дизайна была улучшена термостабильность L-ASNase из Rhizomucor miehei и Acinetobacter soli [9]. Полученные L-ASNase обладали улучшенной стабильностью, периодом полужизни, пониженной иммуногенностью, противораковой активностью in vitro и in vivo. Также с помощью генной инженерии была улучшена термостабильность L-ASNase из E. carotovora, E. chrysanthemi [10] и Bacillus licheniformis [11]. Несмотря на то, что есть множество примеров ферментов, которые были стабилизированы при помощи введения одной или двух мутаций [12], до сих пор не существует универсальной стратегии стабилизации «любого» белка путём ограниченного количества рационально спроектированных мутаций [10]. Другим подходом для увеличения стабильности L-ASNase является иммобилизация, например, конъюгация с полиэтиленгликолем (ПЭГ) [13, 14]. Ранее в экспериментах по денатурации EwA было показано, что этот фермент в свободной форме имеет пониженную термодинамическую стабильность и быстро инактивируется в присутствии мочевины [6], поэтому имеет ограниченный потенциал в качестве противолейкозного препарата. Для улучшения стабильности EwA была конъюгирована с полиэтиленгликолем [15]. В данной работе мы предложили подход для увеличения стабильности фермента EwA путём его иммобилизации на плёнки окисленной бактериальной целлюлозы (ОБЦ). МЕТОДИКА Получение мембран БЦ Штамм Komagataeibacter hansenii (ВКПМ № В-11239) культивировали методом статической ферментации для получения БЦ. Для культивирования использовали среду Хестрина-Шрамма следующего состава: 10 г/л глюкозы («Sigma», США), 5 г/л пептона («Диаэм», Россия), 5 г/л дрожжевого экстракта («PanReac Applichem», Испания), 1.15 г/л лимонной кислоты («Merck Millipore», Германия) и 2.7 г/л Na2PO4 («PanReac Applichem», Испания), pH 4.5. Культуральную среду разливали по 200 мл в 1 л колбы и автоклавировали в течение 20 мин при 120°C. Для получения БЦ к среде добавляли 1 мл 99% этилового спирта и 20 мл среды с K. hansenii (в логарифмической стадии роста), разливали в 24-луночные культуральные стерильные планшеты («Wuxi NEST Biotechnology», Китай) по 2.5 мл и помещали в инкубатор (26°C). Мембраны БЦ снимали через 4 дня и обрабатывали для удаления остатков бактерий и среды с помощью 0.1 M NaCl («Диаэм») и 1% додецилсульфата натрия («Merck Millipore»). Реакция окисления мембран БЦ Для реакции окисления мембран БЦ с помощью NaIO4 была использована и модифицирована методика, описанная ранее Vasconcelos и соавт. [16]. Очищенные влажные мембраны БЦ погружали в раствор KCl/HCl (250 мл 0.2 моль/л раствора KCl и 670 мл 0.2 моль/л раствора HCl) при 25°C на 24 ч. Затем образцы БЦ погружали в 200 мл 1% (мас./об.) NaIO4 («Кемстор», Россия), растворённого в KCl/HCl. Реакция окисления протекала в отсутствие света при орбитальном перемешивании (100 об/мин) в течение 5 ч при 50°С. После этого в реакционную смесь добавляли 12 мл этиленгликоля («Экос-1», Россия) для нейтрализации избытка NaIO4 и инкубировали в течение 1 ч при 22°С при орбитальном перемешивании. Затем ОБЦ несколько раз промывали деионизированной водой. Физическая характеристика плёнок Для мембран БЦ измеряли массу, толщину и содержание воды. Массу определяли путём взвешивания пяти мембран ОБЦ или БЦ на аналитических весах при 25°C. Содержание воды и адсорбцию (%) определяли с помощью стандартных методик, описанных Wu и соавт. [17]. Иммобилизация EwA на ОБЦ Раствор EwA (595 МЕ/мг, молекулярная масса 37 кДа, получена в лаборатории медицинской биотехнологии ИБМХ) готовили в 0.05 M буфере HEPES (рН 8.0). Влажные мембраны ОБЦ помещали в 24-луночный планшет, добавляли к ним разведённый в 0.05 М HEPES 1 мл раствора EwA в концентрации 0.05 мг/мл (28 МЕ/мл) и инкубировали при 4°С в течение 12 ч. После иммобилизации EwA мембраны трижды промывали HEPES для удаления несвязанной EwA. Инфракрасная спектроскопия ИК-спектры были записаны для БЦ, ОБЦ и ОБЦ+EwA с использованием ИК-Фурье-микроскопа МИКРАН-3 («Симекс», Россия). Спектральное разрешение составляло 4 см-1, в режиме 40 сканов в спектральном диапазоне 4000–1000 см–1 в режиме поглощения. Определение термостабильности EwA, иммобилизованной на ОБЦ Термодинамическую стабильность фермента, иммобилизованного на БЦ, определяли по изменению активности EwA при инкубации в присутствии L-аспарагина. Плёнку ОБЦ инкубировали в 50 мл 0.05 М HEPES буфере в диапазоне температур 45-60°С в течение 1-3 ч. Каждые 10 мин отбирали 100 мкл пробы для определения концентрации ионов аммония методом прямой несслеризации [18]. За единицу активности фермента принимали количество фермента, которое катализирует высвобождение 1 мкмоль аммиака за 1 мин при 37°С. Данные активности представляли как процент от максимальной активности свободного фермента. Статистика Измерения проводили в четырёх независимых повторах. Для количественных данных рассчитывали среднее значение и стандартное отклонение с использованием программного обеспечения MS Office Excel 2016. Значения считали статистически достоверными при p≤0,05. РЕЗУЛЬТАТЫ Физико-химические характеристики ОБЦ Нами было выявлено, что в результате окисления БЦ изменяются её основные физико-химические характеристики. Плёнки ОБЦ обладали меньшей массой, диаметром и адсорбционной ёмкостью, чем плёнки БЦ (табл. 1). Потеря массы БЦ после окисления составила 23%.
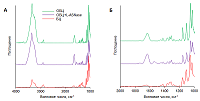
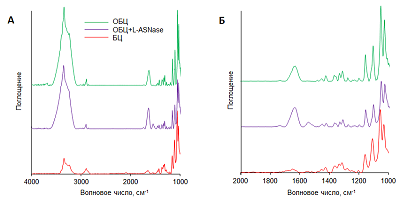
Определение химического состава ОБЦ Для всех образцов на ИК-спектрах были характерны пики (рис. 1), соответствующие химической структуре целлюлозы: валентное колебание –OH (3325 см-1) и симметричное изгибание (1336 см-1); алифатические валентные колебания CH (2874 см-1); деформационные колебания CH (1635 см-1, 1419 см-1, 1356 см-1); асимметричное растяжение гликозидной связи C–O–C (1155 см-1) и растяжение связи C–O (1055 см-1). В результате окисления БЦ выявлен новый пик при 1646 см-1, соответствующий симметричному растяжению связи C=O, отнесенной к альдегидной группе, которая образуется в результате окислением целлюлозы NaIO4. Включение EwA в мембрану ОБЦ приводило к появлению в ИК-спектре характерного пика при 1556 см-1, что соответствует растяжению связи C-N, который относится к аминной группе. Увеличение интенсивности полосы 1646 см-1, наложенной на карбонильную группу (C=O), связано с симметричным растяжением связи C=N, которое характерно для образования иминной группы. Наличие этой полосы указывает на образование ковалентной связи ОБЦ с EwA.
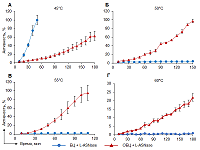
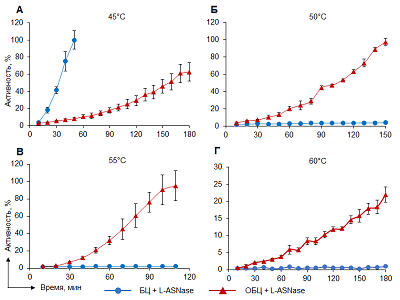
Термостабильность L-ASNase EwA при иммобилизации на ОБЦ Известно, что L-ASNase EwA проявляет максимальную активность при 45°С [3, 15]. При данной температуре для свободного фермента отмечена максимально возможная активность через 50 мин инкубации (рис. 2А). Активность фермента, ковалентно иммобилизованного на ОБЦ, была существенно ниже и при данной температуре достигла 62.6±10.6% от максимальной через 180 мин инкубации. Увеличение температуры до 50°С вызывало полную инактивации свободного фермента (рис. 2Б), в то время как активность L-ASNase, иммобилизованной на ОБЦ, существенно увеличивалась и достигала максимального уровня через 150 мин инкубации. Фермент, иммобилизованный на ОБЦ, сохранял активность и при увеличении температуры до 55°С (рис. 2В). Более того, его активность увеличилась до максимального уровня уже через 100 мин инкубации. Однако увеличение температуры до 60°С приводило к понижению активности фермента (рис. 2Г) и через 180 мин инкубации активность достигла лишь 21.8±2.5%. Таким образом, L-ASNase EwA, ковалентно иммобилизованная на ОБЦ, обладала более широким оптимумом температур по сравнению с нативным ферментом. Иммобилизация на ОБЦ позволила сохранить активность фермента при повышении температуры на 15°С от температурного оптимума для данного фермента.
ОБСУЖДЕНИЕ Большинство ферментов с терапевтическим потенциалом не обладают в нативной форме оптимальными фармакологическими свойствами, так как имеют низкую стабильность в условиях организма. Одним из перспективных носителей для иммобилизации ферментов является БЦ. БЦ имеет высокую пористость, площадь поверхности и большое количество гидроксильных групп – свойства, благоприятствующие её химической модификации [16]. Ковалентное связывание с целлюлозными носителями повышает активность и/или термическую стабильность иммобилизованного фермента [20]. Ранее было показано, что иммобилизация липазы [21], лецитазы [22] и лакказы [23] на окисленную NaIO4 БЦ приводила к увеличению стабильности ферментов, что и предопределило выбор данного способа модификации БЦ. Ионы перйодата (IO4-) избирательно окисляют вторичные гидроксильные группы в целлюлозе за счёт разрыва связи С2-С3 в глюкопиранозидном кольце. В результате этого в молекуле глюкозы образуются две альдегидные группы [24], а морфология исходного целлюлозного материала сохраняется. Альдегидные группы пригодны для введения различных групп-заместителей, таких как карбоновые кислоты, гидроксильные группы или имины [25]. В окисленной целлюлозе альдегидные группы (–HC=O) образуют иминную связь со свободными аминогруппами белков (–C=NR), которая затем перегруппировывается с образованием стабильного амина (–C–NHR) [26]. Кроме того, процесс окисления снижает плотность отрицательного заряда, увеличивая возможность межмолекулярных взаимодействий с ферментами [25]. Ранее было показано, что модификация остатков лизина, расположенных на поверхности, влияет на стабильность ферментов. Например, для стабилизации пероксидазы хрена использовали химические или генетические модификации трёх экспонированных на поверхности лизинов [27]. В мономере EwA из 20 аминокислотных остатков лизина 14 расположены на поверхности и доступны для разных модификаций [28]. Мы полагаем, что по аналогии с пероксидазой, при иммобилизации EwA на ОБЦ лизины связались с альдегидными группами окисленной целлюлозы. Это привело к стабилизации белка и повышению его термодинамических характеристик. Вероятно, это происходило из-за изменения конформации белка при иммобилизации, а также за счёт снижения активности молекул воды вблизи белковой макромолекулы [15]. Таким образом, ОБЦ можно рассматривать в качестве носителя для ферментов для повышения их стабильности. ЗАКЛЮЧЕНИЕ Произведена химическая модификация мембраны БЦ перйодатом натрия. Ковалентная иммобилизация терапевтической L-ASNase EwA на окисленную мембрану БЦ позволила увеличить термическую стабильность фермента на 15°С и повысить температуру инактивации до 60°С. Мембрана ОБЦ может служить потенциальным носителем для ковалентной иммобилизации ферментов с целью улучшения их фармакологических свойств за счёт увеличения термостабильности. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не содержит каких-либо исследований с участием людей или использованием животных в качестве объектов. ФИНАНСИРОВАНИЕ Работа выполнена в рамках Программы фундаментальных научных исследований в Российской Федерации на долгосрочный период (2021-2030 годы) (№ 122022800499-5). КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|