|
ДНК-ПОВРЕЖДАЮЩЕЕ ДЕЙСТВИЕ И ИНДУКЦИЯ АПОПТОЗА В КЛЕТКАХ КАРЦИНОМЫ ШЕЙКИ МАТКИ ПОД ВОЗДЕЙСТВИЕМ НОВЫХ ПРОИЗВОДНЫХ ФОСФОНИЕВЫХ СОЛЕЙ Институт органической и физической химии им. А.Е. Арбузова – обособленное структурное подразделение Федерального исследовательского центра «Казанский научный центр Российской академии наук», 420088 Казань, ул. Акад. Арбузова, 8; *e-mail: aplyubina@gmail.com Ключевые слова: фосфониевые соли; апоптоз; повреждение ДНК; клеточный цикл DOI: 10.18097/BMCRM00254 ВВЕДЕНИЕ Онкологические заболевания являются одной из самых серьезных проблем медицины как на глобальном, так и на национальном уровнях. Они характеризуются быстрым и неконтролируемым ростом и распространением аномальных клеток, которые могут поражать различные органы и ткани организма [1]. Согласно данным Всемирной организации здравоохранения (ВОЗ), в 2022 году было зарегистрировано около 20 миллионов новых случаев онкологических заболеваний и приблизительно 10 миллионов случаев смерти от рака по всему миру [2]. В России ситуация также требует серьезного внимания. По данным Федеральной службы государственной статистики, в 2021 году в стране было зарегистрировано более 580 тысяч новых случаев рака. Число умерших от злокачественных новообразований составило около 280 тысяч человек. Таким образом, онкологические заболевания занимают второе место среди всех причин смертности среди взрослого населения страны [3]. Многие современные методы лечения, такие как химиотерапия и лучевая терапия, направлены на уничтожение не только раковых, но и здоровых клеток, что приводит к значительным побочным эффектам и ухудшению качества жизни пациентов [4]. Кроме того, опухолевые клетки могут развивать резистентность к существующим химиотерапевтическим препаратам [5]. Поэтому на сегодняшний день продолжается поиск эффективных противораковых средств. Фосфониевые соли представляют собой многообещающий класс соединений с разнообразными биологическими свойствами, например, противоопухолевыми, антимикробными и противовирусными [6-8]. В данной работе рассматрены ранее синтезированные фосфониевые соли, которые продемонстрировали выраженные антимикробные свойства в отношении грамположительных бактерий [9]. Бактерицидное действие этих соединений обусловлено негативным влиянием на внутриклеточные процессы бактерий и увеличением проницаемости бактериальной мембраны [10]. Кроме того, данные фосфониевые соли обладают свойствами протонофоров, индуцирующих протон-селективные токи через липидный бислой мембраны и вызывающих разобщение митохондрий [11]. Целью данного исследования стали оценка цитотоксических свойств вышеупомянутых производных фосфониевых солей в отношении раковых клеточных линий и изучение их возможного механизма действия. МЕТОДИКА Исследован ряд ранее синтезированных производных фосфониевых солей: (Z)-(2-(2-Гидрокси-5-хлорфенил)-2-фенилэтенил)алкилдифенилфосфоний хлориды [9, 10]. Вещества отличались длиной алкильного радикала у атома фосфора. Клеточные линии Клеточные линии M-HeLa (эпителиоидная карцинома шейки матки. сублиния HeLa, клон М-HeLa 11), MCF-7 (аденокарцинома молочной железы), HuTu 80 (аденокарцинома двенадцатиперстной кишки), PANC-1 (карцинома поджелудочной железы), А549 (карцинома легкого), Т 98G (глиобластома), HepG2 (карцинома печени), RPMI 1788 (лейкоциты периферической крови здорового донора), HL-60 (периферическая кровь, промиелоцитарная лейкемия) были получены из Института Цитологии РАН (Россия). Клетки Chang liver (гепатоцитоподобные клетки) получены из Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамале́и (Россия). Клеточные линии SK-OV-3 (аденокарцинома яичника), A-375 (злокачественная меланома), DU-145 (карцинома предстательной железы) из клеточного репозитория CSL (Cell line service) (Германия). Клеточные линии M-HeLa, MCF-7, HuTu 80, PANC-1, А549, Т 98G, HepG2, Chang liver, Du-145 культивировали в стандартной среде Игла-МЕМ (“ПанЭко”, Россия) с добавлением 10% фетальной бычьей сыворотки и 1% растворa незаменимых аминокислот (“ПанЭко”). Клетки RPMI 1788, HL-60 выращивали на среде RPMI-1640 (“ПанЭко”) c добавлением 20% фетальной бычьей сыворотки. Клетки SK-OV-3 культивировали на среде ДМЕМ F12 (“ПанЭко”) с добавлением 5% фетальной бычьей сыворотки и 2 мМ L-глутамина. Клетки A-375 выращивали на среде ДМЕМ с глутамином (“ПанЭко”), с добавлением 1% незаменимых аминокислот и 10% фетальной бычьей сыворотки. Все клеточные культуры выращивали при температуре 37°С в атмосфере, содержащей 5% СО2. Цитотоксичность соединений in vitro Влияние фосфониевых солей на жизнеспособность клеток оценивали при помощи МТТ-реагента. Для этого клетки, которые инкубировали в течение 24 ч в присутствии исследуемых соединений, окрашивали раствором МТТ в конечной концентрации 0.5 мг/мл. Через 4 ч образовавшиеся кристаллы формазана растворяли в ДМСО. В качестве негативного контроля были использованы клетки, не подвергнутые воздействию соединений. В качестве препарата сравнения использовали Доксрубицин (“Sigma-Aldrich”, США). Расчет IС50 (концентрации полумаксимального ингибирования) производили с помощью онлайн-калькулятора: MLA - «Калькулятор Quest Graph ™ IC50» [12]. Индекс селективности (ИС) соединений определяли, как отношение их IC50 для нормальной клеточной линии к IC50 для опухолевых клеток. Индекс селективности рассчитывали относительно условно-нормальных клеток Chang liver и RPMI 1788. Проточная цитометрия Оценку уровня активных форм кислорода (АФК), апоптозиндуцирующего действия соединений, влияние веществ на мембранный потенциал митохондрий и анализ клеточного цикла проводили методом проточной цитометрии. Для этого клетки, которые в течение 24 ч подвергались воздействию тестируемых соединений, открепляли от дна планшетов и осаждали при 300 g в течение 5 мин, затем дважды промывали фосфатно-солевым буфером (ФСБ) (“ЭКОсервис”, Россия). Для проведения анализа клеточного цикла к осадку клеток добавляли 0.05 М фосфатно-цитратный буфер (рН 4.0; 7.7мл 0.2 М Na2HPO4; 12.3 мл 0.1 М лимонной кислоты), перемешивали, затем центрифугировали при 300 g в течение 5 мин, ресуспендировали и снова осаждали при тех же условиях. Осадок смешивали с 0.125 мкл 0.1% Тритона Х100, 2.5 мкл красителя йодида пропидия (PI) (“Sigma-Aldrich”) и 147.5 мкл ФСБ и выдерживали 60 мин в темноте при температуре 37˚С. Изучение индукции апоптоза (с использованием набора Annexin V-Alexa Fluor 647™ Apoptosis Detection Kit (“Thermo Fisher Scientific”, США), изменение митохондриального трансмембранного потенциала (с использованием Mitochondria Membrane Potential Kit (“Sigma-Aldrich”) и оценку уровня активных форм кислорода (АФК) (с использованием красителя CellROX® Deep Red, “Invitrogen”, США) проводили согласно стандартным протоколам, предоставленным производителями. Детекцию результатов проводили с использованием проточного цитометра Guava EasyCyte (“Merck”, США). Исследование адгезивных свойств клеток M-HeLa и Chang liver в режиме реального времени Влияние исследуемых фосфониевых солей на клетки M-HeLa в режиме реального времени изучали при помощи клеточного анализатора хCELLigence S16 Real-time Analysis System RTCA (“Acea Biosciences”, США). В оригинальные 16-луночные планшеты (E-Plate, “Acea Biosciences”) была добавлена питательная среда для определения базового уровня клеточного индекса (CI). CI представляет собой безразмерный параметр, основанный на изменениях электрического импеданса, и используется для характеристики биологического состояния клеток, таких как их количество, жизнеспособность, морфологические особенности и степень адгезии [13]. Затем в каждую лунку вносили суспензию, содержащую 5×105 клеток M-HeLa или Chang liver, и проводили измерения каждые 15 мин на протяжении 24 ч. После этого в лунки добавляли равные объемы растворов исследуемых соединений в разных концентрациях. В контрольные лунки был добавлен такой же объем питательной среды. На протяжении первых 6 ч измерения проводили каждые 30 с, а в последующие часы – каждые 15 мин. Для анализа полученных данных использовали программное обеспечение RTCA Software 2.0. Мультиплексный анализ маркеров раннего апоптоза и генотоксичности Мультиплексный анализ маркеров раннего апоптоза и маркеров повреждения ДНК/генотоксичности проводили с использованием соответствующих наборов MILLIPLEX® 7-plex Early Apoptosis Magnetic Bead Kit и MILLIPLEX® MAP 7-plex DNA Damage/Genotoxicity Magnetic Bead Kit (“Merck”) согласно стандартным протоколам производителя. Панель MILLIPLEX® 7-plex Early Apoptosis Magnetic Bead Kit позволяет определить такие маркеры как Akt (pS473), BAD (Ser112), Bcl-2 (Ser70), p53 (Ser46), JNK (Thr183/Tyr185), активные каспаза-8 (Asp384) и каспаза-9 (Asp315). Набор MILLIPLEX® MAP 7-plex DNA Damage/Genotoxicity Magnetic Bead Kit позволяет определить фосфорилированные Chk1 (Ser345), Chk2 (Thr68), H2A.X (Ser139), p53 (Ser15) а также общий уровень ATR, MDM2 and p21. Для подготовки образцов клетки инкубировали в присутствии тестируемых соединений в течение 24 ч, затем открепляли, промывали ФСБ и разрушали с использованием лизирующего буфера MILLIPLEX MAP (“Merck”), содержащего смесь ингибиторов протеаз P8340 (“Sigma”, США). Полученные лизаты клеток M-HeLa стандартизировали в соответствии с общим содержанием белка, которое измеряли с использованием реагента Бредфорда (“Bio-Rad”, США). Значения интенсивности флуоресценции детектировали с использованием системы Luminex® MAGPIX® (“Merck”). Статистическая обработка результатов Статистический анализ данных выполнен с использованием программ Past4.17 и Microsoft Office Excel 2016. Значимость различий средних значений определяли с применением U-критерия Манна-Уитни (p ≤ 0.01) с учетом поправки Бонферрони. Табличные и графические данные содержат средние значения и стандартное отклонение. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Цитотоксичность соединений in vitro Ранее нами была продемонстрирована высокая антимикробная активность исследуемых фосфониевых солей [9, 10]; соединения близкой им структуры продемонстрировали также селективность в отношении некоторых опухолевых клеточных линий [14]. В связи с этим в данной работе также были исследованы цитотоксические свойства (Z)-(2-(2-Гидрокси-5-хлорфенил)-2-фенилэтенил)алкилдифенилфосфоний хлоридов с шифрами РРR. Результаты цитотоксичности данных соединений в отношении клеточных линий человека приведены в таблице 1. Рассчитанные относительно условно-нормальных клеток Chang liver и RPMI 1788 ИС веществ представлены в таблице 2. По результатам эксперимента можно заключить, что исследованные фосфониевые соли обладают цитотоксической активностью на уровне препарата сравнения доксорубицина в отношении некоторых клеточных линий, таких как M-HeLa, HepG2, MCF-7, SK-OV-3, HuTu 80. Значения IC50 наиболее активных соединений (РР5, РР6, РР7, РР8) на этих линиях варьировали от 3.9 мкМ до 13.1 мкМ. При этом в большинстве случаев ИС протестированных фосфониевых солей оказался выше ИС Доксорубицина. Анализ результатов продемонстрировал зависимость цитотоксических свойств соединений от длины алифатического заместителя у атома фосфора, что согласуется с ранее полученными данными по антимикробной активности этих соединений, а также подтверждает данные литературы [15]. Для дальнейших исследований по изучению механизма действия было выбрано соединение РР8, как наиболее селективное в отношении модельной культуры клеток M-HeLa и большинства других протестированных клеточных линий. В последующих экспериментах фосфониевую соль РР8 использовали в двух концентрациях: 5 мкМ (концентрация, близкая к значению IC50) и 10 мкМ (заведомо высокая концентрация для модельных клеток M-HeLa).
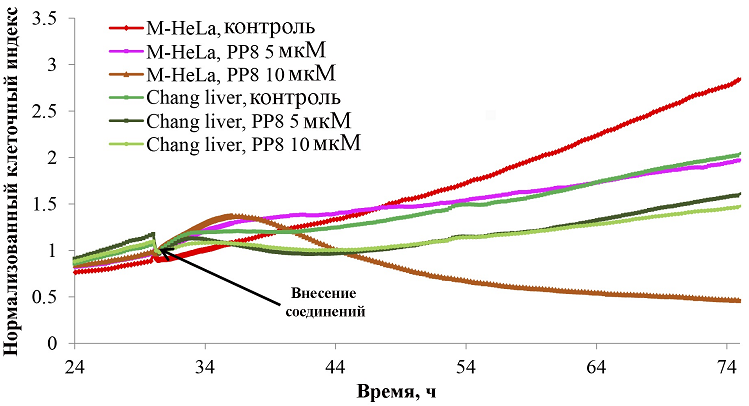
Исследование адгезивных свойств клеток M-HeLa и Chang liver в режиме реального времени Определение IC50 с помощью МТТ реагента дает информацию по цитотоксичности веществ через определенный промежуток времени (в данном случае через 24 часа). Мониторинг состояния клеточной популяции в режиме реального времени расширил понимание характера воздействия тест-соединения на эукариотические клетки. На рисунке 1 представлено изменение клеточного индекса от времени в присутствии разных концентраций РР8. По результатам видно, что его цитотоксический эффект в отношении клеток M-HeLa в концентрации 10 мкМ проявлялся уже после 6 ч воздействия. В концентрации 5 мкМ соединение проявляло преимущественно цитостатический эффект: замедляло скорость роста и деления клеток. В первые 6 ч после добавления вещества, кривая клеточного индекса поднималась выше контрольного уровня, а затем снижалась. По данным Abassi и соавт. [16] такая кривая клеточного индекса характерна для веществ, затрудняющих репликацию ДНК. Подобные соединения останавливали клеточный цикл в фазе G0/G1 [16]. В отношении гепатоцитоподобных клеток Chang liver выраженных цитотоксических свойств и значительного влияния на рост и адгезию клеток не выявлено.
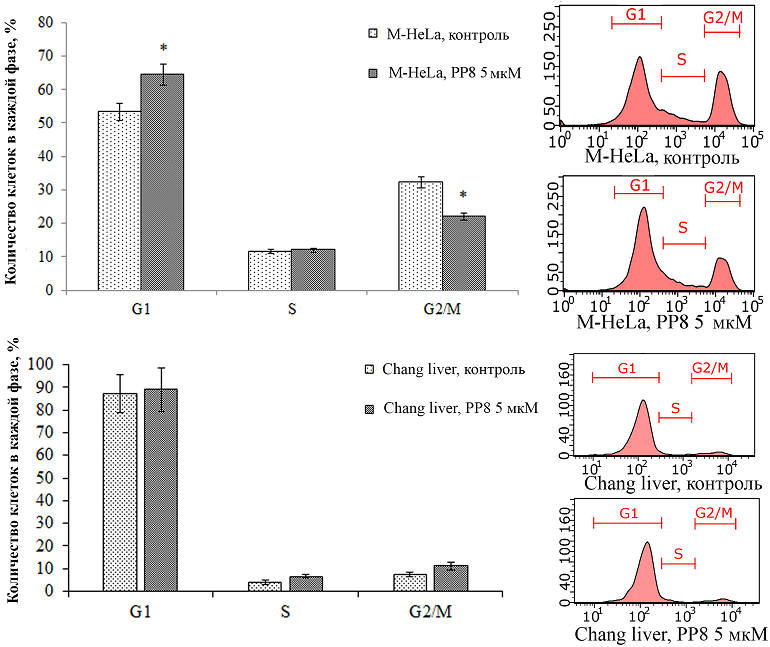
Влияние фосфониевых солей на клеточный цикл клеток M-HeLa и Chang liver По результатам проточной цитометрии клеток, окрашенных красителем PI (рис. 2) видно, что в присутствии соединений в клетках M-HeLa происходит увеличение доли клеток в фазе G1 и снижение в фазе G2/M, что подтверждает данные, полученные с помощью клеточного анализатора хCELLigence. Не было продемонстрировано влияния исследуемых фосфониевых солей на клеточный цикл Chang liver.
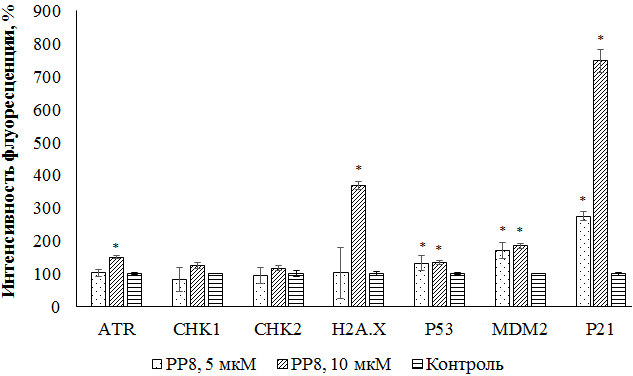
Мультиплексный анализ повреждения ДНК/ генотоксичности Литературные данные свидетельствуют о возможном взаимодействии фосфониевых солей с ДНК [17]. Для оценки влияния веществ на ДНК нами был проведен мультиплексный анализ маркеров повреждения ДНК и генотоксичности. Повреждения ДНК могут происходить в результате влияния внешних факторов (ионизирующее, ультрафиолетовое излучение, воздействие химических соединений) или эндогенного воздействия (ошибки репликации ДНК или накопления АФК) [18]. В ответ на повреждения ДНК активируются ATR и ATM-киназы, относящиеся к семейству PIKK-киназ [19]. ATR активируется в присутствии однонитевой ДНК (например, при ошибках репликации), АТМ играет ключевую роль в ответе на двухцепочечные разрывы ДНК (DSB) [20]. Такие повреждения являются наиболее опасными для клетки. Активированный АТМ фосфорилирует множество субстратов, в число которых входит и гистон H2A.X, который считается маркером двухцепочечных разрывов ДНК, так как накапливается в местах повреждений и участвует в их репарации [21, 22]. Субстратом АТМ и ATR могут являться киназы контрольных точек CHK2 и CHK1, а также опухолевый супрессор р53 [23, 24]. В результате фосфорилирования р53 белками ATR или ATM по сайту Ser15 происходит разрыв связи р53 с его отрицательным регулятором убиквитинлигазой MDM2 [25]. После чего р53 способен фосфорилировать р21, ингибитор циклин-зависимой киназы 1А, который в дальнейшем приводит к остановке клеточного цикла преимущественно при переходе из G1 фазы в S фазу [26]. В случае невозможности репарации повреждений ДНК из-за тяжелого генотоксического стресса происходит фосфорилирование р53 (Ser46) и подается сигнал для уничтожения клетки посредством программируемой клеточной гибели (апоптоза) [27]. Результаты, представленные на рисунке 3, демонстрируют увеличение уровня H2A.X в клетках M-HeLa под действием 10 мкМ РР8. При этом наблюдается рост уровня р21 и MDM2 в клетках в присутствии всех протестированных концентраций. Стоит отметить также небольшое, но достоверное увеличение уровня фосфорилированного р53 (Ser15). Данные, полученные с помощью мультиплексного анализа, свидетельствуют о затрудненной репликации ДНК и вероятном возникновении двухцепочечных разрывов ДНК в клетках, что в результате сигнальных каскадов приводит к остановке клеточного цикла.
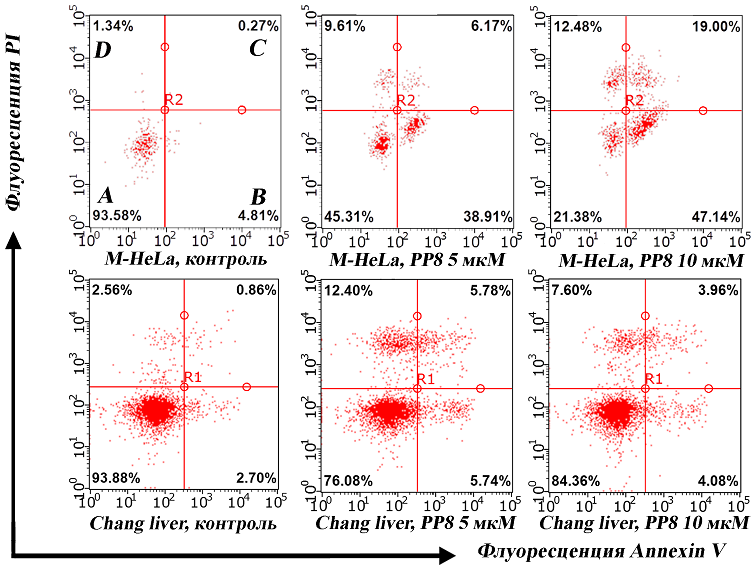
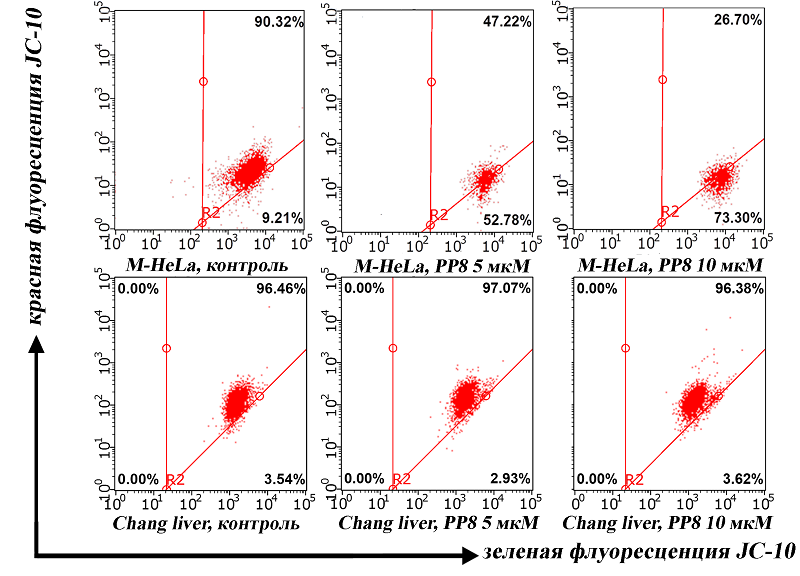
Изучение апоптоза в клетках M-HeLa и Chang liver Так как ранее нами было продемонстрировано увеличение уровня р53 в клетках в присутствии РР8, необходимо было также изучить апоптозиндуцирующее действие соединений. По результатам проведения проточной цитометрии клеток M-HeLa с использованием красителей PI и Annexin V-Alexa Fluor отмечено дозозависимое увеличение доли клеток на стадии раннего и позднего апоптоза (рис. 4). Снижение митохондриального мембранного потенциала в клетках M-HeLa под воздействием РР8 (рис. 5) не только продемонстрировало митохондриальное нацеливание веществ, но и позволило предположить возможный внутренний путь программируемой клеточной гибели. Причиной деполяризации мембраны митохондрий, вероятно, являются протонофорные свойства соединений, продемонстрированные ранее [11]. На условно-нормальных гепатоцитоподобных клетках Chang liver не было показано выраженного снижения митохондриального мембранного потенциала и индукции апоптоза.
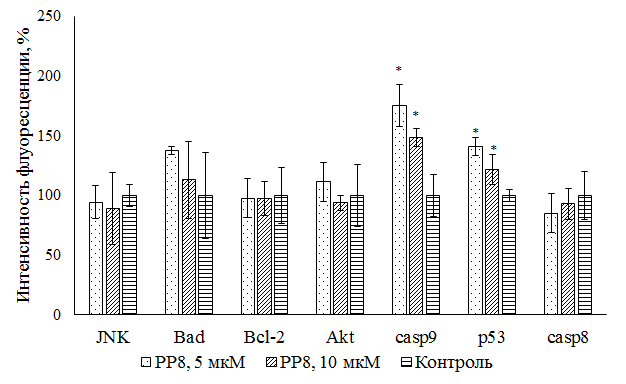
Мультиплексный анализ семи маркеров раннего апоптоза Анализ семи маркеров раннего апоптоза позволил углубиться в понимание причин и пути апоптоза, индуцированного РР8. Результаты эксперимента (рис. 6) продемонстрировали увеличение количества каспазы-9 в клетках после воздействия соединения, что свидетельствует о протекании апоптоза по митохондриальному пути. Также отмечено увеличение уровня белка р53, фосфорилированного по сайту Ser46. Такие результаты подтверждают и дополняют полученные ранее данные.
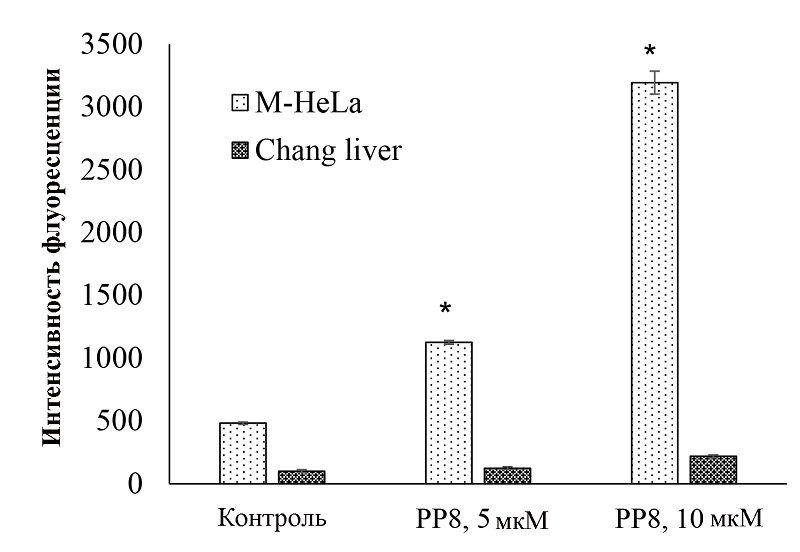
Накопление АФК в клетках M-HeLa и Chang liver АФК постоянно образуются в живой клетке, например, как продукты побочных реакций в процессе окислительного фосфорилирования. Однако накопление АФК может привести к негативным для клетки последствиям: окислению липидов, белков, нарушению структуры ДНК [28]. Ранее нами было выявлены признаки повреждения ДНК и апоптоза. Кроме того, исследуемые фосфониевые соли в своей структуре содержат фенольный фрагмент. Известно, что фенолы могут приводить к формированию АФК [29]. Методом проточной цитометрии было выявлен более высокий уровень АФК в клетках M-HeLa после воздействия соединения РР8 (рис. 7). При этом в отношении гепатоцитоподобных клеток Chang liver даже после воздействия 10 мкМ РР8 уровень АФК вырос не более чем в два раза по сравнению с интактными клетками. Раковые клетки могут быть более уязвимы к окислительному стрессу из-за того, что их уровень АФК выше, чем в нормальных клетках [30]. Полученные нами данные позволяют предположить, что избирательная токсичность в отношении некоторых раковых клеток может быть связана именно с индукцией окислительного стресса. Повышенный уровень АФК также может быть причиной повреждений ДНК и впоследствии апоптоза. Тем не менее не стоит исключать возможность и прямого взаимодействия фосфониевых солей с ДНК.
ЗАКЛЮЧЕНИЕ В результате работы была выявлена высокая цитотоксическая активность (Z)-(2-(2-гидрокси-5-хлорфенил)-2-фенилэтенил)алкилдифенилфосфоний хлоридов на уровне препарата сравнения доксорубицина в отношении клеточных линий M-HeLa, HepG2, MCF-7, SK-OV-3 и HuTu 80. Более низкая цитотоксичность была продемонстрирована на условно-нормальных клетках Chang liver и RPMI 1788. В качестве наиболее перспективного было выбрано производное РР8, имеющее октильный радикал у атома фосфора. На его примере было продемонстрировано цитостатическое действие в отношении клеток M-HeLa в концентрациях, близких к IC50 (5 мкМ). Методом проточной цитометрии были выявлены остановка клеточного цикла в фазе G1, повышенный уровень АФК, дозозависимая индукция апоптоза и снижение митохондриального мембранного потенциала. Мультиплексный анализ маркеров повреждения ДНК/генотоксичности и маркеров раннего апоптоза обнаружил достоверные увеличения уровней белков ATR, H2A.X, p53, MDM2, p21 и каспазы-9. Увеличение некоторых маркеров повреждения ДНК, обнаруженное в результате мультииплексного анализа, может быть как результатом прямого воздействия производных фосфониевых солей на молекулу ДНК, так и её вторичного повреждения в том числе в результате накопления АФК. Таким образом, протестированные фосфониевые соли могут представлять интерес в качестве основы для создания новых противоопухолевых агентов. А понимание механизма действия данных веществ позволит обозначить стратегию их возможной дальнейшей модификации. СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ Работа не связана с исследованиями, в которых в качестве объекта выступают люди или животные. БЛАГОДАРНОСТИ Мультиплексный анализ маркеров раннего апоптоза и маркеров повреждения ДНК/Генотоксичности выполнен с использованием оборудования лаборатории химико-биологических исследований Института органической и физической химии им. А.Е. Арбузова – ОСП ФИЦ КазНЦ РАН ФИНАНСИРОВАНИЕ Работа выполнена в рамках государственного задания ФИЦ КазНЦ РАН. КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов. ЛИТЕРАТУРА
|